Des coupures d`un ouvrage ancien de chimie sont retrouvées ont

Activité expérimentale N°6 : Pile et énergie
I- Comment réaliser une pile électrochimique ?
Réalisation d’une pile :
Réalise le montage suivant, constituant un élément de la pile de Volta, en plongeant 2
lames métalliques ( 1 et 2 ) dans une solution ionique ( 3 ) puis en branchant aux
bornes un ampèremètre.
Note l’intensité I débitée et la tension U en changeant les matériaux ( Cu-Cu ; Cu-Zn,
etc ) , les solutions ( eau distillée, CuSO4, sulfate de zinc, sulfate de fer, eau salée ) ...
Tu consigneras tes valeurs dans un tableau.
Exemple :
Pile 1
Pile 2
Pile 3
Solution
Cu2+, SO42-
Cu2+, SO42-
Eau distillée ou
« robinet »
Métal 1
Cu
Cu
Cu
Métal 2
Zn
Cu
Zn
Intensité I
( mA )
Tension
( V )
3ème
Thème Chimie Partie : Pile et énergie
Vous allez dans cette activité
Réaliser une pile
Décrire une conversion d’énergie
Valider ou invalider une hypothèse
Interpréter l’origine de l’énergie électrique
Durée :2 h
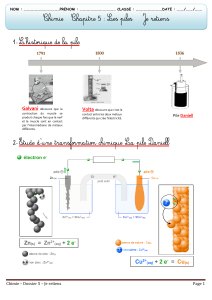
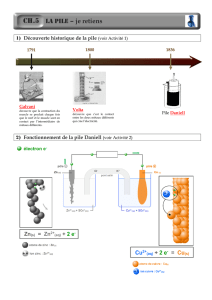
« La première pile fut réalisée par le physicien
italien Alessandro Volta en 1800.
Il alterna des pièces de cuivre et de zinc,
séparées par un tissu imbibé de saumure. A ces
bornes, une tension fut recueilli...Ainsi la
première pile chimique fut découverte ! »
A
o
u
V

Réflexion :
1. Quelles conditions doivent remplir les métaux et les solutions pour qu’un montage
génère une intensité ou tension électrique notable et constitue ainsi une PILE ?
Les métaux constituant cette pile doivent être de nature différente, la solution
doit être ionique
2. En rappelant la notion d’intensité électrique dans les METAUX et les SOLUTIONS,
émet une hypothèse sur l’origine de cette intensité débitée. ( FACULTATIF )
Les électrons sont porteurs de charges dans les métaux , en solutions ce sont les
ions qui " conduisent" l'électricité
II-La pile convertie de l’énergie ..mais sous quelles formes ?
1) Branche un petit moteur aux bornes de cette pile
i) Schématise et observe.
ii) En quelle énergie l’énergie ELECTRIQUE est-elle convertie ?
2) Branche une Del aux bornes de cette pile et observe.
i) Schématise et observe.
ii) En quelle énergie l’énergie ELECTRIQUE est-elle convertie ?
iii) Explique le terme de pile « électrochimique ».
iv) Comment vérifier qu’une partie de l’énergie est aussi convertie en « chaleur » ?
v) Représente à l’aide d’un organigramme la conversion d’énergie dont la pile est le siège
Aide :
-Aides toi de la fiche Mémo d’électricité pour symboliser les composants électriques.
-L’énergie peut prendre plusieurs formes : ELECTRIQUE, MECANIQUE, CHIMIQUE, THERMIQUE,
RAYONNANT...
III- D’où provient l’énergie électrique délivrée par la pile ?
Pour déterminer l’origine de ce courant électrique, nous allons étudier la
réaction directe entre de la poudre de zinc (solide) et une solution de sulfate
de cuivre (solution aqueuse)
Mélange dans un bécher une spatule de poudre de zinc dans 2 ou 3 cm
de solution de sulfate de cuivre contenu dans un bécher !
Agite, laisse reposer et observe
Schématise et légende l’expérience.
Après 4 minutes, verse un peu de Soude dans la solution reversée dans
un bécher. Note tes observations. Précipité blanc
Analyse :
1) Rappelle quelle est l’origine de la couleur bleue de la solution de sulfate de cuivre
La coloration Bleue est due aux ions Cu2+
En observant le milieu réactionnel en fin de réaction,
la solution est devenue incolore
un reflet cuivré apparaît
Après ajout de soude, un précipité blanc apparaît !
2)
a) dire quel réactif a été consommé ? les ions Cu2+ ont disparu du mélange
réactionnel , ils sont été consommés
b) dire quel métal s’est formé ? (les éléments sont toujours conservés au cours d’une
réaction) Du Cuivre métallique s'est formé
c) Quel ion, formé aussi au cours de la réaction, a été identifié par l’ajout de soude ?
Le précipité blanc met en évidence l'ion issu du métal zinc, càd l'ion Zn2+

3) Essaye d’écrire l’équation de réaction entre le Zn et la solution de sulfate de Cuivre
a) Avec des mots ( Réactifs Produits )
Ions Cuivre + Zinc ( s) --> Cu (s) + Ions Zinc
b) Avec des symboles
Cu2+ + Zn ( s) --> Cu (s) + Zn2+
Remarque : les ions sulfates sont spectateurs
4) Essaye d’expliquer :
a) A quoi est due l’usure d’une pile ?
La pile s'arrête qd un des 2 réactifs à disparu (Cu2+ ou Zn est entièrement
consommé )
b) Quelles réactions chimiques ont lieu lors de la recharge de cette pile ? (il s’agira
alors d’une « batterie rechargeable » et non d’une « pile » )
La réaction inverse se déroule : Cu (s) + Zn2+ --> Cu2+ + Zn ( s)
Aide : Le cuivre métallique est de couleur rouge.
Rappel sur les solutions et métaux utilisées dans ce T.P :
Métaux
Symbole
Solution
Formule
Cuivre
Cu
Sulfate de cuivre
Cu2+, SO42-
Zinc
Zn
Sulfate de zinc
Zn2+, SO42-
Plomb
Pb
Sulfate de Fer
Fe2+, SO42-
Aluminium
Al
Chlorure de sodium
Na+, Cl-
Hydroxyde de
sodium
Na+, OH-
Rappel sur les branchements d’un Multimètre
Ce que je dois retenir du TP 6 : Pile et énergie
Je sais définir :
Une pile électrochimique : constituée de 2 métaux différents plongeant dans un
électrolyte (solution ionique)
Un réactif : espèce chimique réagissante, consommée au cours d’une
transformation
Je suis capable de :
Réaliser et schématiser une pile électrochimique Cu/Zn
Réaliser la réaction directe entre la poudre de Zinc et la solution de
sulfate de cuivre
Je retiens que :
Une pile est un réservoir d’énergie chimique.
L’énergie électrique produite provient d’une transformation
chimique.
L’usure d’une pile est due à la consommation des réactifs.
Lors du fonctionnement d’une pile, l’énergie chimique est convertie en
partie en énergie ELECTRIQUE et en partie en énergie
THERMIQUE

Pense à réaliser ta carte mentale afin de mémoriser les notions essentielles !
Rappel :
Notions abordées :
TP 6 : Pile et énergie
Date :
Matériel ELEVE
Pour 2 binômes
Thermomètre électronique
Solution de sulfate de fer 1 M
Solution de sulfate de cuivre, sulfate de zinc, eau distillée, eau salée...
Par 1 binôme

Lame de Cu et Zn ( 2 ) et Al , Pb.... + système de tenue+ béchers
3 pots
Pinces crocos 2 + fils 2
Multimètre
Moteur
Del
Poudre de zinc
Solution de soude O,1 M
1
/
5
100%