Scarica PDF

Choriomon
Composition
Principe actif: gonadotropinum chorionicum (hCG, gonadotrophine chorionique d'origine humaine,
extraite d'urine humaine; provenance de l'urine: République Populaire de Chine).
Excipient: lactosum monohydricum.
Solvant: natrii chloridi solutio.
Forme galénique et quantité de principe actif par unité
Poudre lyophilisée contenant 500/1000/2000/5000/10'000 UI d'hCG par flacon.
Une ampoule de solvant pour la préparation de la solution à injecter contient 1 ml de solution de
chlorure de sodium 0,9%.
Indications/Possibilités d'emploi
Choriomon est indiqué lorsque la fonction des glandes génitales doit être activée; son succès
thérapeutique dépend de la capacité fonctionnelle des glandes génitales. Les cas d'hypersécrétion
de gonadotrophines, qui indiquent une insuffisance primaire irréversible des glandes sexuelles ou
des anomalies organiques incompatibles avec la fertilité, sont réfractaires au Choriomon.
Chez la femme
Déclenchement de l'ovulation après un traitement de stimulation de la maturation folliculaire à
l'aide d'hMG (gonadotrophine humaine de la ménopause, ménotropine) ou de FSH (hormone
folliculostimulante, urofollitrophine) dans les états de stérilité fonctionnelle suivants:
aménorrhée primaire;
aménorrhée secondaire persistante;
anovulation chronique.
De plus, Choriomon est indiqué dans la stérilité due à un raccourcissement de la phase lutéale du
cycle, car il provoque un retard du saignement menstruel et une prolongation de la phase
d'épanouissement du corps jaune et, par conséquent, de meilleures conditions pour la nidation.
Chez les patientes atteintes d'une aménorrhée persistante ou d'une anovulation chronique, un
traitement par l'hMG/(FSH)/hCG n'est indiqué que lorsqu'un test à la progestérone résulte négatif
ou lorsque des traitements répétés par des agents stimulateurs de l'ovulation plus faciles à manier
(p.ex. clomiphène) sont restés sans succès.

Chez l'enfant et l'homme
Cryptorchidie, hypogonadisme hypogonadotrope, retard de la puberté.
Un traitement de la cryptorchidie par Choriomon n'a de chances de succès qu'en l'absence de
lésions congénitales ou primaires des testicules ou d'obstructions anatomiques.
Dans l'hypogonadisme hypogonadotrope, Choriomon est surtout indiqué dans l'eunuchoïdisme
hypogonadotrope dû à une insuffisance diencéphalo-hypophysaire, dans laquelle le tissu
testiculaire reste au stade de développement prépubertaire.
L'association à un traitement avec de la gonadotrophine ménopausique (hMG) permet aussi de
stimuler la fonction tubaire des testicules et d'éventuellement obtenir la fertilité.
Posologie/Mode d'emploi
Choriomon doit toujours être injecté par voie intramusculaire. La solution des gonadotrophines doit
être préparée juste avant l'injection à l'aide du solvant joint à chaque emballage. La solution ne se
conserve que durant un temps limité. Toute solution non utilisée doit être éliminée.
Chez la femme
Aménorrhée primaire, aménorrhée secondaire persistante, anovulation chronique: si les organes
génitaux sont considérablement sous-développés, il est nécessaire de procéder à un traitement
préliminaire pendant plusieurs mois avec une association estroprogestative, dans le but de
stimuler la croissance et l'irrigation sanguine de l'utérus, des trompes et du vagin.
L'application des gonadotrophines se fait en deux phases:
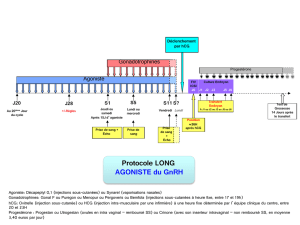
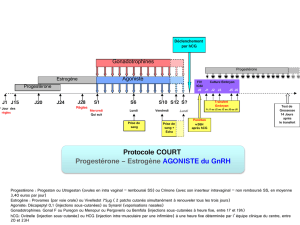
1ère phase: injection quotidienne i.m. de gonadotrophine ménopausique (hMG) ou d'urofollitrophine
(FSH) pendant 7?12 jours, à la dose de 75 U.I., jusqu'au moment où l'augmentation des
oestrogènes, l'ultrasonographie et les modifications du facteur cervical indiquent l'existence d'un
follicule mûr (oestradiol plasmatique 1,1?2,9 pmol/ml = 300?800 pg/ml; diamètre du follicule
dominant 18?22 mm; score cervical selon Insler ?8 points sur 12).
2ème phase: afin de déclencher l'ovulation, on injecte 24 à 48 heures après la dernière
administration d'hMG (ou de FSH) une seule dose de 5000 à 10'000 U.I. de Choriomon i.m.;
l'ovulation se produit en général 32 à 48 heures plus tard. On recommandera à la patiente d'avoir
des rapports tous les jours à partir du jour précédant l'administration de Choriomon et jusqu'à ce
que l'ovulation soit mise en évidence. Si aucune grossesse ne survient, on peut répéter le
traitement selon le même schéma. Pour de plus amples détails, il est recommandé de consulter
des «Informations professionnelles pour le médecin» d'une préparation d'hMG ou de FSH.
Stérilité due au raccourcissement de la phase lutéale du cycle: 5000 U.I. de Choriomon i.m. le 21ème
, 23ème et 25ème jour du cycle.
Chez l'enfant et l'homme
Cryptorchidie: le traitement devrait avoir lieu avant l'âge de deux ans, car plus tard la position
anormale du testicule provoque des lésions irréversibles qui s'aggravent avec le temps. Par contre,
il est déconseillé de commencer une thérapie hormonale avant l'âge de 6 mois, car souvent une
Copyright

le traitement devrait avoir lieu avant l'âge de deux ans, car plus tard la position
anormale du testicule provoque des lésions irréversibles qui s'aggravent avec le temps. Par contre,
il est déconseillé de commencer une thérapie hormonale avant l'âge de 6 mois, car souvent une
descente spontanée des testicules est encore possible.
Le traitement préconisé a une durée de 5 semaines (10 injections), selon le schéma suivant:
Age
6?12 mois: 2 fois par semaine 250 U.I. i.m.;
1?6 ans: 2 fois par semaine 500 U.I. i.m.;
au dessus de 6 ans: 2 fois par semaine 1000 U.I. i.m.
Si le traitement se solde par un échec ou n'aboutit qu'à un succès partiel, il peut être répété après
2?3 mois (éventuellement après 6 mois). Si après le deuxième traitement le succès n'est pas
atteint, on aura recours à une intervention chirurgicale.
Retard de la puberté: lorsqu'à l'âge de 15 ans la puberté ne s'est pas encore instaurée, on peut
stimuler le processus de maturation des glandes sexuelles par un traitement avec Choriomon, qui
favorise le début de la puberté et la formation des caractéristiques somatiques de la maturité
sexuelle.
Posologie: 2 fois par semaine 1000 U.I. i.m. pendant 8?12 semaines.
Traitement à répéter, si nécessaire, après 3 mois.
Hypogonadisme hypogonadotrope: en général, le traitement débute avec une posologie de 500 à
1000 U.I. de Choriomon i.m. tous les 2 jours pendant 4 à 6 semaines, afin de porter les cellules de
Leydig à pleine maturité. Par la suite, 500 U.I. de Choriomon sont administrées en association
avec 75 U.I. d'hMG i.m., 2 à 3 fois par semaine pendant 3 mois ou plus.
Pour contrôler la réponse au traitement, on effectuera un spermogramme au moins une fois par
mois. Lorsque la spermatogenèse sera induite, il sera possible dans certains cas de continuer le
traitement avec Choriomon seul à raison de 5000 U.I. par semaine.
Si la stérilité est due à un hypogonadisme secondaire, il est préférable, pour fortifier et maintenir
l'aspect viril, d'avoir recours à une thérapie substitutive avec un androgène.
Contre-indications
Chez la femme
Grossesse.
Stérilité due au manque de la maturation folliculaire normale (p.ex. d'origine tubaire ou cervicale),
sauf si la patiente participe à un programme de procréation médicalement assistée.
Kystes ovariens qui ne sont pas à reconduire au syndrome des ovaires polykystiques.
Hémorragies gynécologiques d'étiologie inconnue.
Hyperprolactinémie.
Carcinome de l'ovaire, de l'endomètre ou du sein.
Copyright
©

Chez l'homme
Infertilité qui n'est pas due à l'hypogonadisme hypogonadotrope.
Tumeurs androgènodépendantes, telles que le carcinome de la prostate ou de la glande
mammaire.
Chez l'homme et la femme
Hypersensibilité connue à l'hCG ou autres gonadotrophines (hMG, FSH), hyperprolactinémie,
carcinomes de l'hypophyse ou de l'hypothalamus, endocrinopathies d'origine thyroïdienne ou
surrénale non traitées.
Mises en garde et précautions
Un traitement par des hormones gonadotropes ne devrait être entrepris que par un médecin
spécialiste expérimenté dans le diagnostic et le traitement des troubles de la fertilité et après
exclusion de toute autre cause d'infertilité (mécanique, immunologique ou andrologique).
Chez la femme
Choriomon ne doit être administré qu'en âge de maturité sexuelle, car avant la puberté il pourrait
provoquer une stimulation indésirable des ovaires.
Après la ménopause par contre, l'ovaire n'est plus sensible aux gonadotrophines.
Avant le début d'un traitement par l'hMG/(FSH)/hCG, la patiente doit être soumise à un examen
gynécologique et endocrinologique approfondi. Le potentiel de fertilité du partenaire doit être
évalué et la patiente et son partenaire devraient être informés qu'un tel traitement comporte le
risque d'une hyperstimulation ovarienne, ainsi qu'un risque accru d'une grossesse multiple ou d'un
avortement spontané. Le traitement exige la disponibilité d'une infrastructure clinique adéquate.
Chez 5?6% des patientes traitées par des hormones gonadotropes, une hyperstimulation
ovarienne se produit, le plus souvent 7 à 10 jours après l'administration de l'hCG. Le risque d'une
hyperstimulation est particulièrement élevé chez des patientes ayant des ovaires polykystiques
(anovulation hyperandrogénique chronique). La marge thérapeutique entre une posologie
suffisante et une hyperstimulation est restreinte.
Afin de réduire le risque d'une hyperstimulation au minimum, la patiente doit être soumise à un
examen endocrinologique et clinique au moins tous les deux jours pendant toute la durée du
traitement et pendant les 2 semaines suivant son interruption. Si les dosages d'hormones
démontrent une réaction oestrogénique exagérée (oestradiol plasmatique +100% en 2 ou 3 jours
et/ou taux >4 pmol/ml/>1100 pg/ml) ou si des signes cliniques ou ultrasonographiques devaient
indiquer une hyperstimulation ovarienne (diamètre d'un ou de plusieurs follicules <22 mm), le
traitement par l'hMG (ou FSH) doit être suspendu immédiatement. L'injection d'hCG est strictement
contre-indiquée dans ces cas.
L'hyperstimulation ovarienne est caractérisée par une forte augmentation de la perméabilité
vasculaire qui provoque une accumulation rapide de liquide dans la cavité péritonéale, le thorax et
le péricarde. Le plus souvent, elle se manifeste 5?10 jours après l'administration de l'hCG et l'on
distingue 3 degrés de gravité: légère, moyenne et grave.
Copyright
©
2013

Lors d'une hyperstimulation légère (degré I), avec léger agrandissement des ovaires (grandeur 5 à
7 cm), sécrétion excessive de stéroïdes et inconfort abdominal, une thérapie n'est pas nécessaire,
mais la patiente devrait être informée et mise sous contrôle attentif. Lors d'une hyperstimulation
moyenne (degré II), avec kystes ovariens (grandeur des ovaires de 8 à 10 cm), symptomatologie
abdominale, nausées et vomissements, une surveillance clinique et un traitement symptomatique
sont indiqués; également, en cas d'hémoconcentration prononcée une substitution intraveineuse
de plasma est indiquée.
Une hyperstimulation grave (degré III, fréquence <2%), caractérisée par de grands kystes ovariens
(grandeur des ovaires >12 cm), ascite, hydrothorax, forte distension abdominale, douleurs
abdominales, dyspnée, rétention de sel, hémoconcentration, augmentation de la viscosité
sanguine et de l'agrégation plaquettaire, peut mettre en danger la vie de la patiente et demande un
traitement en milieu hospitalier, afin de stabiliser les fonctions vitales et de rétablir le volume
plasmatique, la perfusion rénale et l'équilibre des électrolytes.
Chez les patientes dont l'aménorrhée est due à un syndrome de Stein-Leventhal, des kystes
ovariens peuvent se former. Ils provoquent des douleurs pelviennes d'intensité variable et
nécessitent l'interruption du traitement.
Des grossesses multiples se produisent chez environ 20% des patientes traitées par des
gonadotrophines. Dans la grande majorité de ces cas, les conceptions multiples sont gémellaires.
Le risque de grossesses multiples lors d'un protocole de procréation médicalement assistée est lié
au nombre d'ovocytes prélevés et d'embryons implantés.
Le taux des avortements spontanés est plus élevé que ceux observés dans la population générale,
mais il est comparable à celui que l'on observe chez les femmes avec d'autres problèmes de
fertilité. Il y a aussi un risque plus élevé de grossesses extra-utérines, surtout chez les patientes
avec des antécédents de pathologies tubaires.
Chez l'homme
Chez les patients porteurs d'un syndrome de Klinefelter avec concomitante augmentation de
gonadotrophines excrétées par l'urine, le traitement par Choriomon est inefficace. Lors du
traitement d'hypogonadisme et d'eunuchoïdisme hypogonadotrope, surtout chez de jeunes
patients, il faudra effectuer des contrôles cliniques et endocrinologiques, afin d'éviter un
développement exagéré des testicules. Si des signes d'une puberté précoce se manifestent, le
traitement devra être suspendu. Afin d'éviter une éventuelle désensibilisation des cellules de
Leydig à la suite d'un traitement par l'hCG, on contrôlera les taux de testostérone pendant toute la
durée du traitement et l'on ajustera la posologie en fonction de ces taux.
Interactions
Aucune interaction avec d'autres médicaments n'est connue à ce jour.
Grossesse/Allaitement
Des études contrôlées sur l'animal ou chez la femme enceinte ne sont pas disponibles.
L'administration d'hCG en tout début de grossesse en cas d'insuffisance lutéale ou après ponction
folliculaire et transfert d'embryon améliore le développement de l'endomètre dans la phase de
péri-implantation. Il n'y a pas d'indication pour l'hCG allant au-delà de cet emploi.
Copyright
©
2013
IBSA
 6
6
 7
7
 8
8
1
/
8
100%