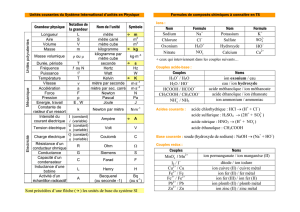
Chimie, Chapitre 5

- 1/4 -
Chimie, Chapitre 5 PREMIERE S.
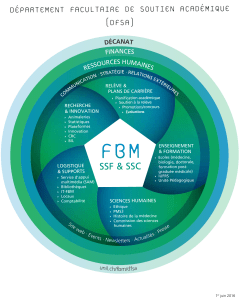
REACTIONS D’OXYDOREDUCTION
I – OXYDANTS ET REDUCTEURS
1°) Définitions
2°) Couples oxydant/réducteur
Ex : Ag+(aq) / Ag (s) ; Cu2+(aq) / Cu (s) ; Fe3+(aq) / Fe2+(aq) , I2(aq)/I-(aq)
3°) Demi-équation d’oxydoréduction ou demi-équation électronique
Couple ion métallique/métal Mn+(aq)/M(s) a pour demi-équation électronique :
Ex : - Couple ion argent(I)/métal argent Ag+/Ag(s) :
- Couple ion fer(II)/métal fer Fe2+/Fe(s)
- Couple ion cuivre/métal cuivre Cu2+/Cu(s)
Couple ion métallique/ion métallique
Ex : Couple Fe3+/Fe2+ :
Couple ion hydrogène/dihydrogène H+/H2 :
Couple diiode/ion iodure I2/I- :
Couple ion tétrathinate/ion thisulfate
)aq(OS/)aq(OS 2
32
2
64
:
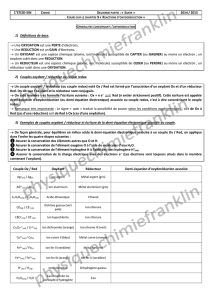
4°) Méthode pour établir une demi-équation d’oxydoréduction en milieu
acide
Remarque : Les ions H+ sont fournis par un acide que l’on a ajouté (ex : acide sulfurique)

- 2/4 -
Exemples :
Couple ion permanganate/ion manganèse(II)
2
4Mn/MnO
en milieu acide :
Couple dioxygène / eau oxygénée O2 (g) / H2O2 (aq) :
ion dichomate orange / ion chrome (III) vert Cr2O7 2-(aq) / Cr3+(aq) :
II – REACTIONS D’OXYDOREDUCTION
1°) Qu’est ce qu’une réaction d’oxydoréduction
Remarque : Deux oxydants ne réagissent pas ensemble et deux réducteurs ne réagissent pas ensemble.
2°) Comment établir l’équation d’une réaction d’oxydoréduction
3°) Exemples de réaction d’oxydoréduction
On fait réagir le métal cuivre sur l’ion argent (I). Il y a transfert d’électrons du réducteur Cu(s) à
l’oxydant Ag+(aq).
On fait réagir le métal fer sur l’ion cuivre (II). Il y a transfert d’électrons du réducteur Fe(s) à l’oxydant
Cu2+(aq)

- 3/4 -
L’éthanol C2H6O(aq) est l’alcool contenu dans les vins, les apéritifs..…. C’est le réducteur conjugué de
l’acide éthanoïque (ou acide acétique) CH3COOH(aq).
1°) Etablir, à partir des demi-équation électroniques, l’équation de la réaction qui se produit entre
l’éthanol et les ions dichromate du couple Cr2O7 2-(aq) / Cr3+(aq) en milieu acide.
2°) Cette réaction a lieu dans les alcootests. Si l’haleine d’un automobiliste contient des vapeurs d’alcool,
quel sera le changement de couleur observé ?
III - OXYDANTS ET REDUCTEURS DANS LA CLASSIFICATION PERIODIQUE
La position des éléments dans la classification périodique permet de prévoir leur caractère oxydant ou
réducteur. On distingue les métaux des non-métaux. (cf doc 9 p.119)
Exemple :
L’élément aluminium Aℓ (Z=13) est dans la colonne III principale de la classification.
Ecrire sa structure électronique :
Selon la règle de l’octet, un atome d’aluminium va ………………… électrons pour donner l’ion
………….………
Le métal aluminium est donc un …………………. puisqu’il peut ……………. facilement
……….…..………..
Compléter la demi-équation électronique : Aℓ (s) =
Exemples :
L’élément iode I est dans la colonne ……. principale de la classification.
L’atome d’iode possède ……. électrons périphériques, il a tendance à ………………. électron selon la
règle de l’octet.
Le diiode I2 est donc un …………………….. puisqu’il peut ………………. facilement ……………..
pour donner l’ion ……………………
Compléter la demi-équation électronique : I2 (aq)
Le dioxygène O2 peut de même ………….………… électrons pour donner de l’eau.
Compléter la demi-équation électronique : O2 (g)

- 4/4 -
IV – OXYDANTS ET REDUCTEURS CONTENUS DANS DES « PRODUITS » DE
LA VIE COURANTE
De nombreux « produits » utilisés dans la vie quotidienne contiennent des oxydants et des réducteurs.
Où les trouve-t-on ?
Oxydant
Réducteur
Dans l’alimentation
acide ascorbique ou vitamine
C C6H8O6 (aq)
Dans les cosmétiques
le peroxyde d’hydrogène H2O2 (aq) de l’eau
oxygénée
Dans le domaine médical et
paramédical
- l’ion hypochlorite CℓO-(aq) de l’eau de
Javel ;
- le peroxyde d’hydrogène H2O2 (aq) de l’eau
oxygénée ;
- l’ion permanganate MnO4-(aq) d’une
solution de permanganate de potassium ;
- le diiode I2 de la solution antiseptique le
Lugol®
Dans les « produits » ménagers
l’ion hypochlorite CℓO-(aq) de l’eau de Javel
VI – COMPARAISON ENTRE REACTION ACIDO-BASIQUE ET REACTION
D’OXYDOREDUCTION
Type de réaction
Particule échangée
Demi-équation
Acido-basique
Oxydoréduction
1
/
4
100%