2. Étude du pouvoir oxydant

BEP CSS – L’eau de javel - 1/3
BEP CSS
L’eau de javel
1. Étude de documents
Préciser la précaution à respecter lors de l’utilisation de l’eau de Javel.
Ne pas mélanger avec d’autres produits
Nommer le gaz dangereux susceptible de se dégager en cas de mauvaise utilisation de l’eau de Javel.
Le chlore ou dichlore
Les propriétés chimiques de l’eau de Javel sont dues à un ion particulier. Lequel ?
L’ion hypochlorite CLO–
Préciser son action.
Il oxyde ; il est oxydant ; etc…
À la manufacture des produits chimiques qui était installée sur
le site de l'actuel quartier de Javel, Berthollet fabriqua en 1790
l'hypochlorite de potassium (K+ + ClO–) qui reçut dès sa
naissance le nom d'eau de Javel.
C'est au début du 19ème siècle que le pharmacien Labarraque
mit au point une «liqueur» qui n'était en fait que de
l'hypochlorite de sodium (Na+ + ClO–).
L'eau de Javel ou solution d'hypochlorite de sodium diluée, est
un produit industriel très important en raison notamment de
son pouvoir chlorant et oxydant.
Source : http://perso.wanadoo.fr/hydroland/Javel01.htm
L’eau de javel tue 100% des microbes et
bactéries (à ce jour, aucune souche
microbienne résistant à l’eau de Javel n’a été
trouvée).
Attention ! Ne pas utiliser en combinaison
avec d’autres produits : des gaz
dangereux (chlore) peuvent se libérer.
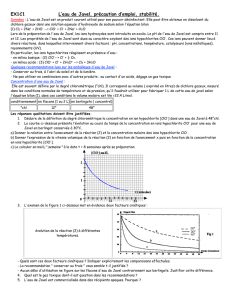
Classification de quelques couples oxydoréducteurs :
Pouvoir oxydant croissant
Al3+
Zn2+
Fe2+
H+
Cu2+
Fe3+
Ag+
Cl2
Au3+
ClO–
│
│
│
│
│
│
│
│
│
│
│
│
│
│
│
│
│
│
│
│
Al
Zn
Fe
H2
Cu
Fe2+
Ag
Cl–
Au
Cl2
Pouvoir réducteur croissant
Un entretien avec l’eau de Javel demande un essuyage parfait
surtout quand celle-ci est utilisée pour nettoyer des pièces en
fer ou en inox (évier par exemple).
En effet, l’eau de Javel oxyde le fer et le transforme en oxyde
de fer, c’est à dire en rouille.

BEP CSS – L’eau de javel - 2/3
2. Étude du pouvoir oxydant
2.1. Manipulation
Réaliser les deux expériences présentées ci-dessous :
Boucher les tubes avec un bouchon et renverser plusieurs fois.
Noter vos observations.
– il ne se passe rien
– la solution perd sa couleur bleue
– le fer prend une couleur rouge-marron foncé
Récupérer les filtrats de chacun des tubes à essais et y ajouter quelques gouttes de soude.
Noter vos observations.
– il se forme un précipité vert
– il se forme un précipité vert
Compléter les textes ci-dessous.
sulfate de fer
+
poudre de cuivre
→
pas de réaction
sulfate de cuivre
+
poudre de fer
→
sulfate de fer
+
poudre de cuivre
Écrire l’équation de la réaction (Cu2+ + SO42–) + Fe → (Fe2+ + SO42–) + Cu
Remarque : les ions SO42– sont spectateurs.
2.2. Interprétation
Il se produit en fait deux réactions simultanément.
– Réaction concernant le cuivre
Compléter l’écriture ci-contre : Cu2+ + 2e–→ Cu
– Réaction concernant le fer
Compléter l’écriture ci-contre : Fe → Fe2+ + 2e–
2.3. Définitions
Une oxydation est une perte d’électron(s)
Compléter :
oxydation
Fe
→
Fe2+ + 2e–
Fe
Cu2+
Cu2+
Fe
est oxydé
est réduit
est l’oxydant
est le réducteur
réduction
Cu2+ + 2e–
→
Cu
oxydoréduction
Fe + Cu2+
→
Fe2+ + Cu
On définit alors deux couples oxydoréducteurs (aussi appelés couples redox) : Fe2+ / Fe et Cu2+ / Cu
2.4. Utilisation de la classification des couples oxydoréducteurs
La classification présentée sur la page 1/3 permet de prévoir la réaction qui se déroule pour deux couples
d’oxydoréducteurs.
L’oxydant le plus fort réagit avec le réducteur le plus fort
Prévoir la réaction qui se produit entre les couples Zn2+ / Zn et Fe2+ / Fe.
Proposer une manipulation pour vérifier votre hypothèse.
Fe2+ + SO42–
Cu
Cu2+ + SO42–
Fe

BEP CSS – L’eau de javel - 3/3
POC
Fe2+
Fe
oxydation
Zn
→
Zn2+ + 2e–
Zn
Fe2+
Fe2+
Zn
est oxydé
est réduit
est l’oxydant
est le réducteur
réduction
Fe2+ + 2e–
→
Fe
Zn2+
Zn
PRC
oxydoréduction
Zn + Fe2+
→
Zn2+ + Fe
On place de la poudre de zinc dans un tube à essais contenant une solution de sulfate de fer.
CHACUN APPLIQUERA LA MÉTHODE GAMMA OU LA MÉTHODE CI-DESSUS.
3. Application
1ère application :
action de l’eau de Javel sur le fer métal.
Écrire ci-dessous les deux couples redox mis en jeu.
Écrire la demi-équation correspondant au couple Fe2+/ Fe (l’écriture de l’autre demi-
équation est plus compliquée et n’est pas à votre programme).
Fe → Fe2+ + 2 e–
Préciser s’il s’agit d’une oxydation ou d’une réduction.
Il s’agit d’une perte d’électron, donc d’une oxydation.
Proposer et réaliser la manipulation correspondante.
2ème application :
L’eau de Javel contient des ions hypochlorite ClO– et des ions chlorure Cl–. Si le milieu est acide, ces deux ions
réagissent entre eux.
Écrire ci-dessous les deux couples redox mis en jeu.
Écrire la demi-équation correspondant au couple Cl– / Cl2 (l’écriture de l’autre demi-
équation est plus compliquée et n’est pas à votre programme).
2 Cl– → Cl2 + 2 e–
Préciser s’il s’agit d’une oxydation ou d’une réduction.
Il s’agit d’une perte d’électron, donc d’une oxydation.
Indiquer le nom du gaz qui se dégage et pourquoi il est dangereux d’utiliser l’eau de javel avec un produit acide.
– Le gaz qui se dégage est le dichlore, gaz extrêmement toxique.
– La réaction ne se produit que si le milieu est acide.
L’eau de javel a des propriétés désinfectantes très importantes car elle contient un oxydant très puissant :
– l’ion hypochlorite ClO–
POC
ClO–
Cl2
Fe2+
Fe
PRC
POC
ClO–
Cl2
Cl2
Cl–
PRC
1
/
3
100%