methodes d`etudes de la cellule

TECHNIQUES D’ETUDES DE LA CELLULE
Introduction
L’organisation interne des systèmes biologiques est pour l’essentiel inaccessible à l’œil nu.
Au 16eme siècle, les premières utilisations de lentilles grossissantes à des fins d’observation
de structures biologiques, notamment par LEEWENHOEK, ont permis de définir l’entité
biologique élémentaire : la cellule.(cellula en latin petite chambre). Les perfectionnements de
la microscopie optique ont ainsi permis des observations de structures grandes de quelques
micromètres à quelques millimètres . Puis l’avènement de la microscopie électronique a affiné
ces observations ; on accède à des dimensions de l’ordre du nanomètre.
TECHNIQUES D’OBSERVATION
(première partie)
A. LES INSTRUMENTS D’OBSERVATION : LES MICROSCOPES
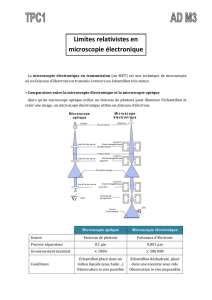
1 . LA MICROSCOPIE OPTIQUE :
Principe : les préparations sont éclairées par la lumière visible, soit par dessus (microscopie de
réflexion) ,soit par dessous ( microscopie de transmission) . Dans ce dernier cas, les
préparations sont suffisamment fines pour laisser passer la lumière.
Des variantes en sont : - la microscopie polarisée : on intercale sur le faisceau lumineux un
système de polarisation . Celui-ci crée des teintes artificielles qui peuvent révéler certains
détails de la structure des objets observés, non repérables en lumière blanche. Très
couramment utilisée en minéralogie, cette technique est également utilisée pour l’étude des
polymères biologiques ( cellulose des parois végétales par exemple) ou des structures
minéralisées (os par exemple).
- la microscopie par contraste de phase : le système optique est
conçu de façon à exploiter la diffraction des rayons lumineux par
la préparation . Ainsi , les structures observées apparaissent en
relief. On l’utilise fréquemment pour l’observation vitale de
cellules animales.
2. LA MICROSCOPIE ELECTRONIQUE :
Principe : la microscopie optique ne permet pas d’accéder à des détails inférieurs à quelques
dixièmes de micromètres . En effet, le pouvoir de résolution d’un microscope est fonction de
la longueur d’onde du rayonnement véhiculant l’information. En diminuant la longueur
d’onde , on augmente le pouvoir de résolution de l’appareil . D’où l’idée d’utiliser un faisceau
d’électrons (rayonnement de faible longueur d’onde ) ; ces particules présentent l’intérêt
d’être faciles à obtenir , d’être facilement accélérer par un champ électrostatique, et d’être
déviées par un champ magnétique comme le font les rayons lumineux au travers d’une
lentille.
Le faisceau d’électrons traverse l’échantillon étudié et atteint un écran fluorescent qui
s’éclaire plus ou moins suivant le degré d’absorption des électrons par l’échantillon.
L’observateur regarde au travers d’oculaires cet écran. Les clichés obtenus ne sont donc pas
des photographies , mais des électronographies.
On dira qu’une structure apparaissant en sombre est dense aux électrons, alors qu’une
structure très claire sera transparente aux électrons.

Des variantes en sont : - la microscopie électronique par transmission (MET) le faisceau
d’électrons traverse l’échantillon. L’image est due à l’absorption différentielle des électrons
par les différentes structures de l’échantillon.
- la microscopie électronique à balayage (MEB) : l’objet observé
est massif et est bombardé d’électrons. Les électrons incidents ne le traversent pas mais ils le
pénètrent et subissent des chocs avec les atomes qui provoquent l’émission de rayons X , et
d’électrons secondaires. Ces rayonnements réémis sont analysés et fournissent une image en
trois dimensions de l’objet étudié.
B. LA PREPARATION DES CELLULES :
1. L’OBSERVATION DE CELLULES VIVANTES :
Celle-ci n’est possible qu’en microscopie optique. La microscopie électronique ne
permet pas de réaliser des observations vitales. On utilise fréquemment des colorants
vitaux ( ex : rouge neutre pour les cellules végétales) qui n’altèrent pas le
fonctionnement cellulaire.
2. L’OBSERVATION DE CELLULES MORTES :
C’est le cas de la plupart des observations d’histologie végétale, puisque les
caractéristiques de la paroi des cellules suffisent à caractériser un tissu. Cependant,
quand il s’agit d’observations de cellules complètes (végétales ou animales), et qu’il
s’agisse de microscopie optique ou électronique, tuer les cellules revient à les fixer :
la fixation est la première étape d’une observation de cellules mortes.
a) la fixation : les préparations de microscopie électronique sont fixées au tétroxyde
d’osmium. On peut également accentuer, voire créer des contrastes.
b) la création de contrastes :
) technique du contraste positif : on fixe des atomes métalliques
denses aux électrons sur les structures cellulaires que l’on souhaite observer . A l’observation,
celles-ci apparaissent opaques dans un environnement transparent : le contraste obtenu est
positif. Le métal utilisé peut être intégré au fixateur : c’est le cas de l’osmium du tétroxyde
d’osmium.
) technique du cryodécapage : il s’agit d’obtenir, grâce à l’action du
froid, des coupes de cellules ou d’organites selon des surfaces non planes, dont les
irrégularités correspondent à des détails structuraux. La technique comprend trois étapes .
(i) la congélation : l’objet vivant est congelé très rapidement, de
façon à éviter la formation de cristaux de glace (qui lèseraient
les structures fines ) par immersion dans l’azote liquide. La
température s’abaisse d’une centaine de degrés en moins
d’une seconde.
(ii) L’obtention de la surface : la préparation est placée sous vide
à –100°C. Dans ces conditions, l’objet se fracture, lorsqu’on
le coupe , suivant des surfaces de faible résistance : c’est la
cryofacture. Quand la surface est enrobée de glace ( par
exemple des restes de milieu hyaloplasmique), la sublimation
de la glace accentue le relief : c’est le cryodécapage.

(iii) Réalisation d’une réplique : on projette obliquement des
atomes de platine qui recouvrent inégalement la surface, dont
on obtient ainsi une réplique ombrée. Cette réplique est alors
recouverte d’un dépôt de carbone, transparent aux électrons,
de façon à lui donner une rigidité suffisante. Puis , l’objet est
dissous.
TECHNIQUES CONDUISANT A DES DONNEES D’ORDRE FONCTIONNEL
(deuxième partie)
A. ETUDE FONCTIONNELLE « IN SITU »
1. CYTOCHIMIE
Certaines réactions chimiques spécifiques peuvent être effectuées à l’échelle cellulaire .
Elles sont réalisées sur blocs ou sur coupes avant ou après la fixation.
Exemple : mise en évidence des polysaccharides
Le principe de cette réaction se ramène à rendre visible sur les ultra-coupes certaines
fonctions chimiques portées par les oses. Dans ce cas précis, il s’agit de mettre en évidence
les groupements aldéhydes par une oxydation particulière ( technique de Thiery)

Tous les grands groupes chimiques ne peuvent pas être mis en évidence sur ultra-coupes avec
autant de facilité ; certains (les lipides par exemple ) n’étant pas caractérisés par un ou
plusieurs groupements chimiques réactionnels, d’autres techniques seront nécessaires.
2. EXTRACTION SELECTIVE
On peut par exemple digérer un constituant cellulaire à l’aide d’une enzyme hydrolytique
ou l’extraire par un solvant spécifique.
Exemple : action ménagée d’une amylase
Après incubation à 37°C (température optimale) et à pH 7,2 , les échantillons sont fixés ,
inclus , puis coupés . C’est une digestion enzymatique permettant de localiser « in situ » un
composé chimique particulier l’amidon.
Exemple : extraction de lipides de réserve ou lipides neutres par le chloroforme
L’action de solvants , le chloroforme en particulier , va permettre une extraction assez
spécifique des lipides de réserve (lipides neutres).
D’autres solvants , le méthanol par exemple, permettent d’extraire préférentiellement les
phospholipides .
Certains mélanges oxydants sont capables de provoquer également une extraction totale des
composés lipophiles.
3. CYTOENZYMOLOGIE
Il est possible également de mettre en évidence une activité enzymatique par les
produits résultant de son action.
Exemple : Détection de l’activité phosphatasique
Les échantillons sont incubés dans un milieu renfermant un substrat de l’enzyme (à pH
et température appropriés) et un sel soluble de plomb. L’activité phosphatasique se traduit par
la libération de phosphate qui réagit avec le sel de plomb pour former un précipité opaque aux
électrons permettant ainsi la visualisation de cette activité. La réaction s’effectue en deux
temps

4. RADIOAUTOGRAPHIE
Technique basée sur l’utilisation de traceurs radioactifs (voir le cours)
5. AUTRES TECHNIQUES
On peut également localiser dans la cellule les propriétés antigéniques d’une substance :
c’est l’immunocytochimie. Voir l’exemple du cours immunofluorescence indirecte.
B. ETUDE FONCTIONNELLE IN VITRO
La microscopie électronique permet également de vérifier certaines données fournies par la
biochimie.
Exemple : vérification de fractions cellulaires obtenues après centrifugations préparatives en
gradient de densité.
Il existe 2 types de centrifugations couramment utilisés :
- la centrifugation de zone (v. fig 1) qui permet la séparation de constituants
de taille très différente.
- La centrifugation isopycnique (v. fig 2) qui permet une séparation plus fine.
Les coefficients de sédimentation sont exprimés en unités Svedberg ( 1S=10 sec)*
Le tableau suivant donne quelques coefficients de sédimentation caractéristique
Ces méthodes sont si sensibles qu’elles sont capables de séparer des molécules ayant
incorporé des isotopes lourds, comme N ou C ,des mêmes molécules non marquées .
CONCLUSION
Les techniques microscopiques ne doivent pas former une fin en soi même si elles fournissent
des documents de bonne qualité. Elles doivent toujours être considérées comme une méthode
d’étude adaptée au but recherché, de nombreuses techniques aussi bien microscopiques que
biochimiques sont nécessaires pour la compréhension de la cellule.
1
/
5
100%