Les alcènes

11
1
Les alcènes (chimie organique classique)
1. Rappels
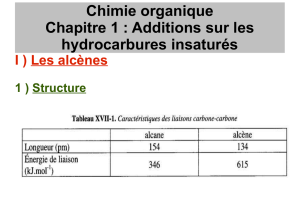
1.1. Structure des alcènes et des alcynes
Électronique : Lewis, revoir Hückel
Géométrique : VSEPR
1.2. Addition radicalaire de HBr
Conditions opératoires
Régiosélectivité : effet Kharash (1895-1957)
Interprétation : contrôle cinétique, relation vitesse / stabilité du radical
1.3. Additions électrophiles
Addition de HX (conditions), hydratation en catalyse acide :
régiosélectivité Markovnikov (1838-1904)
Interprétation : contrôle cinétique….
Addition d’un dihalogène : stéréochimie
Généralisation : conditions pour pouvoir étudier la régiosélectivité, la
stéréochimie d’une addition sur un alcène.
1.4. Ozonolyse
Conditions opératoires, résultats dans divers cas.
Rq : autres oxydants forts, intérêt des oxydations ménagées.
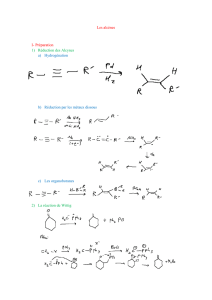
1.5. Obtention des alcènes
À partir des monohalogénoalcanes
Conditions opératoires : basique et chaud
Régiosélectivité Zaitsev (1841-1910) : contrôle cinétique
Stéréochimie : E1 ou E2 ?
À partir des alcools
Conditions opératoires : acide et chaud
Régiosélectivité, stéréochimie
Diels-Alder : donne des cyclohexènes
Réaction de Wittig
Aldolisation crotonisation : -énones

11
2
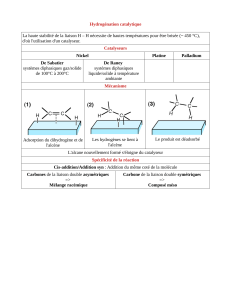
2. Dihydrogénation en catalyse hétérogène
2.1. Bilan et observations expérimentales
Bilan alcène, bilans alcyne, catalyseurs.
Réactivité comparée
La stéréochimie, cas où les deux faces ne sont pas équivalentes
2.2. Catalyse hétérogène
Étapes de la catalyse hétérogène
Existence d’une température optimale
2.3. Mécanisme proposé et cohérence avec les observations.
Détail du mécanisme
Cohérence : réactivité, stéréochimie, choix de la face.
Cas des alcynes
2.4. Applications des réactions d’hydrogénation
Synthèse
Analyse : classer les insaturations, sélectivité
Stabilité des alcènes, (règle de Zaitsev)
3. Action du diborane et traitements des alkylboranes.
« Obtention d’un alcool primaire par hydroboration d’un alcène terminal »
3.1. Bilans, conditions opératoires de l’addition du borane.
Borane, diborane, alkylboranes
3.2. Mécanisme proposé.
Addition
Oxydation de l’alkylborane
Passage à l’alcool
3.3. Généralisation
À d’autres alcènes
À d’autres boranes
À d’autres traitements de l’alkylborane

11
3
4. Oxydations en diols vicinaux, propriétés des diols vicinaux.
4.1. Syn-dihydroxylation
Par le tétraoxyde d’osmium, méthode stœchiométrique ou catalytique
Rq : action du permanganate dilué neutre ou basique même résultat
4.2. Anti-dihydroxylation
4.2.1. Époxydation
Bilan, exemples de peracides, liaison « peroxy »
Mécanisme (HP) stéréochimie, réactivité.
Rq : autres voies d’accès aux époxydes
4.2.2. Ouverture de l’époxyde
Bilan
En milieu basique : SN2, résultat depuis l’alcène = anti-dihydroxylation
En milieu acide : SN2 anti (ou SN1
mélange)
4.3. Réactions des diols vicinaux
Coupure par l’ion periodate, résultat depuis l’alcène
Protection des composés carbonylés par acétalisation
Industrie des polyesters
Et ne pas oublier… étude quantique des alcènes et des polyènes conjugués, réaction
de Diels-Alder.
1
/
3
100%