Lien - bromont-physiquechimie

Devoir de physique/chimie N°5 Année 2013/2014 TleS
Nom Prénom :
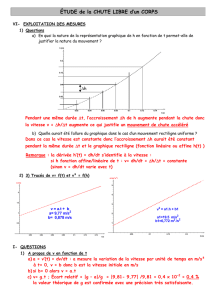
EXERCICE I : MOUVEMENT CIRCULAIRE D’UNE BILLE
Une bille de masse m = 25 g est lâchée sans vitesse initiale sur une piste de jeu de billes pour enfant. Le profil de la piste est un arc de
cercle AB de rayon R = 50 cm. Les frottements sont négligeables. Le mouvement de la bille est étudié par chronophotographie avec
10 images par seconde. Les positions successives de la bille, assimilée à un point matériel G, sont représentées sur la figure ci-après :
1.1. Déterminez les valeurs v2, v3 et v4 des vecteurs vitesse de la bille aux dates t2, t3 et t4.
1.2. Tracez les vecteurs
et
, en prenant pour échelle 1,0 cm pour 5,0.10-1 m.s-1.
2.1. Au niveau du point G3, construisez le vecteur Δ
. Déterminez la valeur Δv3 de sa norme à l’aide de l’échelle
précédente.
2.2. Déduisez-en la valeur a3 de la norme du vecteur accélération
de G à l’instant t3. Construisez le vecteur
(utilisez une couleur
différente de celle que avez utilisée pour construire les vecteurs
vitesse) avec pour origine le point G3, en prenant pour échelle
1,0 cm pour 1,0 m.s-2.
3. La bille est-elle isolée ou pseudo-isolée dans le référentiel
terrestre ? Justifiez votre réponse.
EXERCICE II : DES EQUATIONS A LA VITESSE
ET A L’ACCELERATION
Un point matériel G est animé d’un mouvement décrit,
dans un repère orthonormé, par les équations horaires de
ses coordonnées :
x(t) = 4,00 t2 + 6,00 t
y(t) = 3,00 t
1. Pourquoi qualifie-t-on ces équations d’«horaires» ?
2. Quelles sont les coordonnées de G à l’instant t = 0 s ?
3.1. Donnez l’expression des coordonnées vx et vy du
vecteur vitesse de G en fonction du temps.
3.2. Calculez les coordonnées de la vitesse à t = 1,00 s,
puis déduisez-en la valeur de la vitesse à cet instant.
4. A partir des coordonnées de la vitesse, donnez
l’expression des coordonnées ax et ay de l’accélération
de G. Déduisez-en sa valeur.
EXERCICE III : OXYDATION DU PROPAN-2-OL
A 30°C, le propan-2-ol est lentement oxydé par les ions permanganate MnO4
-
(aq) pour former de la propanone C3H6O.
A une date t = 0 s, on introduit dans un erlenmeyer 1,0 mL de propan-2-ol et 50,0 mL d’une solution de permanganate de potassium
acidifié (K+(aq) +MnO4-(aq)), de concentration molaire c0 = 0,20 mol.L-1.
Données : masse volumique du pran-2-ol : ρ = 0,785 g.mL-1. Masse molaire du propan-2-ol : M = 60,0 g.mol-1.Couple
redox : C3H6O(aq) / C3H8O(aq) ; MnO4
-
(aq) / Mn2+(aq). Seul l’ion MnO4
-
est coloré (violet).
On souhaite étudier les variations
temporelles de l’avancement x de la
réaction. Pour cela on prélève à une date t
un volume du mélange réactionnel auquel
on ajoute de l’eau glacée. On détermine
ensuite par une méthode appelée dosage,
la concentration des ions permanganate
contenus dans ce prélèvement pour
pouvoir déterminer l’avancement x de la
réaction étudiée. On renouvelle
l’opération à différentes dates et on
obtient la courbe (a) ci-après :
1.1 Donnez les formules semi-développées du propan-2-ol et de la propanone. Précisez pour chacune de ces molécules à quelle
famille elle appartient.
1.2 Ecrivez l’équation de la réaction étudiée.

Devoir de physique/chimie N°5 Année 2013/2014 TleS
Nom Prénom :
CH3
CH2
N
CH3
CH3
2.1. Quelle caractéristique physique du système varie au cours de la réaction considérée ?
2.2. De quelle façon aurait-on pu alors également suivre la cinétique de la réaction ? Expliquez.
3. Pour quelle raison introduit-on de l’eau glacée dans les prélèvements. Expliquez.
4. Définissez le temps de demi-réaction t1/2, puis déterminez graphiquement sa valeur.
On met maintenant en œuvre cette même réaction, mais en faisant varier les conditions expérimentales :
Quantité d’ions MnO4- introduits
Quantité de C3H8O introduits
Température
Expérience 2
1,0.10-2 mol
1,3.10-2 mol
20°C
Expérience 3
2,0.10-2 mol
1,3.10-2 mol
30°C
5. Pour chacune des expériences réalisées, représentez l’allure de la courbe d’évolution temporelle de l’avancement que l’on
obtiendrait. Justifiez vos réponses.
6. La courbe (b) aurait-elle pu être obtenue en ajoutant un catalyseur au milieu réactionnel de l’expérience 3 ? Justifiez.
EXERCICE IV : BASE FAIBLE
La N,N-diméthyléthylamine est un liquide incolore miscible avec
l’eau, d’odeur ammoniacale forte. C’est une base.
Vous trouverez son spectre RMN ci-après :
1.1. Donnez un nom (groupe A, B,…) aux différents groupes
de protons équivalents de cette molécule.
1.2 Reliez, en justifiant, chaque groupe de protons équivalents de
la molécule à un multiplet du spectre.
Dans une fiole jaugée de volume V = 250 mL, on introduit
V0 = 20 mL de N,N-diméthyléthylamine pure, puis on rajoute de
l’eau jusqu’au trait de jauge. La densité de la base est d = 0,685.
2. Montrez que la concentration en N,N-diméthyléthylamine de la
solution S ainsi préparée vaut C = 0,75 mol/L.
3. Ecrivez l’équation de la réaction de la N,N-diméthyléthylamine avec l’eau utilisée pour préparer la solution. Pour simplifier
l’écriture, la N,N-diméthyléthylamine sera noté B et son acide conjugué BH+.
Complétez le tableau d’avancement suivant en fonction de C, V, de l’avancement x et de xf.
+ +
quantités de matières en mol
x = 0
x
xf
4. Montrez que pH = pKe + log(xf/V).
On mesure le pH de la solution, celui-ci vaut : 11,9.
5. Déduisez-en que xf = 1,99.10-3 mol.
Données : masses molaires de la N,N-diméthyléthylamine M = 73,0 g.mol-1. Masse volumique de l’eau ρeau = 1,00 g/mL. Dans les
conditions de l’expérience, Ke = 14,0.
quadruplet
singulet
triplet
2,317
2,219
1,064
1
/
2
100%