Cancer et hérédité en question

24_VIVRE_SEPTEMBRE 2012
Cancer et hérédité
en question
Enquête
Pour aider
Cancer
et hérédité
VIVRE_SEPTEMBRE 2012_25
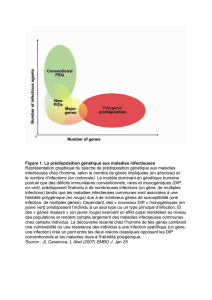
Maladie dite « multifactorielle », le cancer
trouve son origine dans notre environnement
et dans nos gènes. L’incidence des cancers liés
à l’hérédité paraît aujourd’hui relativement
limitée. Toutefois, l’étude de ces cancers
particuliers est riche d’enseignements :
elle permet de mieux connaître la maladie,
quelle que soit son origine, et de la prendre
en charge plus efficacement.

Maude observe sa petite fille qui joue
à l’ombre d’un mûrier noir. En ce bel
après-midi d’été, le ciel est resté sans
nuages. Pourtant, elle n’arrive pas à
profiter de la quiétude de l’instant,
son esprit s’est assombri au fil des dernières heures.
Cette cousine éloignée «perdue de vue depuis si long-
temps» lui a parlé du cancer du sein qui est mainte-
nant «… derrière elle…» De fil en aiguille, les deux
femmes en sont venues à recenser les cancers ayant
touché leurs familles. L’exercice est difficile et pour tout
dire un peu dérangeant. Toujours est-il que Maude peut
dénombrer «deux cancers sûrs du côté de sa mère... et
au moins un dans la branche paternelle». Tout cela la
préoccupe, ne dit-on pas du cancer qu’il est une mala-
die génétique et qu’il peut être une histoire de famille ?
Avant de déterminer si Maude à de vraies raisons de
s’inquiéter (voir encadré Risque, inquiétude et
réponses p.27), quelques définitions s’imposent. Si l’on
dit du cancer qu’il est une maladie génétique, c’est
avant tout parce qu’il résulte toujours d’une atteinte
des gènes. L’accumulation d’altérations dans certains
gènes clés du fonctionnement de la cellule fait que
celle-ci échappe au contrôle de l’organisme, perd sa fonc-
tion normale et prolifère de façon anarchique. Quelles
sont les causes de ces altérations ? Malgré les progrès
de la biologie, le plus grand nombre de ces causes restent
inconnues. Toutefois, on sait que l’âge, les modes de
vie et l’exposition à des agents physiques (les rayons
UV, les radiations ionisantes) ou chimiques (certains
composés de la fumée de cigarettes, certains solvants,
l’amiante, etc.) qui peuvent «blesser» l’ADN support de
Pour aider /Cancer et hérédité
26_VIVRE_SEPTEMBRE 2012
L’INCIDENCE DES CANCERS LIÉS À L’HÉRÉDITÉ
PARAÎT AUJOURD’HUI RELATIVEMENT LIMITÉE.
VIVRE_SEPTEMBRE 2012_27
réalité, notamment, quand d’autres facteurs environne-
mentaux et comportementaux (évoqués plus haut)
viennent se surajouter à la prédisposition génétique.
On estime aujourd’hui, dans une fourchette de 5 à 10 %,
les cancers impliquant une prédisposition héréditaire.
Des formes familiales ont été observées pour la plupart
des localisations et il est possible de distinguer trois
grands types de prédispositions : celles qui sont associées
à des cancers communs (sein, ovaire, endomètre, côlon-
rectum, prostate et mélanome malin), celles qui sont
liées à des cancers héréditaires rares comme, entre
autres, le rétinoblastome et le néphroblastome (des
cancers de l’enfant pour lesquels l’altération génétique
est associée à un risque de 90 % de développer la
maladie) et celles qui découlent de la transmission
d’une maladie génétique pouvant évoluer en cancer
Risque, inquiétude et réponses
De nos jours l’incidence des cancers est telle qu’un homme
sur deux et une femme sur trois seront concernés au fil de
leur existence… Difficile, donc, de trouver des familles
épargnées, même si l’on met de côté d’éventuelles
prédispositions génétiques. Les éléments ressassés par
Maude sont trop lacunaires (nous ne connaissons pas son
âge, par exemple), imprécis (quel est le degré de parenté
avec les « cas du côté de sa mère et de son père » ?), voire
hors propos (sa cousine éloignée n’est pas issue de
germain), pour qu’on puisse se faire la moindre idée de
son risque de cancer du sein et a fortiori de la part de ce
risque éventuellement dû à son hérédité. De fait, l’origine
héréditaire d’un cancer commun, comme le cancer du
sein, n’est évoquée que dans un contexte familial
particulier suggéré par plusieurs cas chez des parents
de premier degré (parents, enfants, fratrie) ou issus
de germains, surtout si la maladie est apparue à un âge
précoce. Dans le cas précis, où une prédisposition
familiale est avérée par l’identification d’une mutation
du gène BRCA1, celle-ci peut avoir été héritée du père
ou de la mère. La probabilité de la céder à la descendance,
fille ou garçon, est de 50 %. On peut donc dire que Maude
n’a en l’état pas de raisons rationnelles de s’inquiéter
pour elle… ou pour l’avenir de sa fillette. Toutefois, sa
préoccupation est compréhensible et devrait l’inciter à
s’informer, auprès de son médecin ou de son gynécologue,
sur les dispositifs de prévention et de dépistage qui sont à
sa disposition. Elle doit comprendre qu’elle n’est pas seule
face au risque, quelle qu’en soit l’origine.
Pour en savoir +
Consultez la brochure d’information Le risque
familial de cancer du sein et/ou de l’ovaire,
téléchargeable sur www.ligue-cancer.net,
rubrique « Actualités, publications».
nos gènes, jouent un rôle majeur dans l’acquisition de
mutations liées aux cancers. Mais dans certains cas, les
mutations ne sont pas acquises, elles nous ont été
transmises, par l’un ou l’autre de nos parents et se
trouvent donc inscrites dans notre patrimoine géné-
tique dès la naissance. C’est cet héritage génétique qui
fait que, parfois, le cancer peut être une histoire de
famille. Mais, même dans ces cas, on ne peut pas dire
que le cancer se transmet car il n’existe que très peu
d’exemples où une mutation héritée de l’ascendance
suffit à elle seule à la survenue de la maladie. Le plus
souvent les mutations constituent « juste » des facteurs
de prédispositions : les sujets porteurs ne déclareront
pas nécessairement un cancer, mais présentent un
risque accru par rapport à la population générale. Un
risque qui peut encore croître et éventuellement devenir

Pour aider /Cancer et hérédité
ON NE PEUT PAS DIRE QUE LE CANCER SE TRANSMET CAR IL N’EXISTE
QUE TRÈS PEU D’EXEMPLES OÙ UNE MUTATION HÉRITÉE DE
L’ASCENDANCE SUFFIT À ELLE SEULE À LA SURVENUE DE LA MALADIE.
28_VIVRE_SEPTEMBRE 2012 VIVRE_SEPTEMBRE 2012_29
« Aujourd’hui, on estime qu’une femme sur 500 est
porteuse d’une altération des gènes BRCA1 ou BRCA2,
explique Dominique Stoppa-Lyonnet. Chez celles-ci, on
évalue à 65 % le risque de développer un cancer du sein
avant 70 ans et avant 50 ans le risque est d’environ
40 %. En cas d’altération du BRCA2, le risque est d’environ
45 % à 70 ans et de 20 % avant 50 ans.» Ainsi, même
si l’augmentation du risque est substantielle, une
femme qui présente une prédisposition génétique peut
ne jamais développer de cancer du sein.
Des tests génétiques très spécialisés
Des analyses spécifiques peuvent être réalisées
lorsqu’un faisceau d’indices rendant compte d’une
histoire familiale à risque permet de suspecter une
prédisposition génétique. Dans le cas du cancer du
sein, ces analyses se fondent sur la recherche des
altérations des gènes BRCA1 et BRCA2. «En pratique,
une prise de sang est réalisée au décours de la consul-
tation et le test proprement dit est réalisé dans un
laboratoire spécialisé, précise Dominique Stoppa-Lyonnet.
La recherche des mutations suspectées est un processus
long et méticuleux qui demande plusieurs semaines.
Lorsqu’une mutation conduisant à l’inactivation (ici des
(par exemple la polypose colique familiale qui prédispose
à certains cancers du côlon).
L’exemple du cancer du sein familial
Au cours des années 1990, l’identification des gènes
BRCA1 puis BRCA2 a constitué une avancée scienti-
fique remarquable. La mutation constitutionnelle*
de ces gènes impliqués dans la réparation des lésions
de l’ADN constitue un facteur de prédisposition héré-
ditaire aux cancers du sein et de l’ovaire. A côté de
son intérêt fondamental, cette découverte a également
contribué à une amélioration de la prise en charge
des patientes concernées avec le développement des
consultations d’oncogénétique. «En fait, l’objectif initial
visait à réunir plusieurs familles de cancers du sein dans
un but de recherche», note Dominique Stoppa-Lyonnet,
chef du service de génétique oncologique de l’Institut
Curie, et professeur de génétique médicale à l’université
Paris-Descartes. « Rapidement, on s’est rendu compte
que les personnes sollicitées se posaient de nombreuses
questions sur la prise en charge des membres de leur
famille. De la mise en place de programmes de
recherche à l’Institut Curie est née une consultation de
génétique sur les risques tumoraux et dont la vocation
était aussi de donner des conseils de prévention et de
dépistages adaptés. Le diagnostic de prédisposition que
l’on pouvait faire alors était limité à la seule analyse de
l’histoire personnelle et familiale des personnes. Dès
1995, on a pu développer les premiers tests suite à
l’identification du gène BRCA1, premier gène dont les
anomalies sont associées à un risque de cancers du sein
et de l’ovaire. » A quel risque les porteuses de ces pré-
dispositions sont-elles exposées ? En France, dans la
population générale, on estime qu’une femme sur dix a
eu ou aura un cancer du sein avant l’âge de 70 ans.
LES MODES DE VIE ET L’EXPOSITION À DES AGENTS PHYSIQUES OU CHIMIQUES
PEUVENT « BLESSER » L’ADN SUPPORT DE NOS GÈNES.

30_VIVRE_SEPTEMBRE 2012
Pour aider /Cancer et hérédité
protéines BRCA1 ou BRCA2) est mise en évidence, le
sur-risque de cancer est avéré. Mais l’interprétation de
ces tests génétiques très spécialisés n’est pas toujours
simple, les altérations de ces gènes se caractérisent par
une très grande diversité. Un résultat négatif, c’est-à-
dire “normal” pour un membre d’une famille dans
laquelle personne n’a encore été testé, doit encore
être interprété avec prudence ». Quoi qu’il en soit, ce
dépistage génétique a l’intérêt de pouvoir déboucher
sur une prise en charge adaptée pour les femmes
effectivement concernées. L’Institut national du cancer
(INCa) a émis des recommandations de prise en charge
des porteuses d’une mutation BRCA1 ou BRCA2. « Une
surveillance mammaire très attentive est préconisée. En
cas de prédisposition génétique, il est proposé chaque
année une IRM mammaire, une mammographie dès
l’âge de 30 ans, et une échographie des seins s’ils sont
très denses. Se pose aussi la question de la mastectomie
“prophylactique”, c’est-à-dire l’ablation des seins à
visée préventive qui réduit le risque de cancer du sein de
plus de 90 % ! Mais, c’est un geste qui doit être discuté
et la décision longuement mûrie. Concernant le risque
de cancer de l’ovaire, qui est également associé, on
commence par une surveillance entre 35 et 40 ans.
A 40 ans, une chirurgie ovarienne de prévention est
recommandée, en particulier dans un contexte BRCA1»,
précise Dominique Stoppa-Lyonnet.
Identifier de nouveaux gènes responsables
d’une prédisposition
Toutefois, les mutations de BRCA1 ou de BRCA2 ne
sont responsables que d’une partie des formes hérédi-
taires des cancers du sein et de l’ovaire. D’autres
gènes pourraient-ils être impliqués ? En charge d’un
projet de recherche réalisé dans le cadre du pro-
gramme de la Ligue «Cartes d’Identité des Tumeurs®»
COMPRENDRE LA DIVERSITÉ DES TUMEURS, ÉTABLIR LA « CARTE D’IDENTITÉ
DE LEUR GÉNOME » EST UN DES OBJECTIFS DU PROGRAMME CIT DE LA LIGUE.
VIVRE_SEPTEMBRE 2012_31
(CIT, voir encadré Les espoirs de la génomique… à la
carte), Michel Longy, médecin généticien à l’Institut
Bergonié, à Bordeaux, cherche à identifier de nou-
veaux gènes liés à la prédisposition héréditaire au
cancer du sein. «Chez les patientes présentant un cancer
du sein de type familial, les tests génétiques ne révèlent
une mutation de BRCA1 ou de BRCA2 que dans seulement
30 % des cas. Il reste 70 % de formes familiales de cancer
du sein pour lesquelles on ne met pas en évidence
d’anomalie génétique responsable d’une prédisposition.
Une des explications possibles est que des altérations
d’autres gènes que nous ne connaissons pas peuvent
être en cause.» Pour identifier ces gènes putatifs,
quinze familles ont été incluses dans l’étude en cours.
De façon originale les travaux réalisés se fondent sur
l’analyse du génome des tumeurs qui se sont dévelop-
pées et non sur l’étude du patrimoine génétique des
patients. « Le but est de comparer le génome de toutes
Chaque cancer résulte d’une série particulière
d’altérations de notre patrimoine génétique. D’une
tumeur à l’autre, la cascade d’événements à l’origine
de ces altérations peut être très différente.
Le cancer, ou plutôt les cancers, se caractérisent donc
par une très grande diversité. Or, cette diversité est
un des facteurs qui peut expliquer qu’un traitement
se révèle efficace chez un patient et sans effet chez
un autre. Comprendre la diversité des tumeurs,
établir la « carte d’identité de leur génome »,
et faire correspondre à celle-ci un traitement
véritablement adapté constitue aujourd’hui
une évolution majeure de la prise en charge
thérapeutique des cancers. La Ligue s’est attelée à
cet objectif, en lançant en 2000 le programme Cartes
d’Identité des Tumeurs® (CIT). A partir de l’analyse
des échantillons de tumeurs et des observations
cliniques sur les patients, les travaux des chercheurs
impliqués dans CIT définissent des signatures
génomiques. « Après plusieurs étapes de validation,
ces signatures trouvent des applications médicales
en permettant la mise au point de kits d’analyses
utilisés pour affiner le diagnostic, prédire le
pronostic et la réponse au traitement », explique
Jacqueline Métral, coordinatrice du programme CIT
à la Ligue contre le cancer.
« Plus de 10 000 tumeurs couvrant 20 familles
de cancers ont été analysées. L’étude des données
produites a contribué à la caractérisation de
nombreux types de cancers dont ceux du sein, du foie
et du côlon. Certaines de ces découvertes ont déjà
conduit à la mise au point de kits moléculaires qui
devraient, dans un délai assez proche, aider à une
prise en charge personnalisée du patient », précise
Aurélien de Reyniès, coordinateur des analyses
biostatistiques du programme CIT.
Le point fort du programme CIT tient à un protocole
d’étude où la standardisation et le contrôle sont
des maîtres-mots. Autre valeur ajoutée, toutes
ces informations cruciales pour mieux appréhender
les tumeurs et leur diversité sont stockées dans
Annotator®, une base de données de la Ligue
qui renferme l’une des plus vastes collections
de données génomiques et cliniques en Europe.
Les espoirs de la génomique… à la carte
les tumeurs d’une même famille dans l’idée que s’il
existe un déterminisme commun, il doit être possible
d’en trouver la trace dans le génome de la tumeur »,
commente Michel Longy. ■
Gilles Girot et Jérôme Hinfray
* Mutation constitutionnelle : altération de l’ADN présente dans toutes les
cellules de l’organisme incluant les cellules sexuelles ovules et spermatozoïdes.
Pour en savoir +
www.ligue-cancer.net
1
/
4
100%