FIBROSE ENDOMYOCARDIQUE: APPORT DIAGNOSTIC DU

FIBROSE ENDOMYOCARDIQUE: APPORT DIAGNOSTIC DU
REHAUSSEMENT TARDIF EN IRM
Salami FA1, Croisille P1, Séka AR2, N’Zi KP2, Diabaté AS3
1 Service de Radiologie, Hôpital Cardio-vasculaire et Pneumologique Louis Pradel de
(Lyon France)
2Service de Radiologie, Institut de Cardiologie d’Abidjan (Côte d’Ivoire) 3 Service
de Radiologie, CHU de Treichville Abidjan (Côte d’Ivoire)
Abréviations :
IRM = Imagerie par résonance magnétique
MDCT = Multidetector computed tomography (scanner multidétecteur)
FEVG = Fraction d’éjection du ventricule gauche
FEM = Fibrose endomyocardique
RESUME :
Nous rapportons l’observation d’un patient de 40 ans, de type caucasien, ayant une intoxication
tabagique à 5 paquets /années mais sans notion de séjour en zone d’endémie parasitaire ni
atopie. Il présentait une asthénie depuis 12 mois associée à une hyperéosinophilie à 25.200
/mm3. Huit mois plus tard sont apparus une dyspnée Stade II fort de la NYHA et des signes de
toxicité multiviscérale avec syndrome myéloprolifératif. À l’échographie trans-thoracique, il a été
observé une FEVG à 60 % avec des signes restrictifs et un thrombus ventriculaire gauche. Au
scanner multidétecteur synchronisé à l’ECG, les coronaires étaient d’aspect normal; une
calcification bi-ventriculaire massive et un comblement apical ont été mis en évidence. Les
séquences ciné-SSFP en IRM ont montré une hypokinésie bi-ventriculaire, une dilatation du
massif atrial associées à une insuffisance mitrale et une insuffisance tricuspide. Après injection
de Gadolinium, la séquence de rehaussement tardif a mis en évidence une amputation bi-
apicale avec rétention de contraste à prédominance sous-endocardique de distribution non
vasculaire signant la fibrose et le thrombus.
L’IRM est un examen performant dans le diagnostic non invasif de la fibrose endomyocardique
grâce à l’analyse ciné-morphologique cardiaque. La séquence de rehaussement tardif en
améliorant la caractérisation du tissu myocardique notamment de la fibrosepermet de
diagnostiquer la FEM et envisagerune meilleure priseen charge.
Mots clés :Syndrome hyperéosinophilique - Fibrose endomyocardique –Endocardite De Löeffler -
IRM - Rehaussement tardif
FAIT CLINIQUE
Correspondance et tiré à part:
Dr Salami Fatima Service de Radiologie, Hôpital Cardio-vasculaire et Pneumologique
Louis Pradel de (Lyon France)
E-mail: [email protected]
J Afr Imag Méd 2011; (4), 7: 405-411

SUMMARY:
We report a case of a Caucasian 40 years old man, with a tobacco intoxication (5 packs/year)
but not living in endemic areas or atopy, describing a weakness for 12 months. Biology showed
hypereosinophilia to 25,200/mm3. Eight months later appeared dyspnea Stadium II high (NYHA)
and signs of multiple organ toxicity with myeloproliferative disorder. A transthoracic ultrasound
found an ejection fraction to 60% with restrictive signs and a left ventricular thrombus. A 64 –
slice multidetector computed tomography found normal coronary arteries, bi-ventricular
calcification and an apical filling. A cardiac MRI (Avanto 1.5 T) with cine-SSFP sequences
showed a bi-ventricular hypokinesia, dilation of the atrial mass associated with mitral and
tricuspid insufficiency. Delayed enhancement sequences showed a bi-apical amputation with a
subendocardial hyperenhancement non vascular repartition signing fibrosis and thrombus.
MRI is a powerful examination in the noninvasive diagnosis of endomyocardial fibrosis with
cine-morphological sequences. The sequence of delayed enhancement with inversion-recovery
improves the characterization of myocardial tissue including fibrosis in the endomyocardial
fibrosis .It allows a better management of endomyocardial fibrosis.
Key-words:Hypeosinophilic syndrome - Endomyocardial fibrosis - Löeffler endocarditis - MRI -
Delayed enhancement
INTRODUCTION :
Le syndrome hyperéosinophilique est un
diagnostic d’élimination défini par Chusid
(1) par la présence d’une hyperéosinophilie >
1, 5 G/l (ou 1500 éléments / mm3) persistant
plus de six mois, l’atteinte d’organes
spécifiques et l’absence d’autres causes
d’hyperéosinophilie. La fibrose
endomyocardique en est la conséquence
cardiaque par toxicité des polynucléaires
éosinophiles. Le diagnostic non invasif de la
FEM constitue un challenge car la biopsie
endomyocardique qui est un geste lourd est la
technique de référence de ce diagnostic.
L’avènement de nouvelles séquences IRM
permet de mieux détecter et caractériser cette
pathologie rarissime en France et au
pronostic sombre (75 % de décès dans les 2
ans suivant le diagnostic). Le but de notre
étude était de décrire une évaluation
diagnostique non invasive et pronostique
d’un cas de FEM par la séquence de
rehaussement tardif en IRM.
OBSERVATION :
M. T.F, 40 ans, de type caucasien ayant
comme facteur de risque cardiovasculaire
une intoxication tabagique (5 paquets/
année) a présenté une asthénie
progressivement croissante depuis 12 mois.
Il n’avait ni atopie ni antécédent de séjour
en zone d’endémie parasitaire. L’examen
clinique et l’ECG étaient normaux. Il avait
une hyperéosinophilie à 25.200 /mm3. Les
causes infectieuses parasitaires classiques
ont été éliminées. Au bout de huit mois est
apparue une dyspnée stade II fort de la
NYHA associée à une cyanose aux
changements de position et une toxicité
multiviscérale (hépato-splénomégalie et
anasarque)avec syndrome myéloprolifératif.
À l’échographie trans-thoracique, une
masse tissulaire apicale fibro-calcifiée
associée à des résidus thrombotiques ; une
FEVG à 60 % avec des signes restrictifs et
un thrombus ventriculaire gauche ont été
observés. Le scanner 64 détecteurs
synchronisé à l’ECG a montré des
coronaires d’aspect normal, une
calcification bi-ventriculaire massive et un
comblement apical avec un épanchement
pleural liquidien droit. Les séquences ciné-
F Salami et al
F Salami et al
J Afr Imag Méd 2011; (4), 7: 405-411

SSFP (Fig.1) en IRM (Avanto 1,5 T avec
antenne cardiaque dédiée) ont mis en
évidence une hypokinésie bi-ventriculaire,
une dilatation du massif atrial associées à
une insuffisance mitrale et tricuspide. Après
injection de Gadolinium (Fig. 2 à 4), nous
avons observé une amputation bi-apicale
avec épaississement myocardique de 16
mm et une rétention de contraste à
prédominance sous-endocardique de
distribution non vasculaire et le thrombus
de quatre centimètres à la pointe du
ventricule gauche.Le diagnostic
d’hyperéosinophilie idiopathique avec
fibrose endomyocardique a été évoqué
devant le faisceau d’arguments clinico-
biologiques et le rehaussement de contraste
tardif sous endocardique en IRM. Deux
mois plus tard, une endocardectomie
biventriculaire avec remplacement
valvulaire mitral par une prothèse
mécanique à double ailette Saint Jude ®a
étéréalisée avec succès. La cartographie
précise de la fibrose et l’aspect des valves
obtenues par ciné-IRM a permis de réaliser
une résection complète du tissu fibreux et
d’envisager la sauvegarde de la valve
tricuspide. Le patient est cependant décédé
en post-opératoire immédiat. La gravité de
son atteinte était liée au syndrome
paranéoplasique du à la myéloprolifération
et responsable de l’hyperéosinophilie et de
la toxicité multiviscérale.
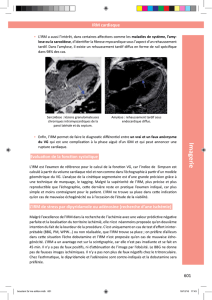
Fig.1:IRM cardiaque, séquence ciné long axe quatre cavités en écho de gradient à l’équilibre –
balanced SSFP (Steady State Free Precession):Comblement de l'apex du VG et du VD par un
matériel tissulaire en quasi isosignal au myocarde (flèches blanches), avec infiltration de
l'appareil valvulaire (tête de flèche) mieux vu en petit axe. Fuites mitrale et tricuspide en
hyposignal dans les atriums gauche et droit (flèches noires) .A noter un épanchement pleural
liquidien droit apparaissant en hypersignal ( ).
Fig.1: Cardiac Cine MRI, long-axis cine sequence four chamber view, balanced gradient-echo
with SSPP (Steady State Free Precession): Fillingthe apex of theLV and RV by a tissue
materialquasiisointenseto the myocardium (white arrows), with infiltrationof thevalvular
apparatus (arrowhead)best viewedinshort axis. Mitral and tricuspid regurgitationsappearing
hypointense in the left atriumand right atriums(black arrows). A right pleural effusion appearing
hyperintense is noted ( ).
F Salami et al
J Afr Imag Méd 2011; (4), 7: 405-411

Fig.2 a) Fig.2 b)
Fig. 2 c) Fig.2 d)
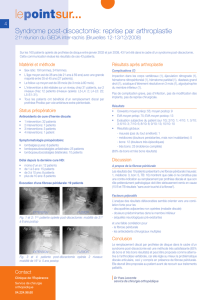
Fig.2 a-d: IRM cardiaque, séquences ciné petit axe pré (a) et post gadolinium (b)
et long axe deux cavités, pré (c) et post gadolinium (d):Thrombus intraventriculaire gauche
(flèche blanche) séparé du myocarde adjacent isointense par une zone de rehaussement
mince correspondant à l’endocarde fibrosé en hypersignal (flèches noires).
Fig. 2 a-d : Cardiac Cine MRI, long-axis cine sequence two chamber view left ventricular
thrombus (white arrow) separated from nearly isointense myocardium by thin zone of
endomyocardium with increased signal intensity (black arrows).
Fig.3: IRM cardiaque,deux cavités, séquence de rehaussement précoce avec signal intense de
l’endocarde du ventricule gauche (flèches). L’intérêt de l’imagerie précoce après injection est de
montrer la cinétique de rehaussement.
Fig.3: Cardiac MRI, two chamber view: Early enhancement with high signal intensity
involving endomyocardium of the left ventricle (arrows).The interest ofearlyimagingafter
injectionis to show thekineticenhancement.
F Salami et al
J Afr Imag Méd 2011; (4), 7: 405-411

DISCUSSION :
La fibrose endomyocardique est une
cardiomyopathie restrictive d’étiologie
inconnue caractérisée par une fibrose de
l’endocarde suite à l’agression de
l’endocarde et à un moindre degré du
myocarde par les produits de dégradation de
polynucléaires éosinophiles cytopathogènes.
L’endocardite fibroplastique de Löeffler (EF)
est aussi une cardiomyopathie restrictive; elle
se rapproche de la fibrose endomyocardique
(FEM) de Davies. L’EF est surtout retrouvée
dans les régions tempérées et est associée à
une hyperéosinophilie importante; elle
correspond au syndrome d’hyperéosinophilie
essentielle (SHE) ou syndrome de Chusid. La
FEM est plutôt rencontrée dans la population
pauvre de certains pays tropicaux qui
constituent des zones endémiques où elle
représente 20 % des défaillances cardiaques
(2); le taux d’éosinophilie y est en général
normal. Il existe une controverse quant aux
dénominations FEM et EL: Certaines équipes
regroupent ces 2 entités sous le même
vocable de FEM en soulignant l’extrême
rareté de la FEM en Europe (3). Le débat
demeure car des hyperéosinophilies ont été
décrites dans la FEM (4).L’association
américaine du cœur (American Heart
Association) a classé la FEM et l’EL en
cardiomyopathies restrictives secondaires par
atteinte endomyocardique (5). La formation
de nécrose suivie de fibrose et de thrombi
muraux est à la base de la défaillance
cardiaque. Le tissufibreux endocardique
atteignant les valves, l’appareil sous-
valvulaire ainsi que l’apex de l'unoules
deuxventricules est pathognomonique de la
fibrose endomyocardique. Elle est
responsable d’une rigiditéendocardique avec
uneinsuffisance valvulaireauriculo -
ventriculairepar lésion des
musclespapillaireset une réduction
progressivedelacavitéventriculaire avec
restriction du remplissage et dilatation
auriculaire. La biopsie endomyocardique
demeure la technique de référence de ce
diagnostic (6). Le geste est lourd mais les
complications sont rares (1 à 6%) entre des
mains expérimentées : pour 546 procédures,
6% de complications ont été observées (6),
dont 2,7 % lors de l’introduction du guide et
3,3 % lors de la biopsie proprement dite.
L’idéal est cependant de diagnostiquer la FEM
par des méthodes non invasives. Dans une
étude rétrospective portant sur 25 ans (1979 à
2004), Hassan (7) a rapporté 21 erreurs
diagnostiquescliniques et paracliniques
(échocardiographie, hémodynamique et
angiographie). L’échocardiographie
bidimensionnelle aurait pu redresser le
diagnostic : la présence d’un petit ventricule
avec oblitération de l’apex et un grand atrium
étant évocatrice de FEM. L’échocardiographie
est en première ligne mais est opérateur
dépendant; elle connait des limites d’où
l’avènement de l’imagerie en coupes, en
particulier l’IRM cardiaque avec sa séquence
de rehaussement tardif qui visualise la FEM.
L’IRM possède une excellente résolution en
contraste et distingue le myocarde sain, de la
fibrose et de l’inflammation ainsi que les
thrombi sur les séquences ciné-
morphologiques (8). La séquence de
rehaussement tardif (9) initialement utilisée
pour l’étude de la viabilité myocardique, est
une séquence pondérée en T1suivi par un
kernel de lecture écho de gradient (2D ou 3D)
ou en écho de gradient stimulé (« Steady State
Free Precession » (SSFP)). L’acquisition des
images est différée de 10 à 15 minutes après
injection intraveineuse de 0,1 à 0,2 mmol/ kg
de produit de contraste gadoliné
(gadopentetate diméglumine). La
détermination optimale du temps d’inversion
(TI) est cruciale pour obtenir une acquisition
correcte des images (10) .Un TI trop court peut
annuler le signal du tissu pathologique et
rehausser le tissu normal alors qu’un temps
allongé peut dégrader le contraste entre tissu
normal et pathologique. Cette technique
détecte les anomalies tissulaires à l’origine
d’une augmentation du volume de distribution
et augmentation du délai de clearance du
gadolinium (fibrose ou nécrose). Par sa
meilleure définition du siège et de l’étendue de
la fibrose, cette séquence permet de guider le
chirurgien ou de maximiser les résultats de la
F Salami et al
F Salami et al
J Afr Imag Méd 2011; (4), 7: 405-411
 6
6
 7
7
 8
8
1
/
8
100%