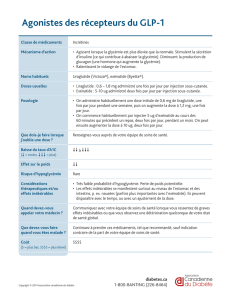
Dérivés du GLP-1 et inhibiteurs de la DPP-IV

Mini-revue
Dérivés du GLP-1 et inhibiteurs de la DPP-IV :
perspectives dans le traitement du diabète de type 2
Jean-Frédéric Blicklé
Service de Médecine interne, Diabète et Maladies métaboliques, hôpitaux universitaires de Strasbourg,
67091 Strasbourg Cedex
La découverte des potentialités offertes dans le traitement du
diabète de type 2 par le GLP-1, une hormone insulinotropique
d’origine digestive, a conduit au développement de diverses
molécules apparentées à cette incrétine comme l’exénatide, ou
d’analogues du GLP-1 d’action prolongée comme le liraglutide.
Administrés par voie sous-cutanée, ces agents ont démontré
leur efficacité dans la réduction de l’hyperglycémie et des taux
d’HbA1c de patients diabétiques de type 2, sans majoration du
risque d’hypoglycémie et sans prise de poids. L’inhibition phar-
macologique de la dipeptidyl-peptidase IV, l’enzyme responsa-
ble de la dégradation du GLP-1 naturel, représente une autre
approche prometteuse dans le traitement du diabète. Certains
de ces inhibiteurs, qui peuvent être administrés par voie orale,
sont actuellement en phase 3 de développement clinique. Leur
efficacité sur le contrôle métabolique paraît établie, mais des
études complémentaires sont nécessaires pour en confirmer la
tolérance, qui pourrait être améliorée par une meilleure sélecti-
vité de ces agents.
Mots clés :diabète de type 2, GLP-1, exénatide, liraglutide, dipeptidyl-
peptidase IV
Chez le sujet normal, une charge orale en glucose s’accompagne
d’une réponse insulinique plus importante que celle provoquée par
une perfusion intraveineuse de glucose permettant d’atteindre une
glycémie équivalente. Cet effet dit « incrétine » est lié pour l’essen-
tiel à la sécrétion de deux hormones intestinales, le glucagon-like-peptide-1
(GLP-1) et le glucose dependent insulinotropic polypeptide également appelé
gastric inhibitory polypeptide (GIP). Chez le diabétique de type 2, la sécrétion
de GLP-1 apparaît légèrement diminuée et l’effet insulinosécrétagogue du GIP
réduit [1]. Ces données expliquent le développement du GLP-1 et de molécules
apparentées dans le traitement du diabète de type 2 (DT2).
Tirés à part :
J.-F. Blicklé
Sang Thrombose Vaisseaux 2006 ;
18, n° 5 : 265-9
STV, vol. 18, n° 5, mai 2006 265
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

Le GLP-1 : données physiologiques
Le GLP-1 est un peptide dérivé du proglucagon sécrété en
réponse à des repas mixtes par les cellules L localisées de
façon prédominante au niveau du tractus digestif inférieur.
Deux formes sont biologiquement actives : le GLP-1 (7-37)
et le GLP-1 (7-36 amide) qui prédomine dans la circulation.
La demi-vie du GLP-1 est extrêmement courte (1-2 minu-
tes) du fait de sa dégradation rapide par une enzyme relati-
vement ubiquitaire et peu spécifique, la dipeptidyl-
peptidase IV (DPP-IV) conduisant à la formation d’un
dérivé inactif, voire antagoniste. Les effets du GLP-1 sont
médiés par leur liaison à un récepteur spécifique membra-
naire couplé à une protéine G et agissant par la voie de
l’AMP cyclique [1-4].
Le GLP-1 possède différentes propriétés pharmacodynami-
ques en faisant un candidat intéressant dans la thérapeuti-
que du DT2 [1, 2] :
– un effet insulinosécrétagogue strictement glucose-
dépendant et qui disparaît pour des valeurs glycémiques
inférieures à 0,80 g/L. Cet effet sur la sécrétion d’insuline
s’accompagne d’une stimulation de sa synthèse et d’un
effet trophique sur la cellule b(différenciation de cellules
progénitrices, réduction de l’apoptose, prolifération des
cellules b);
– une inhibition de la sécrétion de glucagon également
glucose-dépendante, n’empêchant pas la contre-régulation
hormonale de s’exercer pour des glycémies inférieures à
0,65 g/L ;
– un ralentissement de la vidange gastrique et une réduction
du péristaltisme intestinal ainsi qu’une diminution de l’ac-
tivité sécrétoire du tractus digestif supérieur ;
– un effet satiétogène conduisant à une réduction de la prise
alimentaire et à une perte pondérale. Cet effet pourrait faire
intervenir des afférences vagales ou résulter d’une action
directe du GLP-1 circulant sur des régions du SNC non
protégées par la barrière hémoencéphalique et dotées de
récepteurs.
Plusieurs études d’administration intraveineuse de courte
durée (quelques heures) ont confirmé que le GLP-1 permet-
tait de contrôler la glycémie à jeun du diabétique de type 2
et que son effet insulinotrope était glucose-dépendant et
sans risque d’hypoglycémie. Cet effet thérapeutique est
obtenu par des concentrations plasmatiques de 50 à 120
pmol/L, trois à cinq fois supérieures à celles atteintes après
un repas mixte. S’il n’y a pas de patients diabétiques de type
2 non répondeurs absolus, la possibilité d’obtenir une nor-
malisation glycémique dépend de la persistance d’une
masse bcellulaire critique. Une hyperglycémie modérée et
des concentrations d’insuline élevées apparaissent ainsi
prédictives d’une bonne réponse thérapeutique [1].
L’utilisation thérapeutique au long cours du GLP-1 reste
toutefois handicapée par la nécessité d’une administration
intraveineuse. De ce fait, des essais d’administration sous-
cutanée continue ont été effectués. Cette voie aboutit à des
concentrations circulantes apparemment équivalentes à
celle de la voie intraveineuse en dosages radio-immuno-
logiques mais dont, pour des raisons mal comprises, l’effi-
cacité thérapeutique et les effets indésirables sont à l’évi-
dence moindres. C’est ainsi que des doses de 2,4 à
4,8 pmol/kg/min sont nécessaires en sous-cutané contre
seulement 0,4 à 1,2 pmol/kg/min en intraveineux pour
obtenir un effet thérapeutique significatif [1].
En dehors des contraintes d’administration parentérale liées
à la nature peptidique du produit, se pose le problème de la
dégradation extrêmement rapide du GLP-1 sous l’effet de
la DPP-IV.
C’est pour cette raison qu’ont été développés des dérivés du
GLP-1 d’action prolongée, résistant à l’action de la
DDP-IV ou d’agonistes du récepteur, de structure apparen-
tée à celle du GLP-1. Une autre voie de recherche est
l’inhibition pharmacologique de la DPP-IV [3-5].
Dérivés du GLP-1
Exénatide (AC 2993)
L’exendine-4, un puissant agoniste du récepteur du GLP-1
ayant une homologie de séquence de 52 % avec l’hormone
humaine, a été isolé dans la salive d’un lézard, Heloderma
suspectum. Sa forme synthétique, l’exénatide, a une demi-
viede2à4heures et peut être administrée en 2 injections
sous-cutanées quotidiennes [6].
Trois essais de phase 3, ayant inclus un total d’environ
1 100 patients ont évalué l’effet de l’exénatide chez des
diabétiques de type 2 insuffisamment contrôlés par une
monothérapie par metformine ou sulfamide hypoglycé-
miant ou par une association sulfamide-metformine
(HbA1c moyenne>8%dans les 3 essais). Le médicament
a été administré par voie sous-cutanée, 15 minutes avant le
repas du matin et du soir, à une dose unitaire de 5 ou 10 lg.
La baisse d’HbA1c obtenue a été de 0,4 à 0,55 % à la dose
de2×5lg et de 0,77 à 0,86 % à la dose de 2 × 10 lg et, par
rapport au groupe placebo, une proportion plus grande de
patients a atteint des valeurs d’HbA1c<7%après 30 se-
maines de traitement (tableau I). Parallèlement, une dimi-
nution de la glycémie à jeun et des glycémies postprandia-
les a été observée sous exénatide dans les 3 études [6].
L’évolution pondérale a été favorable sous exénatide, avec
une perte de poids de 0,8 à 1,6 kg à la dose de 2 × 5 lg, de
1,6 à 2,8 kg à la dose de 2 × 10 lg contre seulement 0,3 à
0,9 kg sous placebo (NS).
STV, vol. 18, n° 5, mai 2006
266
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

Chez les patients ayant suivi la phase d’extension de ces
études, les effets favorables de l’exénatide sur le contrôle
glycémique et le poids se sont maintenus pendant 82 semai-
nes, les triglycérides se sont abaissés de 0,37 g/L, le
cholestérol-HDL a très légèrement augmenté, la pression
artérielle systolique a diminué de 1,5 mmHg et la diastoli-
que de 3,2 mmHg [6].
L’exénatide a été comparé à l’insuline glargine dans un
essai randomisé multicentrique d’une durée de 26 semaines
ayant inclus des diabétiques de type 2 mal contrôlés par une
association metformine + sulfonylurée (HbA1c ≈8,2 %).
Les deux stratégies ont conduit à une amélioration équiva-
lente du contrôle glycémique, mais les patients du groupe
exénatide ont perdu 2,3 kg, tandis que ceux du groupe
glargine ont pris 1,8 kg [6].
Dans ces divers essais, la tolérance de l’exénatide est appa-
rue bonne, les effets indésirables les plus fréquents étant
des troubles gastro-intestinaux modérés (nausées, vomisse-
ments, diarrhées), des sensations de malaise ou des cépha-
lées. Seuls 2 % des patients sous exénatide 5 lg et 4 % sous
exénatide 10 lg sont sortis d’essai pour effets indésirables
(< 1 % dans les groupes placebo). Des hypoglycémies ont
été rarement observées sous exénatide et ce uniquement en
association avec un sulfamide hypoglycémiant. Un seul cas
d’hypoglycémie sévère a été relevé chez un patient recevant
de l’exénatide 5 lg en association à une combinaison
metformine + sulfamide hypoglycémiant.
Par comparaison à l’insuline glargine, les hypoglycémies
nocturnes ont été plus rares sous exénatide (0,9 versus 2,4
par patient-année) [6].
Des anticorps anti-exénatide ont été détectés à la 30
e
se-
maine chez près d’un patient sur deux. Leur titre était
généralement faible et leur présence n’était pas associée à
un déséquilibre glycémique ou à des événements indésira-
bles [6].
Ces résultats ont conduit à l’approbation par la FDA de
l’exénatide pour le traitement du diabète de type 2 insuffi-
samment contrôlé par la metformine et/ou un sulfamide
hypoglycémiant.
Liraglutide (NN 2211)
Le liraglutide est un analogue du GLP-1 d’action prolongée
dont la structure diffère de l’hormone naturelle par la subs-
titution d’un acide aminé et par un radical acyl permettant
sa liaison à l’albumine [7].
Après injection sous-cutanée chez le volontaire sain, sa
demi-vie biologique est de 11 à 15 heures, ce qui autorise
son utilisation en une administration quotidienne.
Chez des diabétiques de type 2 en déséquilibre modéré
(HbA1c = 7,6 %), un essai en double aveugle contre pla-
cebo a démontré l’efficacité de posologies allant de 0,225 à
0,75 mg/jour sur le contrôle glycémique, la diminution de
l’HbA1c à 3 mois atteignant 0,75 % et celle de la glycémie
à jeun 1,8 mmol/L à la dose la plus forte [4, 5]. Une perte de
poids de 1,2 kg a été notée dans le groupe liraglutide
0,45 mg. Un groupe comparatif traité par glimépiride (1-
4 mg) en ouvert a également amélioré son contrôle glycé-
mique avec toutefois une discrète prise pondérale.
Un autre essai dose-réponse d’une durée de 12 semaines a
testé différents dosages de liraglutide (0,045 à 0,75 mg) par
comparaison à la monothérapie par metformine
2 × 1 g/jour. Il n’a pas été mis en évidence de différence
significative entre le liraglutide aux doses de 0,45, 0,60 ou
0,75 mg et la metformine en ce qui concerne l’évolution de
l’HbA1c ou du poids. La glycémie à jeun était toutefois
légèrement moins bien contrôlée dans le groupe liraglutide
0,75 mg. Les doses inférieures à 0,45 mg ont été insuffisan-
tes pour assurer un contrôle glycémique équivalent à celui
obtenu par la metformine [7].
En association à la metformine, le liraglutide a permis
d’obtenir un meilleur contrôle glycémique (baisse de
l’HbA1c de 1,1 %) que le glimépiride et a conduit à une
perte de poids après 5 semaines de traitement.
Les effets indésirables sont ceux observés avec le GLP-1.
Ils sont généralement transitoires et ne se sont pas accom-
pagnés dans les divers essais mentionnés d’arrêt du traite-
ment. Si les doses sont titrées de façon progressive, des
posologies atteignant 2 mg/jour peuvent être atteintes sans
majoration des effets secondaires [1].
CJC-1131
Ce dérivé, substitué par un résidu D-Ala en position 8 et
possédant une partie C-terminale réactive permettant une
liaison covalente avec l’albumine lui conférant une demi-
vie équivalente à celle-ci, a fait l’objet d’études chez le
volontaire sain. Sa demi-vie d’élimination est comprise
Tableau I.Pourcentage de patients atteignant une HbA1c<7%sous exénatide versus placebo (d'après [6])
Traitement N Placebo Exénatide2x5 Exénatide2x10
Metformine 240 13 % 32 % 46 %
Sulfamide 237 9 % 33 % 41 %
Met + SU 554 9 % 27 % 34 %
STV, vol. 18, n° 5, mai 2006 267
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

entre 9 et 14 jours. Son effet dose-dépendant sur la glycé-
mie se maintient au minimum 48 heures et peut atteindre
8 jours chez certains sujets [2-4].
La molécule, autorisée à poursuivre des essais de phase 2,
n’a toutefois fait l’objet d’aucune publication depuis 2004.
Inhibiteurs de la DDP-IV
L’inhibition de la dipeptidyl-peptidase-IV, une sérine pro-
téase membranaire et circulante responsable du clivage de
plusieurs peptides dont l’avant-dernier acide aminé
N-terminal est un résidu proline ou alanine, inactivant le
GLP-1, représente une alternative thérapeutique séduisante
aux dérivés précédemment cités du fait de la possibilité
d’administration orale du produit [3-5].
À ce jour, plus de 200 brevets d’inhibiteurs de la DDP-IV
appartenant à trois grandes familles sur le plan de la struc-
ture chimique et du type d’inhibition ont été déposés par
une trentaine de laboratoires, mais il est vraisemblable
qu’un petit nombre seulement verront le jour. Les molé-
cules actuellement en phase 2/3 de développement clinique
sont mentionnées dans le tableau II [8].
La plus avancée semble être le LAF-237, qui, du fait de sa
durée d’action plus longue, semble avoir pris le relais du
DVP-DPP 728 dont les premiers résultats chez des diabéti-
ques de type 2 avaient été publiés dès 2002.
En monothérapie, chez des patients naïfs, le LAF-237 à la
dose de 2 × 25 mg/jour a permis d’obtenir une réduction à
3 mois de l’HbA1c de 0,6 % par comparaison à un groupe
placebo. L’efficacité était supérieure lorsque l’HbA1c était
comprise entre 8 et 9,5 %. L’événement indésirable le plus
fréquent a été la survenue d’hypoglycémies mineures chez
10 % des patients traités [8].
Cet agent a également été testé à la dose de 1 × 50 mg/jour
contre placebo en association à la metformine. Une baisse
de l’HbA1c de 0,6 % à 3 mois, de la glycémie à jeun de 1,2
mmol/L et des glycémies postprandiales de 2,2 mmol/L a
été obtenue. Une extension de cette étude à 52 semaines
suggère une stabilité du contrôle glycémique. Il ne semble
pas y avoir d’effet sur le poids. Des résultats encourageants
ont également été obtenus avec le MK-0431, qui entre
également en phase 3 de développement clinique [8].
S’il semble logique d’attribuer l’effet thérapeutique de ces
molécules à l’augmentation de la durée de vie et de l’effet
biologique des incrétines endogènes et plus particulière-
ment du GLP-1, la question d’autres mécanismes reste à ce
jour ouverte.
En effet, l’inhibition de la DDP-IV ne s’accompagne que
d’une majoration modeste des taux circulants de GLP-1,
nettement inférieurs à ceux atteints dans les essais théra-
peutiques utilisant des perfusions intraveineuses de GLP-1.
Il faut toutefois souligner que les taux circulants de ces
hormones pariéto-digestives ne sont très certainement
qu’un mauvais reflet de leurs concentrations portales et de
leur activité biologique. C’est probablement aussi du fait de
la nécessité d’utiliser des doses supra-physiologiques de
GLP-1 par voie parentérale que celui-ci ou ses analogues
provoquent des effets indésirables non observés avec les
inhibiteurs de la DPP-IV.
Le caractère progressif des effets des inhibiteurs de la
DPP-IV suggère toutefois des effets à plus long terme sur la
cellule b. De même, la survenue d’hypoglycémies avec le
DVP-DPP 728 et le LAF-237 en monothérapie ne semble
pas pouvoir être expliquée uniquement par l’effet incrétine.
Des incertitudes subsistent quant à la possibilité d’effets
indésirables liés à l’inhibition du clivage par la DPP-IV
d’autres substrats que le GLP-1 ou le GIP ; en particulier
certains neuropeptides, diverses cytokines (la DPP-IV est
exprimée à la surface des lymphocytes T où elle est connue
sous le nom de CD 26), certaines enzymes comme la pro-
téine ad’activation des fibroblastes exprimée chez l’adulte
sur les fibroblastes activés et dans certains cancers, la
DPP 8 et la DPP 9, des enzymes cytosoliques largement
distribuées et incriminées dans certains effets toxiques ob-
servés chez l’animal (alopécie, thrombopénie, anémie,
splénomégalie...).
Ces problèmes de tolérance devraient être limités par une
augmentation de la sélectivité des inhibiteurs utilisés en
thérapeutique, comme cela a été mis en évidence chez
l’animal [9].
Tableau II.Inhibiteurs de la DPP-IV en phase 2-3
de développement clinique (d'après [8])
Laboratoire Type d’inhibition
DVP DPP-728 Novartis analogue ; liaison
covalente ;
modification d’activité
LAF-237 Novartis analogue ; liaison
covalente ;
modification d’activité
MK-0431 Merck inhibiteur cyclique non
peptidique ; liaison non
covalente ; réversible
BMS-477118 Bristol-Myers
Squibb
analogue ; liaison
covalente ;
modification d’activité
P 32/98 Probiodrug analogue ; liaison non
covalente ; réversible
P 93/01
= PSN-9301
Probiodrug/
Prosidion
liaison non covalente ;
réversible
GW-229A GlaxoSmithKline liaison covalente ;
modification d’activité
STV, vol. 18, n° 5, mai 2006
268
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

Conclusion
Les analogues du GLP-1 pourraient ouvrir prochainement
une nouvelle voie dans le domaine du traitement du déficit
bcellulaire du diabétique de type 2, car en plus de leur effet
glucose-dépendant sur l’insulinosécrétion, ils augmentent
la synthèse de l’hormone et exercent un effet trophique sur
la cellule b. Les contraintes liées à l’administration paren-
térale, leurs effets indésirables digestifs et leur coût proba-
blement supérieur à celui des thérapeutiques classiques en
limiteront toutefois l’utilisation. D’un maniement plus sim-
ple, les inhibiteurs de la DPP-IV offrent également des
perspectives thérapeutiques intéressantes, mais des don-
nées cliniques supplémentaires sont nécessaires avec les
diverses molécules de cette classe extrêmement hétérogène
pour en préciser les modalités optimales d’utilisation théra-
peutique et la toxicité éventuelle liée à une interférence
avec le clivage enzymatique d’autres substances peptidi-
ques naturelles. ■
Références
1. Nauck MA, Meier J-J. Glucagon-like peptide 1 and its derivatives in the
treatment of diabetes. Regul Pept 2005 ; 128 : 135-48.
2. Gautier JF, Fetita S, Sobngwi E, Salaün-Martin C. Biological actions
of the incretins GIP and GLP-1 and therapeutic perspectives in patients
with type 2 diabetes. Diabetes Metab 2005 ; 31 : 233-42.
3. Holst JJ, Orskovc C. The incretin approach for diabetes treatment.
Modulation of islet hormone release by GLP-1 agonism. Diabetes 2004 ;
53 : S197-S204.
4. Nielsen LL. Incretin mimetics and DPP-IV inhibitors for the treatment
of type 2 diabetes. DDT 2005 ; 10 : 703-10.
5. Deacon CF. Perspectives in diabetes. Therapeutic strategies based on
glucagon-like peptide 1. Diabetes 2004 ; 53 : 2181-9.
6. Keating GM. Exenatide. Drugs 2005 ; 65 : 1681-92.
7. Feinglos MN, Saad MF, Pi-Sunyert FX. Effects of liraglutide
(NN2211), a long-acting GLP-1 analogue, on glycaemic control and
bodyweight in subjects with type 2 diabetes. Diabet Med 2005 ; 22 :
1016-23.
8. Demuth HU, McIntosh CHS, Pederson RA. Type 2 diabetes. Therapy
with dipeptidyl peptidase IV inhibitors. Biochim Biophys Acta 2005 ;
1751 : 33-44.
9. Lankas GR, Leiting B, Roy RS, et al. Dipeptidyl peptidase IV inhibi-
tion for the treatment of type 2 diabetes. Potential importance of selectivity
over dipeptidyl peptidases 8 and 9. Diabetes 2005 ; 54 : 2988-94.
Abstract
GLP-1 derivatives and dipeptidyl peptidase
IV inhibitor in the treatment of type 2
diabetes
The discovery of the therapeutic potential of GLP-1, an
insulinotropic gut hormone, in the management of
type 2 diabetes has led to the development of several
incretin mimetics, such as exenatide, or long acting
GLP-1 analogues, such as liraglutide. Given subcuta-
neously, these agents have demonstrated their efficacy
in reducing blood glucose and HbA1c levels of type 2
diabetic patients, without any increase in the incidence
of hypoglycaemia or weight gain. The pharmacologic
inhibition of the dipeptidyl peptidase IV, the enzyme
responsible for the inactivation of the natural GLP-1 is
another promising approach in diabetes therapy. Some
of these inhibitors, which can be given orally, are
presently tested in phase 3 clinical trials. Their metabo-
lic efficacy seems to be established but further studies
are needed in order to assess their safety which could
probably be increased with the development of highly
selective enzyme inhibitors.
Key words: 2 diabetes, GLP-1, exenatide, liraglutide,
dipeptidyl peptidase IV
STV, vol. 18, n° 5, mai 2006 269
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.
1
/
5
100%