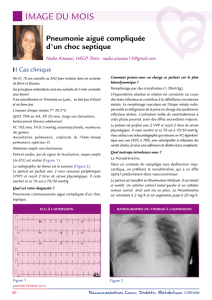
Traitement de la défaillance cardiaque

Traitement de la défaillance cardiaque
S. Marqué et A. Cariou
Introduction
Éléments de physiopathologie
L’existence d’une dysfonction myocardique transitoire au cours du sepsis sévère
et du choc septique est désormais un fait établi et non contesté. Le tableau
hémodynamique observé dans cette situation est complexe et évolutif : carac-
térisé initialement par une vasoplégie et un débit cardiaque élevé, il peut
évoluer vers une défaillance cardiaque associant dysfonctions systolique et dias-
tolique. La dysfonction myocardique observée au cours du sepsis est
classiquement maximale au cours des vingt-quatre premières heures. Sa réver-
sion complète est habituellement observée en sept à dix jours chez les
survivants (1). Chez les non-survivants, la fonction ventriculaire gauche
continue de s’altérer, malgré le support inotrope, et contribue fréquemment au
décès du patient. Les mécanismes concourant à la survenue de cette dysfonc-
tion myocardique ne sont pas univoques et font intervenir de nombreux
éléments de la réponse inflammatoire systémique. À l’échelon cellulaire, le
monoxyde d’azote semble jouer un rôle particulièrement important dans la
transmission du signal conduisant à l’apparition de ces anomalies contractiles.
Éléments d’appréciation de la défaillance cardiaque
Les anomalies circulatoires observées au cours du choc septique rendent diffi-
cile l’individualisation d’une dysfonction myocardique indépendamment
d’une anomalie des conditions de charge (2). La plupart des indices couram-
ment employés pour évaluer la fonction systolique ventriculaire gauche ne sont
pas exclusivement le reflet de la performance myocardique, mais sont égale-
ment sous la dépendance de la pré- et/ou de la post-charge ventriculaire. Une
interprétation correcte des données de la littérature nécessite une bonne
connaissance de ces indices et de leurs limitations d’interprétation.

Débit cardiaque et fraction d’éjection du ventricule gauche (FEVG)
Au cours du choc septique, la tachycardie et la réduction de la post-charge
contribuent conjointement au maintien ou à l’augmentation du débit
cardiaque. À l’inverse, l’hypovolémie engendre une diminution du débit
cardiaque par réduction de la précharge. Le débit cardiaque n’est donc pas un
bon indice de contractilité cardiaque, sa normalité n’excluant en rien l’exis-
tence d’une altération des performances systoliques ventriculaires (3). La
FEVG n’est pas non plus un bon reflet de la contractilité cardiaque, car elle
dépend également de la compliance myocardique et des conditions de charge.
Les mêmes remarques s’appliquent aux indices échographiques tendant à
estimer la FRDS (fraction de raccourcissement de diamètre et de surface) (4).
Indices indépendants des conditions de charge du ventricule gauche
Ces indices, peu nombreux, ont cependant permis de démontrer l’existence
d’une altération des propriétés contractiles ventriculaires, dans des modèles
expérimentaux, mais aussi au cours d’études cliniques.
Les plus utilisés demeurent l’indice systolique de travail ventriculaire
gauche indexé (ISWVG) et la pente de la relation qui lie cet indice à la
précharge du ventricule gauche (VG), appréciée par la mesure de la pression
télédiastolique ventriculaire gauche (PTDVG) chez l’animal et par la pression
artérielle pulmonaire d’occlusion (PAPO) chez l’homme. L’élastance ventricu-
laire est plus intéressante, mais plus difficile à mesurer. Sur les boucles
pression-volume ventriculaires tracées pour différents niveaux de post-charge,
les points télé-systoliques forment une droite stigmatisant la relation pression-
volume télé-systolique du ventricule gauche. Cette relation est un bon reflet de
la fonction ventriculaire car elle ne dépend pas de la pré-charge et tient compte
dans son calcul du niveau de post-charge. La pente de cette droite, appelée élas-
tance maximale (Emax), est un bon indice de contractilité ventriculaire. Dans
le choc septique, Emax est diminuée, témoignant d’une contractilité altérée.
Restauration d’une pré-charge adéquate
Optimisation du remplissage
Un des premiers objectifs du traitement de la défaillance myocardique observée
dans le choc septique demeure la restauration d’une volémie correcte (5). Il
existe en effet, dans cette situation, une hypovolémie absolue ou relative multi-
factorielle (vasoplégie, fuite capillaire, fièvre) mais constante. Une expansion
volémique adéquate, en augmentant le retour veineux, permet d’améliorer la
pré-charge ventriculaire gauche et, de ce fait, d’augmenter le débit cardiaque.
Chez les patients en choc septique, le remplissage augmente la survie, en
240 Sepsis sévère et choc septique

augmentant le débit cardiaque et en redistribuant les débits régionaux vers les
territoires initialement hypoperfusés (6).
Indices cliniques et biologiques
Si la nécessité d’un remplissage initial dans le choc septique ne fait plus aucun
doute, les objectifs à atteindre et les indices de monitorage à employer restent
plus controversés. En effet, poursuivre le remplissage tant que le débit
cardiaque augmente pourrait être susceptible d’induire un œdème pulmonaire,
en particulier chez les patients dont la sévérité de la dysfonction myocardique
limite la tolérance à l’expansion volémique (7). Dans un premier temps, le
remplissage est guidé par des indices cliniques classiques tels que la fréquence
cardiaque, la pression artérielle et la diurèse horaire. Chez les patients qui ne
corrigent pas ces paramètres rapidement, un monitorage plus complet s’impose
(8). En dehors des patients chez qui l’atteinte respiratoire est au premier plan,
le remplissage vasculaire doit donc viser à maximaliser le débit cardiaque.
L’altération des échanges gazeux peut être détectée de façon simple par l’oxy-
métrie de pouls ou la mesure de la pression artérielle en oxygène (PaO2) (8). Le
paramètre classiquement recommandé en pratique clinique pour guider le
remplissage est la PAPO : une valeur comprise entre 12 et 15 mmHg témoi-
gnerait chez la plupart des patients d’un débit cardiaque maximal (9).
Cependant, plusieurs études ont récemment souligné la faible valeur de la
PAPO pour prédire un bénéfice au remplissage vasculaire (10) : en effet, la
PAPO n’est pas un bon indicateur de pré-charge ventriculaire gauche lorsque
la compliance ventriculaire gauche est diminuée, comme c’est le cas dans le
choc septique (11). Afin de prédire la réponse au remplissage en termes de
débit cardiaque, d’autres méthodes moins invasives ont fait la preuve de leur
efficacité. C’est le cas en particulier pour la mesure des variations respiratoires
de la pression pulsée (12).
Catécholamines
Dopamine
La dopamine a souvent été proposée en première intention dans le traitement
du choc septique, dans le but d’agir à la fois sur la dysfonction myocardique et
la vasoplégie. Classiquement, à des posologies de 5 à 10 µg/kg/min, elle induit
une augmentation de la fréquence cardiaque, du volume d’éjection systolique
et du débit cardiaque, par stimulation des récepteurs β1. À des posologies plus
élevées, supérieures à 10 µg/kg/min, apparaissent des effets vasoconstricteurs
α-mimétiques. Toutefois, ce seuil n’est qu’indicatif : les effets inotrope et vaso-
constricteur de la dopamine sont peu prédictibles chez les patients en état de
Traitement de la défaillance cardiaque 241

choc, même à faible posologie. Ainsi, dans une étude menée chez dix patients
en choc septique, Schreuder et al. (13) notaient une augmentation du débit
cardiaque sous dopamine à la posologie de 20 µg/kg/min, mais sans augmen-
tation significative des résistances vasculaires systémiques. Ces résultats ont été
plus récemment confirmés pour des posologies plus élevées, suggérant que les
effets hémodynamiques de la dopamine résultent presque exclusivement de son
action sur le myocarde.
La dopamine reste actuellement recommandée en première intention dans
le choc septique, en particulier dans les cas où la contractilité myocardique est
altérée sans baisse importante des résistances systémiques (5). En pratique, sa
faible efficacité dans cette situation lui fait le plus souvent préférer une caté-
cholamine plus puissante.
Dobutamine (voir Annexe 1)
Par ses propriétés β1-adrénergiques, la dobutamine augmente la contractilité
cardiaque. Elle agit aussi sur les récepteurs β2-adrénergiques, entraînant une
vasodilatation périphérique partiellement compensée par une faible activité
α-adrénergique.
L’administration de dobutamine est justifiée et recommandée dans une
situation de bas débit cardiaque, en pratique pour un index cardiaque inférieur
à 2,5 l/min (8). Cependant, ses indications ont progressivement été élargies
depuis les années 1990. C’est, en effet, durant cette période qu’est apparu le
concept de supranormalisation systématique du transport en oxygène, concept
qui a pour but in fine d’augmenter la consommation globale d’oxygène (VO2)
et de corriger la dette tissulaire en oxygène observée dans le choc septique (14).
La dobutamine faisait partie des moyens à mettre en œuvre pour parvenir à cet
objectif, en augmentant systématiquement le débit cardiaque pour atteindre
des valeurs supra-physiologiques (15). Plusieurs essais randomisés ont comparé
l’administration de dobutamine dans le but d’augmenter le transport en
oxygène à un traitement classique du choc septique, mais aucun n’a démontré
la supériorité d’une majoration systématique du débit cardiaque au-delà des
valeurs physiologiques (16). Dans une étude regroupant 109 patients de réani-
mation, Hayes et al. (17) ont étudié l’influence sur la mortalité d’un traitement
par dobutamine à des posologies permettant d’atteindre un index cardiaque
supérieur à 4,5 l/min, une valeur de transport en oxygène supérieure à
600 ml/min et une valeur de VO2supérieure à 170 ml/min. Dans le groupe
contrôle, les patients n’étaient traités par dobutamine que s’ils présentaient un
index cardiaque inférieur à 2,8 l/min. Un remplissage adéquat était assuré dans
les deux groupes avant toute administration de catécholamines. La mortalité
s’est avérée supérieure dans le groupe traité par dobutamine (54% vs 34% dans
le groupe contrôle). L’hypothèse avancée pour expliquer cette surmortalité est
celle d’une incapacité à faire face à l’augmentation des besoins énergétiques
médiée par l’administration de catécholamines à de telles posologies (18).
242 Sepsis sévère et choc septique

Si la dobutamine ne doit pas être utilisée à titre systématique, elle reste
cependant utile chez les patients présentant une défaillance cardiaque sévère,
d’autant plus que la vasodilatation induite par l’activation des récepteurs β2
pourrait être bénéfique pour certains organes comme le myocarde et le tube
digestif (19). Il est cependant nécessaire de lui adjoindre un vasoconstricteur
périphérique.
Noradrénaline
La noradrénaline est avant tout un puissant agent vasopresseur par le biais de
son action sur les récepteurs α1. Elle possède cependant une action β1-
adrénergique à l’origine d’une augmentation (modeste) de la contractilité
myocardique.
Il est à présent démontré que la noradrénaline est plus efficace que la dopa-
mine pour améliorer la pression artérielle moyenne (PAM) chez des patients en
état de choc septique hyperkinétique. Le rétablissement d’une pression de
perfusion satisfaisante permet, dans la majorité des cas, d’améliorer la fonction
rénale et la diurèse de ces patients (20).
L’impact de la noradrénaline sur le débit cardiaque au cours du choc
septique reste controversé. Dans une majorité d’études, le débit cardiaque
n’augmente pas de façon significative, voire diminue de façon marquée (21,
22). Dans une étude récente portant sur un faible collectif de patients présen-
tant un index cardiaque de 4,7 l/min/m2pour une PAM à 65 mmHg,
l’administration de noradrénaline permettait, en atteignant l’objectif d’une
PAM à 85 mmHg, de majorer l’index cardiaque de près de 20% (23).
La noradrénaline est recommandée chez les patients en choc septique sans
atteinte importante de la contractilité myocardique. Dans le cas contraire, il est
nécessaire de recourir à l’association dobutamine-noradrénaline ou à l’adréna-
line en monothérapie (5).
Adrénaline
L’adrénaline combine des effets α-, β1- et β2-mimétiques. À faible dose, elle
est avant tout un agent β1- et β2-agoniste, entraînant une augmentation du
débit cardiaque ainsi qu’une vasodilatation périphérique. À plus forte dose, ses
propriétés vasopressives prédominent et se traduisent par une élévation des
résistances vasculaires périphériques.
L’adrénaline présente un intérêt dans les états de choc septique réfractaires
aux autres catécholamines, en augmentant de façon significative l’index
cardiaque et le volume d’éjection systolique, avec une action plus modeste sur
la fréquence cardiaque et les résistances vasculaires systémiques (24). Elle
permet également d’améliorer la contractilité ventriculaire droite chez les
Traitement de la défaillance cardiaque 243
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%