Renseignements importants sur l`innocuité de CELEXA : Mise en

Health Santé
Canada Canada Direction générale des produits de santé et des aliments
Health Products and Food Branch
La Direction générale des produits de santé et des aliments (DGPSA) affiche sur le site Web de Santé Canada des
avertissements concernant l'innocuité des produits de santé, des avis de santé publique et des communiqués de presse
afin d'être utilisés par les professionnels de la santé, les consommateurs et les autres parties intéressées. Ces avis sont
parfois préparés avec les Directions de la DGPSA, incluant les secteurs pré-commercialisation et post-
commercialisation, ainsi qu'avec les détenteurs d'autorisation de mise en marché et autres intervenants. Bien que la
DGPSA soit responsable de l'homologation des produits thérapeutiques aux fins de mise en marché, elle n'endosse ni le
produit ni la compagnie. Toute question concernant l'information relative à un produit devrait faire l'objet d'une
discussion avec votre professionnel de la santé.
La présente est une copie d’une lettre de Lundbeck Canada Inc.
Veuillez communiquer avec la compagnie pour obtenir copie de toute référence, pièce jointe ou annexe.
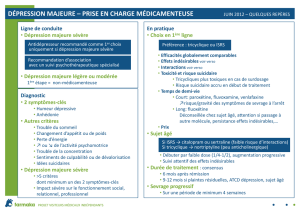
Renseignements importants en matière d’innocuité
approuvés par Santé Canada concernant
CELEXA (bromhydrate de citalopram)
Lundbeck Canada Inc.
413, rue St-Jacques Ouest
Bureau FB-230
Montréal, QC H2Y 1N9
le 26 mai 2004
Objet :RENSEIGNEMENTS IMPORTANTS SUR L'INNOCUITÉ DE CELEXA :
MISE EN GARDE concernant le risque de changements comportementaux et
émotifs, voire d’automutilation, chez les patients traités par un ISRS ou un autre
antidépresseur de nouvelle génération
Avis aux professionnels de la santé
À la suite de discussions avec Santé Canada, Lundbeck Canada Inc. désire vous faire part de
renseignements importants sur l'innocuité des ISRS (inhibiteurs sélectifs du recaptage de la
sérotonine) et des autres antidépresseurs de nouvelle génération, ces derniers pouvant être
associés à des changements comportementaux et émotifs, voire d’automutilation.
La mise en garde de classe que l'on ajoutera à la monographie de Celexa® (bromhydrate de
citalopram) est la suivante :

RISQUE DE CHANGEMENTS COMPORTEMENTAUX ET ÉMOTIFS,
VOIRE D’AUTOMUTILATION
Enfants et adolescents : Données tirées d'essais cliniques comparatifs avec placebo
•Des analyses récentes de bases de données d'essais cliniques sur l'innocuité des
ISRS et des autres antidépresseurs de nouvelle génération laissent supposer que
l'utilisation de ces médicaments chez des patients de moins de 18 ans pourrait être
associée à des changements comportementaux et émotifs et peut-être même
comporter un risque accru d'idées et de comportements suicidaires par rapport à un
placebo.
•Le petit nombre de patients dans les bases de données d'essais cliniques et la
variabilité des taux enregistrés dans les groupes placebo ne permettent pas de tirer
des conclusions fiables quant à l'innocuité relative de ces médicaments.
Adultes, enfants et adolescents : Données supplémentaires
•Lors d'essais cliniques et de programmes de pharmacovigilance sur les ISRS et les
autres antidépresseurs de nouvelle génération – lesquels essais ou programmes
englobaient à la fois des enfants, des adolescents et des adultes – on a signalé des
effets indésirables sévères de type agitation couplés à des actes d’automutilation ou
à des comportements agressifs à l'égard d'autrui. Ces effets indésirables de type
agitation sont les suivants : akathisie, agitation, désinhibition, labilité émotionnelle,
hostilité, agressivité, dépersonnalisation. Dans certains cas, ces effets indésirables
sont apparus plusieurs semaines après le début du traitement.
Il est conseillé de suivre rigoureusement l'état clinique du patient, peu importe son
âge, afin de déceler les idées suicidaires ou tout autre indice du risque de
comportement suicidaire. Cette surveillance inclut les changements
comportementaux et émotifs de type agitation.
Symptômes de retrait
On NE doit PAS mettre fin abruptement au traitement par Celexa® (bromhydrate de
citalopram) en raison du risque de symptômes de retrait. Lorsque le médecin décide
d'arrêter un traitement par un ISRS ou un autre antidépresseur de nouvelle génération,
on recommande une baisse graduelle de la dose par opposition à un arrêt soudain.
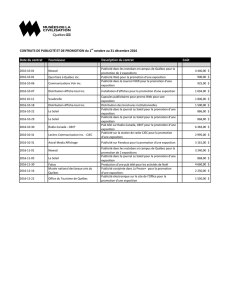
Il importe de souligner qu'un lien causal entre, d'une part, les ISRS et les autres antidépresseurs
de nouvelle génération et, d'autre part, le risque d’automutilation ou de comportement agressif à
l'égard d'autrui, n'a pas été établi. La possibilité d'une tentative de suicide est inhérente à la
dépression et à d'autres troubles psychiatriques et peut persister jusqu'à l'obtention d'une
rémission. On doit donc surveiller les patients étroitement pendant toute la durée du traitement et
envisager avec sérieux le besoin éventuel d'hospitalisation. La présente mise en garde invite les
cliniciens à suivre de près tous les patients recevant un ISRS et d'autres antidépresseurs de
nouvelle génération afin de déceler toute aggravation clinique, l'apparition ou l'aggravation d'effets
indésirables de type agitation ou tout autre indice du risque de comportement suicidaire.
L’utilisation du citalopram n'est pas indiquée chez les enfants et les adolescents.

Ajout de nouvelles données dans la section « Renseignements pour le consommateur »
La section « Renseignements pour le consommateur » de la monographie du produit a été mise à
jour afin de refléter cette mise en garde de classe. Elle vise à faire comprendre aux patients qu'un
traitement par un ISRS ou un autre antidépresseur de nouvelle génération est des plus sûrs et
des plus efficaces lorsqu'il y a une bonne communication avec le médecin traitant et que celui-ci
sait vraiment comment le patient se sent.
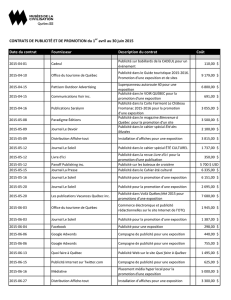
Contexte
En février 2004, on a demandé à un groupe consultatif scientifique mis sur pied par Santé Canada
d'émettre une opinion clinique sur les résultats d'essais cliniques réalisés chez des enfants et des
adolescents et sur certains cas signalés dans le cadre de programmes de pharmacovigilance
quant à l'innocuité des ISRS et des autres antidépresseurs de nouvelle génération. Les membres
du groupe se sont entendus pour affirmer qu'une contre-indication n'était pas justifiée pour ces
médicaments et a appuyé la recommandation de Santé Canada d'émettre une mise en garde. Le
groupe a par ailleurs formulé quelques suggestions et commentaires. Le compte rendu des
délibérations et d'autres renseignements sur le groupe consultatif peuvent être consultés sur le
site Web de Santé Canada :
http://www.hc-sc.gc.ca/hpfb-dgpsa/tpd-dpt/sap_ssri_2004-02-20_rop_f.html.
Lundbeck Canada Inc. continue de travailler en étroite collaboration avec Santé Canada pour
surveiller la déclaration des effets indésirables et assurer la disponibilité de données à jour sur
l'utilisation de Celexa® (bromhydrate de citalopram).
L'identification, la caractérisation et la prise en charge des effets indésirables liés aux
médicaments dépendent d'une participation active des professionnels de la santé aux
programmes de surveillance des effets indésirables des médicaments. Les professionnels de la
santé sont priés de signaler tout effet indésirable suspecté chez les patients prenant Celexa®
(bromhydrate de citalopram) directement à Lundbeck Canada Inc. ou à Santé Canada dont voici
les coordonnées :
Lundbeck Canada Inc.
413, rue St-Jacques Ouest
Bureau FB-230
Montréal, QC H2Y 1N9
Service d'information médicale de Lundbeck Canada Inc. :
1 866 880-4636 (sans frais) ou (514) 844-8088 (appels locaux).
Tout effet indésirable présumé peut aussi être déclaré au :
Programme canadien de surveillance des effets indésirables des médicaments (PCSEIM)
Direction des produits de santé commercialisés
SANTÉ CANADA
Indice de l’adresse : 0701C
OTTAWA (Ontario) K1A 0K9
Tél. : (613) 957-0337 ou télécopieur : (613) 957-0335
Pour déclarer un effet indésirable, les consommateurs et les professionnels de la santé peuvent composer ces lignes
sans frais:
Tél: 866 234-2345 ou télécopieur : 866 678-6789
Pour obtenir d’autres renseignements, veuillez rejoindre la personne ressource.
On peut trouver le formulaire de notification des EI et les Lignes directrices concernant des EI sur le site Web de Santé
Canada ou dans le Compendium des produits et des spécialités pharmaceutiques.
http://www.hc-sc.gc.ca/hpfb-dgpsa/tpd-dpt/adverse_f.html
http://www.hc-sc.gc.ca/hpfb-dgpsa/tpd-dpt/adr_guideline_f.html

En contribuant au dépistage précoce des signes et à une utilisation appropriée des médicaments,
vous vous engagez à protéger le bien-être de vos patients.
Pour toute question, les professionnels de la santé peuvent communiquer avec le Service
d'Information médicale de Lundbeck Canada Inc. aux numéros suivants : 1 866 880-4636 (sans
frais) ou (514) 844-8088 (appels locaux).
Veuillez agréer l'expression de nos sentiments les meilleurs.
originale signée par
Marie Gagné, Ph.D.
Director, Medical and Clinical Department
Lundbeck Canada Inc.
1
/
4
100%