Intoxications graves par médicaments et/ou substances illicites

Intoxications graves
par médicaments
et/ou substances illicites
admises en réanimation :
spécificités pédiatriques
Olivier Brissaud
1
*, Laurent Chevret
2
*, Isabelle Claudet
3
*
1
Unité de réanimation pédiatrique, Hôpital des Enfants, place Amélie Raba Léon,
33076 Bordeaux Cedex
2
Unité de réanimation pédiatrique, Hôpital Bicêtre, 78 rue du Général Leclerc
94270 Le Kremlin Bicêtre
3
POSU pédiatrique, Hôpital des Enfants, 330 avenue de Grande Bretagne,
31059 Toulouse Cedex 9
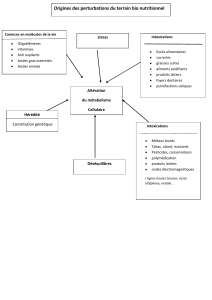
Les intoxications aiguës chez l’enfant nécessitant une prise en charge en Unité
de Réanimation Pédiatrique (URP) restent rares. Le caractère « dynamique » de
l’intoxication, avec la possibilité d’une symptomatologie différée ou retardée
explique l’importance d’une surveillance (généralement < à 12 heures). Une
intoxication grave en pédiatrie est définie par la nécessité d’une surveillance
en URP du fait de la quantité potentiellement létale de la substance absorbée et/
ou des manifestations cliniques. Nous développons les spécificités pédiatriques
des intoxications graves par médicaments et substances illicites d’un point de
vue épidémiologique, définition, toxidromes, prise en charge symptomatique et
spécifique (techniques et antidotes). Nous avons exclu les intoxications involon-
taires iatrogènes. Nous n’abordons pas l’aspect psychiatrique. Nous évoquons
deux nouvelles substances : la méthadone et l’ecstasy.
Mots clés : intoxication médicamenteuse, substances illicites, paracétamol
Épidémiologie
Il n’existe pas de registre français
exhaustif de recueil des intoxications
médicamenteuses chez l’enfant.
La distribution de ces intoxications se
fait selon deux pics de fréquence,
36 mois et 14 ans, correspondant res-
pectivement à deux mécanismes [1-
4] : ingestion accidentelle (prédomi-
nance masculine) et volontaire
(prédominance féminine). Volontaire,
l’intoxication est volontiers polymédi-
camenteuse [2]. Les principaux médi-
caments responsables d’intoxications
graves sont ceux ayant une action
sur le système nerveux central
(sédatifs, hypnotiques, anticonvulsi-
vants, antidépresseurs, morphiniques,
etc.) [2]. Seules 0,5 à 2 % des intoxi-
cations médicamenteuses nécessitent
une prise en charge en Unité de Réa-
nimation Pédiatrique (URP) [2-4].
La mortalité est faible (< 2 %), et aug-
mente avec l’âge [1-3, 5, 6]. Les médi-
caments le plus souvent reliés à la
survenue d’un décès sont les anti-
dépresseurs tricycliques, les anti-
convulsivants (barbituriques, val-
m
t
p
Tirés à part : O. Brissaud
doi: 10.1684/mtp.2008.0185
* Les auteurs ont participé à la rédaction de
l’article à part égale.
mt pédiatrie, vol. 11, n° 6, novembre-décembre 2008
Dossier
331
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

proate de sodium, etc.), les analgésiques (paracétamol,
aspirine…) et les médicaments à base de fer [1-3, 5-8].
Nous ne détaillerons pas la prise en charge symptoma-
tique, psychologique. Nous prendrons deux exemples
d’intoxication chez l’enfant : la méthadone et l’ecstasy.
Définition
Une intoxication médicamenteuse grave est définie
par la nécessité d’une surveillance de l’enfant en URP
du fait de la sévérité des symptômes observés (coma,
détresse respiratoire, instabilité hémodynamique) et/ou
de la quantité potentiellement létale absorbée [2].
Critères d’admission en réanimation
Les trois principaux critères d’admission en réanima-
tion sont :
–une défaillance cardiocirculatoire et/ou respira-
toire ;
–une défaillance neurologique ;
–la nécessité d’une surveillance du fait de la dange-
rosité potentielle du ou des toxiques.
On redoutera l’ingestion de produits potentiellement
létaux à faible dose chez l’enfant : inhibiteurs calciques,
clonidine, tricycliques, opiacés, salicylés, sulfamides
hypoglycémiants, agents psychotropes [9].
Toxidromes
Les divers toxidromes n’ont pas de spécificité pédia-
trique (tableau 1) [10].
Place des analyses toxicologiques
La prise en charge d’une intoxication repose sur l’ap-
proche clinique (anamnèse, examen clinique, individua-
lisation de toxidromes) qui oriente les examens complé-
mentaires. Il n’y a pas de spécificité pédiatrique propre
aux analyses toxicologiques.
Épuration des toxiques
Les particularités pédiatriques sont liées aux posolo-
gies employées.
Décontamination digestive des toxiques
Les méthodes sont les vomissements provoqués, le
lavage gastrique, l’administration en dose unique de char-
bon de bois activé, le lavage intestinal et les accélérateurs
du transit.
Sirop d’ipéca
L’émétine, un des principes actifs du sirop d’ipéca [11,
12], a une action irritante sur la muqueuse gastrique et
une action centrale (alcaloïdes). Presque 85 % des
patients vomissent 25 à 30 minutes après l’administration
d’une dose unique de sirop d’ipéca. Aucune étude cli-
nique publiée ne permet d’affirmer l’influence favorable
de l’administration du sirop d’ipéca sur le devenir cli-
nique la fréquence d’hospitalisation ou la durée de séjour
des patients intoxiqués. Son emploi, non recommandé,
doit être abandonné.
Lavage gastrique
Le recours au lavage gastrique systématique doit être
proscrit et son indication discutée au cas par cas, selon les
substances ingérées et le délai par rapport au moment d’in-
Tableau 1. Principaux toxidromes en pédiatrie (d’après [10])
Toxidromes Signes associés Toxiques possibles
Syndrome sympathicomimétique Fièvre, flush, tachycardie, HTA, mydriase, sueurs Antitussif, décongestionnant
Amphétamines, cocaïne
Ecstasy, théophylline
Syndrome
anticholinergique
Mydriase, tremblements, dysarthrie, confusion
Sécheresse des muqueuses, rétention d’urine,
constipation, tachycardie sinusale, convulsions
Vasodilatation capillaire
ADT, antiparkinsonniens
Antihistaminiques, atropine et solanacées (Datura)
Antispasmodique, phénothiazines
Cycloentolate collyre
Syndrome
parasympathicomimétique
Myosis, diarrhée, incontinence urinaire, hypersalivation,
sueurs, faiblesse musculaire, fasciculations, parésie ou
paralysie
Antimyasthénique (pyridostigmine)
Acidose métabolique Tachypnée
Respiration de Kussmaül
Salicylés, fer, antidiabétiques
ADT
Ataxie aiguë et nystagmus Antihistaminiques
AE (carbamazépine, phénytoïne)
Pipérazine, diphénylhydantoïne
Barbituriques, bromures
Vomissements incoercibles Aspirine, théophylline, fer
HTA : hypertension artérielle ; ADT : antidépresseurs tricycliques, AE : antiépileptiques.
mt pédiatrie, vol. 11, n° 6, novembre-décembre 2008
Intoxications graves par médicaments et/ou substances illicites
332
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

gestion [10, 11, 13]. Il est recommandé pour des substances
sur lesquelles le charbon activé n’aurait pas ou peu d’effet
(fer, lithium), lors d’intoxications exposant à un risque vital
et doit s’effectuer précocement, dans la première heure.
Les complications sont : inhalation, hypoxie, troubles du
rythme cardiaque, laryngospasme, perforation digestive,
troubles métaboliques avec des risques en particulier sur
la natrémie (intoxication à l’eau). Des contre-indications
existent : absence de protection des voies aériennes, inges-
tions d’acide fort, de produits alcalins, d’hydrocarbones, et
patients ayant des risques d’hémorragie digestive. En pra-
tique, les volumes préconisés jusqu’à obtention d’un
liquide clair, sont : chez l’enfant : 50 à 100 mL de liquide
isotonique par cycle (total 2 à 5 litres) ; chez l’adolescent :
250 à 350 mL par cycle (total 10 à 15 litres).
Charbon activé
Le charbon de bois activé [10-14] peut adsorber une
grande variété de médicaments et substances toxiques et
pourrait contribuer à une réduction de leur biodisponibi-
lité. Certains produits sont non adsorbés : acides et bases
fortes, alcools et glycols, cyanures, fers et métaux et sels
ionisés : lithium, chlorure de sodium, de potassium, cal-
cium, magnésium, chlorates. En administration unique, le
charbon activé est recommandé dans l’heure qui suit l’in-
gestion de toxique mais il n’existe pas de preuve formelle
de l’amélioration du pronostic des patients traités par
administration de charbon activé, même dans ces condi-
tions. La dose préconisée est 1 g/kg en dessous d’un an
puis 25 à 50 g entre un et douze ans et 25 à 100 g chez
l’adolescent et l’adulte. Les contre-indications sont :
trouble de conscience, antécédents digestifs, risque de
survenue d’une pneumopathie d’inhalation. Les complica-
tions comprennent : vomissements (fréquents), la pneu-
mopathie d’inhalation (redoutable), de rares cas d’abra-
sion cornéenne par contact direct du produit.
Laxatifs
Les laxatifs ne sont pas recommandés par l’American
Academy of Clinical Toxicology et l’European Association
of Poisons Centers and Clinical Toxicologists dans la prise
en charge des intoxications [11, 15]. Ils sont supposés dimi-
nuer l’absorption digestive des substances (vidange accélé-
rée). Les laxatifs le plus souvent utilisés sont les sels de
magnésium et de sodium et le sorbitol (en association ou
non avec le charbon activé). Aucune étude ne permet de
conclure à l’amélioration du pronostic chez les patients
intoxiqués bénéficiant de ce traitement. En cas d’utilisation,
une seule dose est de rigueur pour minimiser leurs effets
secondaires. Il faut éviter de les administrer en dessous de
l’âge d’un an. Les doses chez les enfants sont les suivantes :
sulfate de magnésium : 250 mg/kg (max 30 g), citrate de
magnésium 10 % : 4 mL/kg (maximum 250 mL), sorbitol à
35 % : 4,3 mL/kg ou 0,5 à 2 g/kg (maximum 50 g).
Les contre indications sont l’iléus paralytique, les syndro-
mes occlusifs intestinaux, l’hypovolémie, les désordres
métaboliques préexistants, l’insuffisance rénale (sels de
magnésium) et l’ingestion de produits caustiques. Les com-
plications sont les vomissements, les nausées, les coliques,
l’hypotension transitoire, la déshydratation, l’hypernatrémie
et l’hypermagnésémie.
Lavage intestinal
Il s’agit d’administrer sur une courte durée une grande
quantité d’une solution osmotique (polyéthylène glycol)
par sonde nasogastrique jusqu’à obtention de selles clai-
res [11, 16]. Il n’existe pas de preuve formelle assurant du
bénéfice du lavage intestinal dans l’amélioration du pro-
nostic chez les patients intoxiqués. Les indications se limi-
tent aux substances à résorption retardée ou à enrobage
entérique (au moins deux heures après leur ingestion) ou
des substances pour lesquelles le charbon activé n’aurait
pas d’efficacité (sels de métaux par exemple). L’utilisation
de cette technique a été proposée pour l’élimination des
toxiques transportés in corpore (héroïne, cocaïne).
Les posologies recommandées sont : enfant de 9 mois à
6 ans : 500 mL/h ; enfants de 6-12 ans : 1 000 mL/h ; au-
delà : 1 500-2 000 mL/h.
Épuration des toxiques
Charbon activé à doses multiples
La justification de l’administration de doses multiples
réside dans la possibilité théorique d’interrompre le cycle
entéro-entérique ou entéro-hépatique ou entéro-gastrique
de certaines substances, ou d’adsorber des substances
présentes tardivement dans le tube digestif : carbamazé-
pine, phénobarbital, dapsone, quinine, théophylline,
digoxine et digitoxine, phénylbutazone, phénytoïne, sota-
lol, piroxicam pour lesquelles on envisagerait des métho-
des d’épuration extrarénales [10, 11, 13, 17]. La posologie
est de 10 à 25 g chez l’enfant, suivie de 0,5 g/kg/4 heures.
Contre-indications absolues : absence de protection des
voies aériennes, troubles de la conscience, l’occlusion
intestinale, pathologie constitutive du tube digestif. Com-
plications : pneumopathie d’inhalation, constipation,
occlusion intestinale, vomissements.
Diurèse alcaline [11, 18]
Elle consiste à augmenter la clairance de certains toxi-
ques par alcalinisation veineuse (sérum bicarbonaté) et
obtenir un pH urinaire > 7,5 (jusqu’à 8,5). Elle s’applique
aux intoxications aux salicylés, phénobarbital, chlorpro-
pamide et méthotrexate. Dans cette dernière intoxication,
l’administration de doses répétées de charbon activé est
plus efficace que la diurèse alcaline. La complication est
essentiellement l’hypokaliémie.
Épuration extrarénale : hémodialyse, hémodiafiltration,
hémoperfusion, échanges plasmatiques,
exsanguino-transfusion, système MARS
Toutes ces méthodes font l’objet de cas rapportés en
pédiatrie et sont des alternatives aux autres modes de
mt pédiatrie, vol. 11, n° 6, novembre-décembre 2008 333
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

décontamination [10, 11, 19]. Elles méritent une argu-
mentation solide, interdisciplinaire. Les études cliniques
concernent surtout l’adulte. Ces techniques sont accepta-
bles si la clairance corporelle totale est augmentée d’au
moins 30 %.
L’hémodialyse
Elle est basée sur le principe de la diffusion, à travers
une membrane semi-perméable, de substances de faible
poids moléculaire et hydrosolubles, avec un petit volume
de distribution (< 2 L/kg), faiblement liées aux protéines,
et dont la clairance totale spontanée est basse. Les études
cliniques (adultes) rapportent un intérêt dans des intoxica-
tions par le lithium, l’acide acétylsalicylique, le valproate
de sodium, procaïnamide, les bromures, la metformine, la
vancomycine et les borates. Il convient aussi de considé-
rer l’hémodialyse dans le traitement des complications
métaboliques aiguës des intoxications. Cette méthode
expose à certaines complications liées à l’abord vascu-
laire, la circulation extracorporelle et à l’anticoagulation.
Hémo(dia)filtration continue
L’hémofiltration est basée sur le principe de la filtra-
tion par un gradient de pression, à travers une membrane
semi-perméable d’eau “plasmatique”et de molécules dis-
soutes de poids moléculaire inférieur à 50 000 daltons.
L’hémodiafiltration associe aussi les principes de l’hémo-
dialyse. L’hémofiltration a été utilisée au cours d’intoxica-
tions par le fer (en combinaison avec le desféral), la digo-
xine, la vancomycine, la diphénhydramine mais sans
preuve d’efficacité. Elle a été utilisée dans les intoxica-
tions aux aminoglycosides et à la théophylline. L’hémo-
diafiltration continue a été utilisée dans quelques cas d’in-
toxication par l’acide valproïque. L’hémodiafiltration
continue peut être une alternative à l’hémodialyse pour
l’intoxication au lithium lorsque cette dernière n’est pas
disponible ou en cas d’instabilité hémodynamique.
Les complications sont identiques à celles de l’hémodia-
lyse.
Hémoperfusion
Elle consiste à faire passer le sang sur une colonne
adsorbante, le plus souvent du charbon activé. L’affinité
de liaison du toxique sur le charbon activé doit être supé-
rieure à celle pour les protéines plasmatiques ou pour les
cellules sanguines. Les toxiques doivent avoir une solubi-
lité pauvre dans l’eau (exemples : carbamazépine, barbi-
turiques, théophylline). L’hémoperfusion peut être une
alternative thérapeutique en cas d’impossibilité d’admi-
nistration orale de charbon activé ou d’inefficacité traite-
ment symptomatique. Une complication fréquemment
retrouvée est une thrombopénie. Les autres complications
sont en rapport avec la technique employée (voies vei-
neuses, circulation extracorporelle).
Molecular Adsorbent Recirculating System (MARS)
Le MARS associe les principes de la dialyse rénale et
ceux d’une dialyse « hépatique » permettant l’élimination
de substances hydrosolubles et de substances fortement
liées à l’albumine. Cette technique a surtout été utilisée
chez l’enfant dans les intoxications aux champignons.
Elle mérite des études complémentaires pour s’assurer
de son efficacité
L’exsanguino-transfusion –Plasmaphérèse
Ces méthodes consistent à échanger la totalité ou une
partie du contenu du secteur vasculaire. Les seules indi-
cations seraient des intoxications par des toxiques dont
l’espace de diffusion est limité au secteur vasculaire ou
extracellulaire (méthémoglobinémie, hémolyses toxiques
aux chlorates de sodium, de potassium et dérivés de l’ani-
line). En fait, ces méthodes ne permettent pas de retirer
des quantités appréciables de toxique et n’ont donc
aucune indication.
Antidotes
Les spécificités pédiatriques sont liées aux posologies
et/ou à l’âge (tableau 2).
N acétylcystéine (NAC) [20-23]
Le risque d’hépatotoxicité chez l’enfant âgé de 1 à
5 ans est plus faible que celui de l’adulte du fait de la
prépondérance du mécanisme de sulfonoconjugaison
dans le métabolisme du paracétamol, de la fréquence
d’utilisation de la galénique liquide de concentration
plus faible en paracétamol et du caractère très souvent
accidentel de l’intoxication à cet âge.
En l’absence de malnutrition ou de prise concomitante
de médicaments inducteurs enzymatiques, il est recom-
mandé de considérer, dans ce groupe d’âge, une dose
toxique plus élevée (dose supposée ou avérée ingé-
rée > 200 mg/kg et paracétamolémie à H2 post-
ingestion > 225 mg/L (pic plasmatique plus précoce des
formes liquides) [20].
Les protocoles d’administration et indications de la
NAC chez l’enfant sont résumés figure 1. En cas d’inges-
tion de doses multiples sur 24 heures, la NAC est indiquée
si la dose ingérée cumulative est > à 150 mg/kg chez l’en-
fant > 6 ans et > à 200 mg/kg chez les enfants < 6 ans.
Alors le nomogramme ne doit pas être utilisé car il sous-
estime le risque hépatotoxique.
Flumazenil (Anexate
®
) [24, 25]
Les indications et précautions sont semblables à
l’adulte. La posologie chez l’enfant est de 10 mcg/kg en
intraveineuse (IV) lent, puis de 10 mcg/kg/h en perfusion
continue si besoin.
mt pédiatrie, vol. 11, n° 6, novembre-décembre 2008
Intoxications graves par médicaments et/ou substances illicites
334
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

Glucagon (Glucagen
®
) [26-29]
Chez l’enfant, le glucagon est proposé comme anti-
dote des intoxications par bêtabloquants, inhibiteurs cal-
ciques ou sulfamides hypoglycémiants dans un cadre
décisionnel bien défini.
La majorité des intoxications accidentelles par bêta-
bloquants chez l’enfant est asymptomatique. L’hypogly-
cémie symptomatique répond habituellement à l’injection
de glucosé par voie orale ou IV. Le recours au glucagon
est indiqué en cas d’hypoglycémie réfractaire et/ou de
dépression myocardique (intoxication massive volontaire
le plus souvent) en complément d’amines pressives.
La posologie recommandée du Glucagen
®
est :
–en cas d’hypoglycémie réfractaire isolée :
•poids < 20 kg : 0,5 mg par voie sous-cutanée (SC),
IV ou intramusculaire (IM),
•poids > 20 kg : 1 mg par voie SC, IV ou IM.
–en cas de dépression myocardique :
•chez le nouveau né : 0,3 mg/kg/4 heures IV/IM/SC
(sans dépasser 1 mg/dose),
•chez l’enfant : 0,025 mg à 0,1 mg/kg IV/IM/SC (sans
dépasser 1 mg par injection) puis 0,025 mg/kg/h en IV
pendant 5 à 12 heures selon l’évolution clinique.
Dans les intoxications par inhibiteurs calciques, en cas
de dépression myocardique, le glucagon peut être utilisé
associé aux amines pressives (posologie : cf. bêtabloquants).
Lors d’une intoxication par sulfamides hypoglycé-
miants chez l’enfant, l’utilisation du glucagon n’est
recommandée qu’après échec d’un traitement avec perfu-
sion de sérum glucosé hypertonique titré pour obtenir une
glycémie supérieure à 0,6 g/L et octréotide IV
(Sandostatine
®
) si disponible. L’inefficacité du glucagon
après trois injections doit faire rejeter cette option (déplé-
tion du stock en glycogène hépatique).
Tableau 2. Posologies des antidotes utilisées en pédiatrie
Toxiques Antidotes
Alpha2-adrénergiques
(solutions nasales, collyres oculaires
contenant dérivés de l’imidazoline)
[36-39]
Coma : naloxone (Narcan
®
)cf.tableau 3
HTA menaçante sans bradycardie : phentolamine (Regitine
®
) IV continu à la dose de 2,5 à 5 mcg/kg/min.
HTA menaçante avec bradycardie : nicardipine (Loxen
®
)1à4mcg/kg/minenIVcontinu.
Amphétamines [34, 35]
Convulsions : diazepam (Valium
®
)
0,5 mg/kg IVL ou IR (sans dépasser 10 mg/dose) puis 1 à 2 mcg/kg/min IV continue.
HTA menaçante : nicardipine (Loxen
®
):0,5à3mcg/kg/hIVcontinu.
Anticholinestérases [40, 41] Sulfate d’atropine 0,02 à 0,05 mg/kg (dose susceptible d’être répétée toutes les 5 à 10 minutes ;
minimum de 0,1 mg/injection et un maximum de 0,5 mg/kg/j)
Antihistaminiques [24] Flumazénil (Anexate
®
) 10 mcg/kg IVL puis 10 mcg/kg/h si nécessaire
Benzodiazépines [25] Flumazénil (Anexate
®
) 10 mcg/kg IVL puis 10 mcg/kg/h si nécessaire
Bêtabloquants [27]
Dépression myocardique : glucagon (Glucagen
®
)
0,025 mg/kg IM ou IV puis 0,025 mg/kg/h IV continue durant 5 à 12 h selon nécessité.
Hypoglycémie : glucagon (Glucagen
®
)
Poids < 25 kg : 0,5 mg sous cutané,
Poids > 25 kg : 1 mg sous cutané.
Troubles de conduction : isoprénaline (Isuprel
®
)
0,1 à 1 mcg/kg/min IV continue (titrage).
Cannabis [42]
Coma : flumazénil (Anexate
®
) 10 mcg/kg IVL puis 10 mcg/kg/h si besoin.
Clonidine [29, 43, 44] Naloxone (Narcan
®
)cf. tableau 3.
Digitaliques [45-47] Anticorps spécifiques (Digidot
®
) 80 mg/flacon : 80 mg neutralisent 1 mg de digoxine ou digitoxine.
Indications : Ingestion dose supérieure à 0,3 mg/kg, en cas de cardiopathie sous-jacente, de concentration sérique de
digoxine ≥6,4 nmol/L (≥5ng/mL),d’arythmie menaçante, d’instabilité hémodynamique, kaliémie ≥6mmol/L.
Fer et sels [48, 49] déféroxamine (Desféral
®
) 15 mg/kg/h IV, réduire la vitesse de perfusion au bout de 4-6 heures sans dépasser 3-6 g
au total ; 100 mg de déféroxamine lient environ 8 mg de fer.
Hypoglycémiants oraux [26, 28] Glucose IV (titration pour maintien de la glycémie > 0,6 g/L).
Hypoglycémie réfractaire : glucagon (Glucagen
®
)
Poids < 25 kg : 0,5 mg sous-cutané,
Poids > 25 kg : 1 mg sous-cutané.
Octréotide (Sandostatine
®
) (4-5 mcg/kg/j divisés en injections toutes les 6 heures, dose maximale 50 mcg
toutes les 6 heures).
Ibuprofène [50]
Convulsions : diazépam (Valium
®
) : 0,5 mg/kg IR ou IV (≤10 mg/dose).
Coma : naloxone (Narcan
®
)cf. tableau 3
Méthadone [32] Naloxone (Narcan
®
)cf. tableau 3
Méthémoglobinémiants [25] Bleu de méthylène 1-2 mg/kg en IV sur 10-15 min et à répéter si besoin.
Opiacés [25] Naloxone (Narcan
®
)cf. tableau 3.
IVL : intraveineux lent ; IR : intrarectal ; IM : intramusculaire.
mt pédiatrie, vol. 11, n° 6, novembre-décembre 2008 335
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.
 6
6
 7
7
 8
8
 9
9
1
/
9
100%