Pathologies chromosomiques : Anomalies du nombre et de la

Page 1 sur 14
UE7 Génétique
Dr B. Doray
Date : 23/01/17 Plage horaire : 8h30 –10h30
Promo : DFGSM3 Enseignant : B. Doray
Ronéistes :
CANDAU Hugo
GOBALSING Sandrine
Pathologies chromosomiques : Anomalies du nombre et de la
structure des chromosomes, Partie 1
I. Introduction
1. Les pathologies génétiques
2. Historique
3. Technique
II. Les anomalies chromosomiques de nombre
1. Les euploïdies
A. Les euploïdies homogènes
B. Les euploïdies en mosaïque
2. Les aneuploïdies
A. Les aneuploïdies homogènes
B. Les aneuploïdies en mosaïque
III. Les anomalies chromosomiques de structure
1. Les anomalies déséquilibrées de la structure des chromosomes
2. Les réarrangements touchant un seul chromosome
A. Les délétions
B. Les duplications
C. Les anneaux
D. Les isochromosomes
E. Les inversions
3. Les réarrangements touchant plusieurs chromosomes
A. Les translocations réciproques
B. Les translocations robertsoniennes

Page 2 sur 14
I. Introduction
1. Les pathologies génétiques
Les pathologies génétiques sont séparées en deux catégories :
Les pathologies géniques, touchant les gènes. Elles sont monofactorielles mendélienne, exemple :
autosomique dominante ou récessive, liée à l’X dominante ou récessive ou mitochondriale d’une part, et
plurifactorielles (ou multifactorielles) d’autre part. Ces pathologies sont étudiées par une analyse des
gènes, à la recherche de possibles mutations. Exemple : myopathie de Duchenne.
Les pathologies chromosomiques affectant les chromosomes, leur nombre et leur structure. Ces
pathologies peuvent être liées à l’environnement dans ce cas elles seront plurifactorielles. La réalisation
d’un caryotype est le moyen d’étude de ces pathologies. Exemple : trisomie 21.
Il faut bien faire la différence
2. Historique
Tjio et Levan en 1956 réalisèrent le premier caryotype humain à 46 chromosomes à partir de fibroblastes
cutanés en culture. Gauthier, Turpin et Lejeune, en 1959, découvrirent pour la première fois une anomalie
chromosomique humaine. Cette anomalie est la trisomie 21 ou syndrome de Down (déjà identifié
cliniquement en France sous le nom de mongolisme).
Dans les années 60, début de la cytogénétique avec les cultures de lymphocytes sanguins permirent
l’analyse chromosomique en routine. C’est là qu’on crée la nomenclature des chromosomes. Les premiers
dépistages néonataux des anomalies chromosomiques eurent lieu en 1966 par amniocentèse, prélèvement de
cellules trophoblastique ou sanguine.
Caspersson en 1971 mit au point des techniques de dénaturation des chromosomes donnant les bandes
chromosomiques (véritable code barre qui permet de les identifier).
Les sites fragiles furent découverts par Sutherland en 1977(grâce à des cultures en milieu pauvre en acide
folique). Ce sont des sites de plus grandes fragilités dans les chromosomes. Exemple : syndrome de l’X
fragile, maladie génique dans lequel la fragilité se trouve sur le bras long de ce gonosome. La technique
d’étude du caryotype en haute résolution (550 à 850 bandes) fut mise au point en 1980. Elle permet de
rechercher et d’analyser des plus petites anomalies chromosomiques.
Les anomalies chromosomiques peuvent conduire à :
Des malformations.
Une déficience cognitive (on ne dit plus « retard mental » car un retard implique qu’on peut le
rattraper).
Des cancers (particulièrement dans les leucémies).
Un caryotype permet l’analyse d’anomalie de 5 à 10 Mb au minimum (donc ne détecte que les grosses
anomalies). La FISH (Fluorescent In Situ Hybridation) permet quant à elle l’étude maximale d’anomalie de
1 à 3 Mb (analyse ciblée : on cible une partie d’un chromosome en particulier, pas tous les
chromosomes, La technique de CGH array ou de puce à ADN est plus précise et permet d’analyser des
modifications chromosomiques de l’ordre de 50 à 100 kb (ATTENTION : on ne parle toujours pas là
d’études géniques ici).
3. Technique
La réalisation d’un caryotype nécessite le consentement éclairé du patient ou de son représentant légal. On
effectue un prélèvement de 5 à 10 mL de sang sur de l’héparine stérile (tube vert). On peut se contenter
de 1 mL pour les enfants. Le prélèvement devra être accompagné d’informations cliniques du patient, il
faudra préciser l’urgence de la réalisation de cette analyse. Exemple : prénatal, trisomie 21, sexe
(différenciation)…

Page 3 sur 14
Le caryotype « standard » métaphasique
Le caryotype « standard » métaphasique est l’examen de base pour l’étude des chromosomes. C’est un
examen non automatisé qui est presque entièrement réalisé par un humain, et pas un automate (on le fait à
l’oeil). Son niveau de résolution est d’environ 400 à 550 bandes, pour un niveau de précision de l’ordre de 5
à 10 Mb. On regarde au moins 20 cellules. Les indications de cet examen sont larges et non orientées.
La réalisation d’un caryotype « standard » intervient dans le diagnostic :
De toutes les anomalies de nombre homogènes.
De la plupart des anomalies de nombre en mosaïque.
De la plupart des anomalies de structure terminales ou intercalaires (= à l’intérieur du chromosome).
Exemple : réalisation d’un caryotype métaphasique devant un déficit cognitif, un retard de croissance, etc…
Coloration des bandes au Giemsa : 2 types de bandes
Bandes “G” après traitement à la trypsine (sombres) => riches en AT, plutôt à l’intérieur des
chromosomes,
Bandes “R” après traitement à la chaleur (claires) => riches en GC, très représentées au
niveau des gènes => meilleure coloration des télomères (plutôt à l’extrémité des chromosomes).
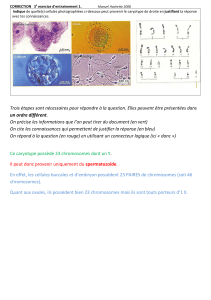
Figure 1: Caryotype normal, (46, XX).
Les anomalies chromosomiques sont fréquentes, elles induisent des altérations dans l’embryogénèse et la
foetogènese. Les anomalies chromosomiques concernent :
20% des ovocytes, cette proportion étant variable avec l’âge maternel (plus il
augmente et plus la proportion d’anomalies chromosomiques au sein des ovocytes augmente).
10% des spermatozoïdes (la maturation a plus de mal à se faire pour les spermatozoïdes dans ce cas
d’où le pourcentage plus faible).
30% des conceptions.
50% des embryons à J3, les modifications à ce stade se traduisent surtout par un mosaïcisme.
10% des fœtus du premier trimestre.
Durant le premier trimestre, il y aura de nombreuses modifications chromosomiques, il aura une proportion
plus importante de fausses couches lors de cette période. Du fait d’une régulation drastique des anomalies
0,4% des nouveau-nés présenteront une anomalie déséquilibrée (avec la technique très basique du
caryotype). Cette proportion est variable en fonction de la résolution de la méthode cytogénétique.
Parmi les anomalies chromosomiques ont décrit deux types d’anomalies :
Les anomalies de nombre.
Les anomales de structure.
II. Les anomalies chromosomiques de nombre
Les anomalies de nombre sont-elles mêmes divisées en deux sous types d’anomalies :
Les anomalies euploïdes.
Les anomalies aneuploïdes.

Page 4 sur 14
1. Les euploïdies
Pour rappel le nombre normal de chromosomes normal est de 46 soit 2N, où N est le nombre de
chromosomes dans un gamète haploïde normal. Les euploïdies sont des anomalies du nombre de copie de
tous les chromosomes (la plupart du temps des polyploïdies).
Exemple : la triploïdie 3N, la tétraploïdie 4N.
Figure 2: Triploïdie (69, XXX).
Les anomalies euploïdes peuvent être homogènes, touchant toutes les cellules de l’organisme, ou en
mosaïque, affectant un seul contingent de cellules.
Elle ne s’intéresse pas aux formules chromosomiques (comme le 69, XXX)
A. Les euploïdies homogènes
Les anomalies euploïdes homogènes sont conséquence d’un événement méiotique ou d’un événement ayant
eu lieu lors de la fécondation. Les anomalies de la méiose touchent principalement les spermatozoïdes. Ces
anomalies, homogènes, concernent toutes les cellules de l’organisme.
In vivo, les anomalies euploïdes homogènes peuvent provenir :
De la fécondation d’un ovocyte par deux spermatozoïdes haploïdes ou de la fécondation d’un
ovocyte par un spermatozoïde diploïde.
D’une non-expulsion du deuxième globule polaire.
Cas de la triploïdie
Les triploïdies provoquent dans la majorité des cas des fausse-couches précoces. On observera un retard de
croissance intra-utérin non harmonieux (petit corps alors que le périmètre crânien est préservé) associé à des
anomalies cérébrales et cardiaques. Au niveau des extrémités, des syndactylies pourront être observées.
Dans ce cas le placenta sera aussi triploïde, conduisant à des altérations de ses fonctions, dont des problèmes
de nutrition du fœtus et des atteintes du développement.
Syndactylie : malformation congénitale caractérisée par l'accolement et une fusion plus
ou moins complète de deux ou plusieurs doigts aux orteils entre eux. La fusion peut se
situer au niveau de la peau ou simultanément des os et de la peau. (Wikipédia)
B. Les euploïdies en mosaïque
Les anomalies euploïdes en mosaïque proviennent d’un événement mitotique. Les anomalies en mosaïque
concernent une partie des cellules. Il faut donc au moins deux populations cellulaires de caryotypes
différents chez un individu issu d’un seul zygote. Le zygote initial est triploïde, mais une perte secondaire au
niveau d’un lot haploïde a eu lieu lors d'une anaphase.
Les euploïdies en mosaïques peuvent entrainer des fausse-couches, un décès fœtal. Mais elles peuvent aussi
être viables si la proportion entre cellules euploïdes et cellules diploïdes le permet.

Page 5 sur 14
Figure 3: Triploïdie en mosaïque (69, XXX/46, XX)
Les signes liés à une euploïdie en mosaïque sont variables. Pourront être observés : une dysmorphie, un
déficit cognitif, des anomalies de la pigmentation, une syndactylie etc.
Il faut pour détecter cela il faut parfois prendre des prélèvements à 2 endroits différents.
2 types de triploïdie :
Digynie : n pat +2n mat => 69, XXX ou 69, XXY
Diandrie : n mat + 2n pat => 69, XXY ou 69, XYY
Le phénotype est variable selon l’origine maternelle ou paternelle du lot supplémentaire.
Digynie :
Fécondation d’un ovule diploïde 2n par un spz n,
Fécondation d’un ovule n’ayant retenu son globule polaire n par un spz n.
Retard de croissance sévère; placenta hypotrophique.
Diandrie :
Fécondation d’un ovule n par deux spz n,
Plus rarement : fécondation d’un ovule n par un spz 2n.
Placenta hypertrophique et multikystique
Rôle du génome paternel dans le développement placentaire.
2. Les aneuploïdies
Les aneuploïdies sont des anomalies du nombre de copie d’un chromosome. Une cellule peut être
aneuploïde par :
L’apparition d’une copie supplémentaire d'un chromosome, on parlera de trisomie libre. Exemple :
les trisomies 21, 18 et 13(ce sont les seules trisomies viables, d’autres le sont mais sous forme
mosaïque).
L’absence d'une copie d’un chromosome, cas des monosomies libres. Exemple : le syndrome de
Turner (45, X la seule viable là aussi).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%