A Monsieur le Professeur Gérard CAMPISTRON

5
A Monsieur le Professeur Gérard CAMPISTRON
Professeur des Universités
Praticien hospitalier
Physiologie-Hématologie
Qui nous a fait l’honneur d’accepter la présidence de notre jury de thèse.
Hommage respectueux.
A Monsieur le Professeur Jacques DUCOS DE LAHITTE
Professeur de l’Ecole Nationale Vétérinaire de Toulouse
Parasitologie et Maladies parasitaires
Qui nous a aidé et dirigé dans notre travail.
Qu’il trouve ici l’expression de notre reconnaissance et de notre profond respect.
A Monsieur le Docteur Jean-Yves JOUGLAR
Maître de Conférences de l’école Nationale Vétérinaire de Toulouse
Pathologie médicale du bétail et des Animaux de basse-cour
Qui nous a fait l’honneur de participer à notre jury de thèse.
Qu’il trouve ici l’expression de toute notre gratitude.

6

7
A la mémoire de Maurice BAUD’HUIN, mon regretté grand-père.
A mes grand-parents,
Modeste témoignage de mon affection.
A mes parents,
Qu’ils soient assurés de l’amour que je leur porte.
A Boris,
Le roi du dôme du tonnerre, des fantassins et des pénalties ; le plus exceptionnel des
gafet’ô plancton, le génialissime bricoleur ; etc…bref le meilleur frère du monde.
A Charlotte,
Chacun de ses sourires est un rayon de soleil.
A toute ma famille.
A mes chiens : Ota, Tété, Buthy, Elf, E.T, Héra, Hunt et Ramsès,
En souvenir des campagnes espagnoles.

8
A Vivi,
Pour les bons moments passés ensemble.
A tous mes amis.
A Mrs Henri Raymond, Christophe Munoz et Speedy Gonzales,
Pour leur contribution à l’élaboration de cette thèse, même si pour cela le Gonzo
maladroit a vidé ma cartouchière.
A Marmotte,
Pour son charisme, son éducation raffinée et surtout pour son aide précieuse et
spontanée.
A New-York,
Pour ses recherches sur Heterakis.
A tout ceux qui m’ont soutenu quotidiennement,
Merci à Mr Néléphant, Choupi, Lapin, Canard, Poppy, Salomon (x2), Bourriquet (x2),
Marmottine, Oie, Chloé, Salerssou, Nici coin coin et évidemment Saturnin.
A Pipoune,
Bonne chance.

9
TABLE DES MATIERES
INTRODUCTION..................................................................................................................17
PREMIERE PARTIE : PRESENTATION GENERALE..................................................19
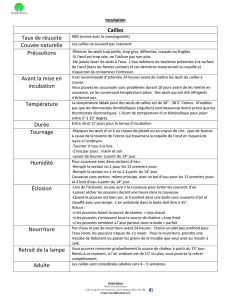
I) La caille .........................................................................................................................21
I.1 Classification...........................................................................................................21
I.2 Morphologie ...........................................................................................................21
a. Sexage...................................................................................................................21
b. Poids.....................................................................................................................22
I.3 Reproduction ...........................................................................................................22
I.4 Migration.................................................................................................................23
a. Migration prénuptiale ..........................................................................................23
b. Migration post nuptiale........................................................................................23
I.5 Mœurs alimentaires .................................................................................................25
a. Régime alimentaire ..............................................................................................25
b. Digestion ..............................................................................................................26
c. Proportion des différents aliments.......................................................................26
II) Les parasites..................................................................................................................27
II.1 Définitions...............................................................................................................27
II.2 Pouvoir pathogène...................................................................................................27
II.3 Infestation des oiseaux: l’exemple des cestodes......................................................28
a. Sources de parasites.............................................................................................28
b. Modalités de l’infestation.....................................................................................29
c. Réceptivité des oiseaux.........................................................................................29
III) Matériels et méthodes ..................................................................................................31
III.1 Prélèvement des oiseaux..........................................................................................31
III.2 Recherche des ectoparasites ....................................................................................32
a. Recherche visuelle directe....................................................................................32
b. Récolte grâce à un insecticide..............................................................................32
c. Recherche microscopique.....................................................................................32
III.3 Recherche des endoparasites ...................................................................................33
a. Helminthes présents dans le tractus digestif........................................................33
b. Syngames présents dans le tractus respiratoire...................................................34
c. Protozoaires présents dans le tractus digestif......................................................34
III.4 Traitement statistique des données..........................................................................35
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
1
/
118
100%