Empreinte génomique et pseudohypoparathyroïdie

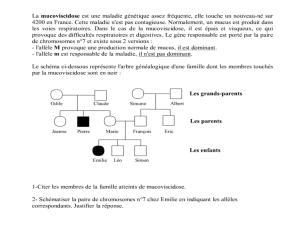
16
Métabolismes Hormones Diabètes et Nutrition (X), n° 1, janvier/février 2006
et maladie endocrinienne
Empreinte génomique parentale
Empreinte génomique et pseudohypoparathyroïdie
Genomic imprinting and pseudohypoparathyroidism
M.L. Kottler*, N. Richard, G.Abéguilé*
L
a pseudohypoparathyroïdie
est une maladie rare dont la
fréquence est largement sous-
estimée, car son diagnostic est diffi-
cile du fait de signes cliniques
pléiotropes.
Depuis 1990, date de l’identification
des lésions génétiques associées,
d’énormes progrès ont été faits dans
la compréhension de son mode de
transmission et de ses mécanismes
physiopathologiques, la génétique et
le développement de modèles ani-
maux ayant apporté les outils essen-
tiels à cette compréhension.
Ostéodystrophie
héréditaire d’Albright
et pseudohypoparathyroïdie
L’ostéodystrophie héréditaire d’Al-
bright (OHA) est un syndrome
transmis sur le mode autosomique
dominant, caractérisé dans sa
forme typique par une petite taille,
une obésité, un faciès lunaire, une
brachymétacarpie prédominant sur
le quatrième métacarpe, des ossifi-
cations sous-cutanées et un retard
mental de gravité variable. S’y
associent des signes cliniques
d’hypoparathyroïdie, celle-ci étant
le plus souvent révélée par une
hypocalcémie. En 1969, Chase,
Melson et Aurbach ont montré que
l’injection d’extrait de parathyroïde
ne corrigeait pas l’hypocalcémie,
n’élevait pas l’excrétion du phos-
phore et n’entraînait pas d’augmen-
tation de l’excrétion urinaire d’AMP
cyclique. La mise en place d’un
dosage efficace de la PTH a permis
de montrer que ces patients avaient
des taux très élevés de PTH, d’où le
terme de pseudohypoparathyroïdie
(PHP). Dès lors, les signes biolo-
giques suggéraient comme base
physiopathologique l’existence d’un
défaut du complexe hormone/récep-
teur/ adénylate-cyclase. Ce complexe
est formé de trois composants inti-
mement liés à la membrane : le
récepteur de l’hormone, un effec-
teur enzymatique, l’adénylate-
cyclase, qui produit un second
messager intracellulaire, l’AMPc,
et la protéine G, régulant la liaison
du GTP. La PTH se lie à un récep-
teur membranaire couplé aux pro-
téines G (figure 1). La protéine G
est un complexe hétérotrimérique
composé des trois sous-unités, α,
ß, γ, la sous-unité αjouant un rôle
clé dans la liaison au récepteur et
dans l’activation de l’effecteur.
Cependant, il a également été
observé que la résistance hormonale
n’était pas limitée à la PTH, car les
sujets atteints présentent aussi une
résistance à la TSH et, le plus sou-
vent, à un niveau infraclinique à
l’ACTH et à la calcitonine. L’exis-
tence d’une résistance à la GH, qui
pourrait être responsable de la
petite taille et de l’obésité, reste
encore controversée. Tout comme
la PTH, ces hormones agissent via
la protéine Gαs pour stimuler
l’adénylate-cyclase et produire de
* Laboratoire de génétique moléculaire, dépar-
tement génétique et reproduction, CHU de Caen.
▲
▲Le locus GNAS1 est un locus complexe soumis à une empreinte géno-
mique dont l’originalité est d’être “tissu-spécifique”, car limitée au TCP
pour ce qui concerne le gène GNAS1.
▲
▲Une mutation “perte de fonction” dans la partie codante de GNAS1
est associée à un phénotype PHP1a avec résistance multihormonale si
cette lésion est située sur l’allèle d’origine maternelle.
▲
▲Un défaut d'expression de GNAS1 est associé à un phénotype PHP1b.
Il serait dû à une absence de méthylation de l’exon 1A du fait d’une
lésion dans le centre d'empreinte situé dans le gène de la syntaxine 16,
200 kb en amont.
▲
▲L’hétéroplasie progressive osseuse est une nouvelle entité clinique
grave associée à une mutation située sur l’allèle d’origine paternelle.
Mots-clés : Ostéodystrophie héréditaire d’Albright (OHA) - Pseudo-
hypoparathyroïdie (PHP) - Pseudo-pseudohypoparathyroïdie (PPHP) -
Hétéroplasie progressive osseuse (POH).
Keywords: Guanine - Nucleotide-binding protein - Alpha Stimulating
(GNAS1).
points FORTS

Métabolismes Hormones Diabètes et Nutrition (X), n° 1, janvier/février 2006
17
Empreinte génomique parentale
et maladie endocrinienne
l’AMPc, comme second messager.
En 1980, Levine et al. ont mis au
point une technique de mesure de
l’activité Gs dans les érythrocytes et
ont montré que les patients avaient
un taux significativement plus bas
(d’environ 50 %) que celui des
patients normaux. En 1990, des
mutations “perte de fonction” ont
été identifiées à l’état hétérozygote
dans le gène GNAS1 qui code pour
la sous-unité alpha des protéines G.
Ces mutations réduisent de 50 % le
niveau de la protéine Gαs et son
activité intracellulaire, comme cela
est démontré dans les érythrocytes
des patients.
Cependant, l’haplo-insuffisance
n’explique pas à elle seule le phé-
notype. Gαs est une protéine ubi-
quitaire qui intervient dans l’action
cellulaire d’un certain nombre
d’hormones et de neurotransmet-
teurs. Or, c’est essentiellement la
signalisation de la PTH et de la
TSH qui est préférentiellement
affectée, la réponse à l’isoprénaline,
le glucagon, la vasopressine restant
intacte.
Pour expliquer ce phénomène, il faut
donc envisager un mécanisme qui
abolit spécifiquement l’action biolo-
gique de Gαs au niveau de certains
tissus cibles, en l’occurrence le rein.
Les différentes formes
de pseudohypoparathyroïdie
La PHP est définie par des signes
d’hypoparathyroïdie et par une
concentration plasmatique très éle-
vée de PTH. Elle s’intègre dans deux
tableaux cliniques particuliers en
fonction, d’une part, de l’existence
ou non du syndrome dysmorphique
OHA et, d’autre part, du niveau d’ac-
tivité de la protéine Gαs:
– la PHP1a, (OMIM 103580) asso-
cie OHA, baisse de l’activité Gαs et
signes de résistance multihormo-
nale, en particulier à la TSH ;
– la PHP1b (OMIM 603233) est
caractérisée par une unique résis-
tance rénale à la PTH, sans autre
manifestation clinique, et l’activité
Gαs est normale.
Comme nous allons le discuter, ces
deux formes, qui se transmettent sur
le mode autosomique dominant, sont
associées au même locus, mais met-
tent en jeu des mécanismes différents.
Aspects génétiques
de la PHP1a
Le gène GNAS1 est localisé sur le
chromosome 20 en position q13. Il
est formé de 13 exons.
Les études de ségrégation familiale
ont montré une transmission de type
autosomique dominant. Pendant
longtemps, la notion de pénétrance
incomplète ou de “saut de généra-
tion” a été évoquée pour expliquer
l’absence apparente d’expression
phénotypique de certains sujets por-
teurs obligatoires de la lésion géné-
tique. De plus, certains patients
présentent un syndrome ostéodys-
trophique caractéristique isolé avec
baisse de l’activité Gαs, mais sans
résistance hormonale. Le diagnostic
alors posé est celui de pseudo-
pseudohypoparathyroïdie (PPHP).
Les études génétiques ont montré
l’existence d’une ségrégation intra-
familiale de PHP1a et de PPHP. En
approfondissant ces études, on a pu
mettre en évidence une transmission
très particulière de ces anomalies :
les patients ayant une OHA et qui
héritent de leur mère la mutation du
gène GNAS développent une résis-
tance multihormonale, principale-
ment à la PTH et à la TSH (tableau
clinique de PHP1a), alors que les
patients qui héritent la mutation de
leur père développent uniquement
une PPHP. Cependant, dans de très
rares cas, certains patients qui ont
une mutation de Gαs sur l’allèle
paternel développent aussi une
forme d’ossification ectopique par-
ticulièrement sévère décrite sous le
nom d’hétéroplasie progressive
osseuse. La physiopathologie de ce
syndrome reste peu claire. Elle
serait liée à une expression inappro-
priée d’un facteur de transcription
spécifique des ostéoblastes Cbra1/
RUNX2. Ce phénotype ne sera pas
étudié dans cet article.
Ces observations permettent de
conclure que la présence d’un
allèle maternel normal prévient la
résistance hormonale, l’allèle
paternel ayant un rôle restreint,
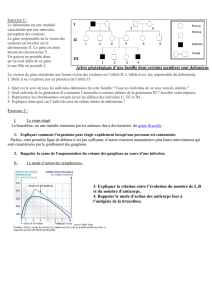
Ligand
GDP
GTP
Second messager*
* : AMPc
Effecteur
enzymatique
Milieu
extracellulaire
Récepteur
membranaire
Milieu
intracellulaire
+
Figure 1. Protéine G et transduction du signal d’un récepteur à sept domaines transmem-
branaires.
Les protéines G sont formées de trois sous-unités : ,,. Après liaison à son ligand, le récep-
teur active la sous-unité (Gs), qui fixe le GTP et active un effecteur enzymatique.
Gs : Guanine Nucleotide-binding protein Alpha Stimulating
Effecteur enzymatique: adénylate-cyclase.

Métabolismes Hormones Diabètes et Nutrition (X), n° 1, janvier/février 2006
18
et maladie endocrinienne
Empreinte génomique parentale
voire nul. Ce résultat est compa-
tible avec une empreinte géno-
mique du gène GNAS1. Cette
hypothèse est renforcée par le fait
que la région 20q13 est synthé-
nique de la partie distale du chro-
mosome 2 de la souris, région sou-
mise à empreinte. Les souris qui
ont une disomie d’origine pater-
nelle (pas d’allèle maternel) sont
de petite taille, présentent une obé-
sité et sont hyperactives, alors que
celles qui ont une disomie d’ori-
gine maternelle expriment un phé-
notype métabolique opposé. Elles
sont inactives, de faible poids et
ne tètent pas. Les souris porteuses
d’une lésion de l’exon 2 du gène
GNAS1, soit sur l’allèle maternel,
soit sur l’allèle paternel, ont un
phénotype semblable à celui des
souris présentant une disomie uni-
parentale, soit paternelle, soit
maternelle.
Ces observations conduisent à l’hy-
pothèse que seul l’allèle maternel
est exprimé (figure 2).
Le gène GNAS1
est soumis à une empreinte
tissu-spécifique
Dans l’hypothèse d’une empreinte
parentale, si un seul allèle, en l’oc-
currence l’allèle maternel, était
exprimé, on devrait, en cas de lésion
sur cet allèle, observer une résis-
tance beaucoup plus complète, mul-
tihormonale. D’autre part, on
retrouve toujours la persistance
d’une certaine activité Gs dans les
érythrocytes, ce qui témoigne de
l’expression de l’allèle paternel nor-
mal. Ces deux résultats sont contra-
dictoires. Pour expliquer la résis-
tance exclusive à la PTH (et à la
TSH), il faut donc que l’expression
de l’allèle paternel normal soit abo-
lie uniquement dans le rein (et la
thyroïde). L’empreinte parentale
n’est donc pas ubiquitaire mais
confinée à un nombre limité de cel-
lules et de tissus : en d’autres
termes, le gène est habituellement
transcrit à partir des deux allèles
dans la majorité des cellules, mais
dans certains tissus (en particulier,
au niveau rénal), il n’est transcrit
qu’à partir d’un seul allèle, en l’oc-
currence l’allèle maternel.
La démonstration d’une empreinte
parentale tissu-spécifique a été
apportée par l’utilisation de
modèles animaux. Chez la souris,
des études effectuées par RT-PCR
permettent de suivre la ségrégation
des allèles grâce à la présence
d’une simple variation de longueur
de la séquence du gène. Elles ont
montré que le gène GNAS était
exprimé de façon bi-allélique dans
la majorité des tissus (cerveau, foie,
poumon). Les chercheurs se sont
ensuite intéressés au tissu rénal,
cible principale des effets biolo-
giques de la PTH. En utilisant un
modèle de souris dont le gène
GNAS a été inactivé (souris KO
pour le gène GNAS), Yu et al.
(1998) ont montré, par d’élégantes
analyses immunohistochimiques,
que la protéine Gαs était exprimée
uniquement à partir de l’allèle
maternel dans les tubules contour-
nés proximaux (TCP) alors que,
dans la médullaire, l’expression
était bi-allélique (figure 3). En cas
de lésion de l’allèle maternel, la
protéine n’est plus synthétisée dans
le TCP. L’empreinte génomique est
donc tissu-spécifique. Des travaux
ultérieurs ont montré que Gαs était
aussi uniquement exprimée à partir
de l’allèle maternel dans la thyroïde
et dans l’hypophyse, ce qui
explique l’hypothyroïdie associée à
la PHP1a.
En résumé, lorsqu’une mutation
siège sur l’allèle maternel, il n’y a
pas d’activité Gs (avec ses consé-
quences de résistance hormonale),
et ce uniquement dans les tissus
(cellules) où le gène a une expres-
sion mono-allélique. Dans les autres
tissus, la persistance de 50 % de
l’activité Gs, qui a pour origine l’al-
lèle paternel, permet le maintien
d’un niveau d’AMP cyclique suffi-
sant pour induire des réponses phy-
siologiques.
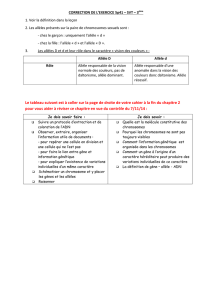
Figure 3. L’empreinte de GNAS1 est tissu-
spécifique.
Identification par immunohistochimie de
la protéine Gαs au niveau du rein (d’après
Yu et al., 1998).
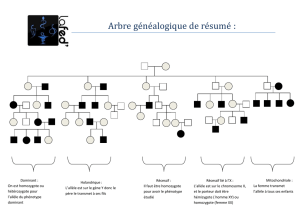
Bi-allélique
50 % + 50 %
Allèle
maternel
Allèle
paternel Allèle
maternel
Allèle
paternel Allèle
maternel
Allèle
paternel Allèle
maternel
Allèle
paternel
Mono-allélique
Ex. : expression
de l’allèle maternel
Mutation
de l’allèle maternel :
perte d’expression
X
Mutation
de l’allèle paternel :
expression conservée
X
Figure 2. Incidence sur l’expression phénotypique de mutations “perte de fonction” d’un
gène soumis à empreinte (expression mono-allélique).
+/+ +/- +/+ +/- +/+ -/+ +/+ -/+
CTX
IM
+/+: souris normale
+/-: mutation sur l’allèle d’origine paternelle
-/+: mutation sur l’allèle d’origine maternelle
CTX: cortex – IM: médullaire

Métabolismes Hormones Diabètes et Nutrition (X), n° 1, janvier/février 2006
19
Empreinte génomique parentale
et maladie endocrinienne
Le gène GNAS1 fait partie
d’un locus complexe
Le gène GNAS1 fait partie d’un
locus complexe (ou locus GNAS)
qui s’étend sur plus de 200 kb et
comprend plusieurs gènes générant
des produits multiples. Les ARN
messagers transcrits se caractéri-
sent par un exon 1 spécifique qui se
raccorde, par un mécanisme
d’épissage alternatif, aux exons
2-13 de GNAS1. Chaque exon 1
dépend d’un promoteur spécifique
situé en amont. Ainsi, on peut posi-
tionner trois gènes (figure 4). Le
gène le plus en amont génère un
transcrit pour une protéine chro-
mogranine-like ou NESP55 dont la
région codante est entièrement
contenue dans l’exon 1 spécifique,
la séquence correspondant aux
exons 2 à 13 communs avec la Gαs
n’étant pas traduite. Le deuxième
gène génère un transcrit codant
pour une isoforme de la protéine
Gαs, appelée extralarge (XLαs),
car elle se différencie de la protéine
Gαs par une extrémité N-terminale
plus grande. XLαs a une distribu-
tion tissulaire limitée au niveau de
l’hypophyse, du cerveau, de l’axe
surrénal, du cœur et des îlots pan-
créatiques. Bien que les fonctions
biologiques du produit de ces deux
gènes n’aient pas été clairement
établies, il semble que la déficience
en NESP55 et XLαs ait peu d’effet
chez l’homme, alors que la défi-
cience en XLαs induit un phéno-
type sévère chez la souris. De plus,
les mutations situées sur l’exon 1
de GNAS1, qui maintiennent donc
la fonctionnalité de XLαs, indui-
sent un phénotype similaire à celui
observé lorsque existent des muta-
tions sur les autres exons. Le pro-
moteur de GNAS1 et son exon 1
spécifique se situent 35 kb en aval
du promoteur de XLαs. Compli-
quant encore le locus, on a iden-
tifié deux autres transcrits qui ne
sont pas traduits : entre NESP55 et
XLαs, un transcrit antisens appelé
nespa chez la souris ; entre le
transcrit XLαs et Gαs (2,5 kb en
amont de Gαs), un transcrit appelé
exon 1A (ou A/B selon les
auteurs).
Empreinte parentale
au locus GNAS
L’expression des gènes décrits au
locus GNAS n’est pas bi-allélique.
La région de leurs promoteurs pré-
sente une méthylation sélective d’un
seul allèle (région méthylée différen-
tiellement, ou DMR) au niveau
d’îlots CpG, mécanisme rendant
actuellement compte de l’empreinte
parentale. Cette empreinte est établie
durant la gamétogenèse et maintenue
au cours du développement.
NESP55 est uniquement exprimé
sur l’allèle maternel ; son promoteur
est méthylé sur l’allèle paternel. En
revanche, XLαs est uniquement
exprimé à partir de l’allèle paternel,
et son promoteur est méthylé sur
l’allèle maternel. Les transcrits
exon 1A et nespa sont exprimés à
partir de l’allèle paternel (figure 3),
leurs promoteurs étant méthylés sur
l’allèle maternel. De façon intéres-
sante, les deux allèles du promoteur
de Gαs ne sont pas méthylés, mais
seul l’allèle maternel est cependant
exprimé au niveau du TCP.
PHP1b:
un défaut d’empreinte
au locus GNAS
Les patients présentant une PHP1b
ont une résistance rénale à la PTH
semblable à celle décrite dans les
PHP1a, mais n’ont pas le phénotype
OHA. L’expression de GNAS1 est
normale dans les érythrocytes, éli-
minant la possibilité d’une mutation
perte de fonction de GNAS1. La
transmission de l’affection est auto-
somique dominante. Les études
génétiques ont permis de rattacher
au locus GNAS l’origine du déficit.
Il existe une anomalie de méthyla-
tion qui touche essentiellement
l’exon 1A. Comme nous l’avons vu,
l’allèle maternel exon 1A est habi-
tuellement méthylé, et seul l’allèle
d’origine paternelle est exprimé.
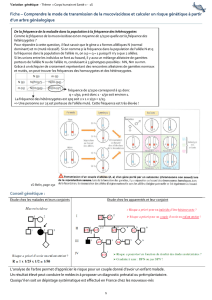
NESP55 XLs1A1213
1 2-3 . . . . . . . 13
Gs
Exon 1A
XLs
NESP55
nespa GNAS1
Figure 4. Organisation des gènes au locus GNAS1.
A:Il existe quatre transcrits différant par leur exon 1 spécifique, qui se raccorde par un phé-
nomène d’épissage à l’exon 2 du gène GNAS1 (B).
L’expression de ces transcrits est mono-allélique.
NESP55 est transcrit à partir de l’allèle d’origine maternelle, tout comme GNAS1. XLset
les transcrits nespa et exon 1A sont transcrits à partir de l’allèle paternel.
A
B

Métabolismes Hormones Diabètes et Nutrition (X), n° 1, janvier/février 2006
20
et maladie endocrinienne
Empreinte génomique parentale
Chez les patients PHP1b, il existe
une association entre la perte
de méthylation de l’allèle mater-
nel, l’expression bi-allélique de
l’exon 1A et la perte d’expression
de GNAS1. Ces observations suggè-
rent la mise en jeu d’un mécanisme
d’inhibition. Ce mécanisme est
confirmé chez la souris, puisque la
délétion de l’exon 1A située sur l’al-
lèle paternel entraîne une surexpres-
sion de la protéine Gαs dans TCP,
alors qu’il n’y a pas d’effet si la
délétion concerne l’allèle maternel.
Deux questions se posent alors :
pourquoi la région de l’exon 1A
situé sur l’allèle maternel n’est-elle
plus méthylée ? Comment l’exon 1A
régule-t-il l’expression de GNAS1 ?
Il existe un centre d’empreinte
situé dans le gène
de la syntaxine 16
Des microdélétions (2,5 à 3 kb)
dans le gène de la syntaxine 16
(STX16), située 220 kb en amont du
gène GNAS1, ont été identifiées
chez les patients PHP1b. Ces délé-
tions sont uniquement situées sur
l’allèle maternel. Elles sont sans
conséquence lorsque la lésion siège
sur l’allèle paternel. Ainsi, cette
région doit contenir un élément
nécessaire pour établir ou maintenir
la méthylation. C’est un centre
d’empreinte qui fonctionne en cis,
puisque sa délétion altère la méthy-
lation de la région de l’exon 1A,
située sur le même chromosome.
Un tel mécanisme a déjà été décrit
pour d’autres pathologies liées à
l’empreinte telles que les syn-
dromes de Prader-Willi/Angelman
et Beckwith-Wiedemann.
Mécanisme d’action
L’hypothèse proposée par Weinstein
(2005) fait intervenir deux éléments
de régulation : une séquence cis
(localisée sur l’ADN) et un facteur
trans, qui se lierait sur cette
séquence en fonction de son état de
méthylation. Du fait de l’action
inhibitrice globale, il est appelé
répresseur.
Le mécanisme proposé est le sui-
vant : rappelons que l’exon 1A est
méthylé sur l’allèle d’origine mater-
nelle. Le facteur trans ne pourrait se
lier que sur une séquence cis non
méthylée, donc sur l’allèle paternel.
Cette interaction aboutirait, selon un
mécanisme encore inconnu, à l’in-
hibition de l’expression de GNAS1
d’origine paternelle. Ce facteur ne
pourrait pas se lier à l’allèle mater-
nel méthylé, et l’allèle GNAS1
d’origine maternelle serait exprimé.
Ce facteur, qui ne serait synthétisé
que par le tube contourné proximal
rénal, reste cependant à identifier.
Dans les autres tissus, le répresseur
n’est pas exprimé. Il n’y a pas
d’inhibition, et les deux allèles
GNAS1 sont exprimés. Chez les
patients présentant une PHP1b,
l’exon 1A maternel n’est pas
méthylé. Le répresseur peut donc se
lier à la fois sur l’allèle paternel et
sur l’allèle maternel, ce qui entraîne
une inhibition de l’expression des
deux allèles de GNAS1, une défi-
cience en Gαs et une résistance à
la PTH. Le répresseur n’étant pas
synthétisé dans les autres tissus, ce
défaut de méthylation n’a pas d’effet
sur l’expression de Gαs dans les
autres tissus.
Références
■
Bastepe M et al. Positional dissociation between
the genetic mutation responsible for pseudohypo-
parathyroidism type Ib and the associated methy-
lation defect at exon A/B: evidence for a long-range
regulatory element within the imprinted GNAS1
locus. Hum Mol Genet 2001;10(12): 1231-41.
■
Genevieve D et al. Paternal deletion of the
GNAS imprinted locus (including Gnasxl) in two
girls presenting with severe pre- and post-natal
growth retardation and intractable feeding diffi-
culties. Eur J Hum Genet 2005;13(9):1033-9.
■
Hayward BE et al. The human GNAS1 gene is
imprinted and encodes distinct paternally and
biallelically expressed G proteins. Proc Natl Acad
Sci USA 1998;95(17):10038-43.
■
Juppner H et al. The gene responsible for pseudo-
hypoparathyroidism type Ib is paternally imprinted
and maps in four unrelated kindreds to chromo-
some 20q13.3. Proc Natl Acad Sci USA 1998;95
(20):11798-803.
■
Liu J et al. Identification of the control region
for tissue-specific imprinting of the stimulatory G
protein alpha-subunit. Proc Natl Acad Sci USA
2005;102(15):5513-8.
■
Linglart A et al. GNAS1 lesions in pseudohypo-
parathyroidism Ia and Ic: genotype phenotype
relationship and evidence of the maternal trans-
mission of the hormonal resistance. J Clin Endo-
crinol Metab 2002;87(1):189-97.
■
Shore EM et al. Paternally inherited inactiva-
ting mutations of the GNAS1 gene in progressive
osseous heteroplasia. N Engl J Med 2002;346(2):
99-106.
■
Weinstein LS et al. Endocrine manifestations of
stimulatory G protein alpha-subunit mutations
and the role of genomic imprinting. Endocr Rev
2001;22(5):675-705.
■
Yu S et al. Variable and tissue-specific hormone
resistance in heterotrimeric Gs protein alpha-
subunit (Gsalpha) knockout mice is due to tissue-
specific imprinting of the Gsalpha gene. Proc Natl
Acad Sci USA 1998;95(15):8715-20.
1
/
5
100%