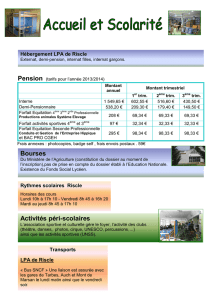
MO 1 Rôle du solvant en chimie organique solvolyse du chlorure de

MO 1 Rôle du solvant en chimie organique
solvolyse du chlorure de tertiobutyle Bl p.167, Florilège p.71 1h30 *
dosage de la fraction énolisée d'un composé β-dicarbonylé JD 11 1h30
compétition c/o-alkylation JD 63 3h30
élimination diastéréosélective JCE 1991 p.515 3h
MO 2 Réactions régiosélectives; réactions stéréosélectives
déshydratation du 2-méthylcyclohexanol Bl p.193 2h30
réaction de Diels-Alder Fieser p.184 2h30
réduction du benzyle Bl p.303 1h30 *
nitration du résorcinol Bl p.137 3h
MO 3 Dérivés carbonylés
transposition pinacolique Bl p.200 2h30
réduction du benzyle Bl p.303 1h30 *
réaction de Wittig-Horner Dupont-Durst p.480 1h30
réaction de Knoevenagel JD 83 2h30
MO 4 Halogénation en chimie organique
réaction de Sandmeyer JD 77 3h30
iodation par SN Bl p.163 1h30 *
bromation de la 4-méthoxyacétophénone JD 70 1h30
bromation du stylbène JD 26 1h30
MO 5 Synthèse organique à l'aide de carbanions
addition 1,4 sur la cyclohexènone JD 33 3h
synthèse malonique Bl p.173 3h
réaction de Wittig-Horner Dupont-Durst p.480 1h30 *
polymérisation anionique Bl p.107 2h30
MO 6 Oxydation en chimie organique
oxydation de l'octanol JD 42 2h
époxydation de la carvone JD 20 2h30
bromation de la 4-méthoxyacétophénone JD 70 1h30 *
transposition de Bayer-Villiger Feneuil p.116 3h30
MO 7 Réduction en chimie organique
réduction du nitrobenzène Vogel p.892
synthèse du triphénylcarbinol Bl p.248 1h30
réduction du benzyle Bl p.303 1h30 *
hydrogénation catalytique JD 19 2h30
MO 8 Extraction et synthèses de molécules odorantes
extraction de l'eugénol Chavanne p.227, BUP 695 p.790 3h
élimination diastéréosélective JCE 1991 p.515 3h
oxydation de l'octanol JD 42 2h
synthèse de l'isovalérate de 2-phényléthyl JD 61 1h30 *
MO 9 Réactions photochimiques
photopinacolisation de la benzophénone Bl p.308 2h
cycloaddition de l'anhydride maléique sur le benzène Bl p.113, JCE 1970 p.589 3h30
effet Karasch Bl p.101 2h
isomérisation du E-azobenzène Bl p.357 1h *
MO 10 Réactions radicalaires en chimie organique
oxydation de l'octanol JD 42 2h *

couplage du naphtol JD 80 3h
polymérisation radicalaire Bl p.104 2h30
addition sur le β-pinène JCE 1976 p.60 2h
MO 11 Réactions de transposition en chimie organique
transposition de Hoffman CPDej p.58 2h
transposition pinacolique Bl p.200 2h30
transposition de Claisen JD 45 2h30
transposition catalysée par Ru(III) Bl p.204 1h30 *
MO 12 Réaction acido-catalysées en chimie organique
mutarotation du glucose BA p.163 2h30
acylation de Friedel & Craft JD 51/84 3h
réaction de Diels-Alder JD 35 3h
acétalysation JD 58 1h30 *
MO 13 Réaction d'élimination en chimie organique
élimination diastéréosélective JCE 1991 p.515 3h
déshydratation du 2-méthylcyclohexanol Bl p.193 2h30
synthèse de la tétraphénylcyclopentadiènone Bl p.288 1h30 *
réaction de Wittig-Horner Dupont-Durst p.480 1h30
MO 14 Réactions de substitution nucléophile
synthèse de Williamson Bl p.169 1h30 *
solvolyse du chlorure de tertiobutyle Bl p.167, Florilège p.71 2h
synthèse de la 2,4 DNPH Vogel p.960 3h
synthèse d'un époxyde à partir d'une bromhydrine JCE 1995 p.1037 2h30
MO 15 Réactions de substitution électrophile
nitration du résorcinol Bl p.137 2h
synthèse de la tétraphénylporphyrine Fuxa p.182 1h30
déprotection sélective d'un éther silylé JD 47 1h30
dosage de la fraction énolisée d'un composé β-dicarbonylé JD 11 1h30 *
MO 16 Alcols et phénols
réduction du benzyle Bl p.303 1h30 *
déshydratation du 2-méthylcyclohexanol Bl p.193 2h30
synthèse de Williamson Bl p.169 1h30
synthèse du binaphtol JD 80 3h
préparation de la bakélite Clemente-Durupthy p.86 1h
MO 17 Réactions d'addition sur les hydrocarbures
synthèse d'un époxyde à partir d'une bromhydrine JCE 1995 p.1037 2h30
effet Karasch Bl p.101 2h *
réaction de Diels-Alder Fieser p.184 2h30
hydrogénation catalytique JD 19 2h30
MO 18 Catalyse en chimie organique
synthèse de la tétraphénylcyclopentadiènone Bl p.288 1h30 *
hydrogénation catalytique JD 19 2h30
couplage de Heck Fuxa p.107 3h
oxydation de l'alcool benzylique Bl p.210 2h
MO 19 Synthèse et réactions des dérivés des acides carboxyliques
synthèse du formiate de citronnelyle JD 56 3h
réaction de Ritter JCE 1989 p.776, BUP 717 1h30 *

réaction de Knoevenagel JD 83 2h30
acylation de Friedel & Craft JD 51/84 3h
MO 20 Protection de fonction en chimie organique
synthèse de l'hydroxycitronnelal JD 23 2h
protection par le BOC JD 68 2h
nitration du résorcinol Bl p.137 2h
déprotection sélective JD 47 1h30 *
MO 21 Aldolisation, cétolisation, crotonisation et réactions apparentées
aldolisation - crotonisation
cétolisation de la propanone Bl p.282 3h *
réaction de Knoevenagel JD 83 3h
réaction de Darzens JD 87 3h
MO 22 Esters
synthèse du formiate de citronnelyle JD 56 3h
réaction de Knoevenagel JD 83 3h
préparation de l'oxamide Bl p.318 1h *
synthèse malonique Bl p.173 3h
MO 23 Amino-acides ; peptides
hydrolyse de la caséine CPDej p.65 1h
électrophorèse BUP 644 p.1046 3h
synthèse d'un dipeptide JCE 1982 p.701, JD 55 1h/1h30/2h
MO 24 Réactions de formation de liaisons simples C-O
synthèse de Williamson Bl p.169 2h30
époxydation de la carvone JD 20 2h30
solvolyse du chlorure de tertiobutyle Bl p.167, Florilège p.71 2h30
réduction du benzyle Bl p.303 1h30 *
MO 25 Hydrocarbures éthyléniques et acétyléniques
déshydratation du 2-méthylcyclohexanol Bl p.193 2h30
réaction de Wittig-Horner Dupont-Durst p.480 1h30 *
hydrogénation catalytique JD 19 2h30
réactivité comparée JD 27 1h
acidité des alcynes vrais JD 71 3h30
MO 26 Organométalliques
synthèse du ferrocène Bl p.236 3h
synthèse de PhMgBr JD 29 2h30
synthèse du triphénylcarbinol Bl p.248 1h30 *
addition 1,4 sur une énone JD 33 3h
MO 27 Dérivés halogénés
solvolyse du chlorure de tertiobutyle Bl p.167, Florilège p.71 2h30
élimination diastéréosélective JCE 1991 p.515 3h
synthèse de PhMgBr JD 29 2h30
nucléophile de I-Bl p.165 1h30 *
MO 28 Diènes
synthèse d'un allène Vogel p.507 3h
synthèse de la tétraphénylcyclopentadiènone Bl p.288 1h30 *
réaction de Diels-Alder Fieser p.184 2h30
transposition de Claisen JD 45 3h

MO 29 Composés aromatiques
synthèse du ferrocène Bl p.236 3h
synthèse de la 2,4 DNPH Vogel p.960 3h
nitration du résorcinol Bl p.137 3h30
oxydation de l'hydroquinone Bl p.214 2h *
MO 30 Dosages de composés organiques
dosage de la fraction énolisée d'un composé β-dicarbonylé JD 11 2h
dosage du methyllithium JD 8 1h30 *
mutarotation du glucose BA p.163, Bl p.259 3h
dosage par spectroscopie UV CPDej p.257 2h30
MO 31 Chromatographies
séparation des pigments d'épinard Florilège p.159 2h *
nitration du toluène Bl p.135, Vernin p.125 3h
séparation d'acides aminés contenus dans le Sargenor BUP 668 p.269 3h
MO 32 Etude des composés organiques naturels
extraction du limonène C.couleurs et odeurs p.207 2h
séparation des pigments d'épinard Florilège p.159 2h
hydrolyse de la caséine CPDej p.65 1h
électrophorèse BUP 644 p.1046 3h
détermination de l'équivalent de saponifaication d'une huile DeFranceschi p.49 1h30 *
MO 33 Réactions de formation de cycles en chimie organique
époxydation de la carvone JD 20 2h30
synthèse de la tétraphénylcyclopentadiènone Bl p.288 1h30 *
réaction de Diels-Alder Fieser p.184 3h
synthèse de la tétraphénylporphyrine Fuxa p.182 2h30
MO 34 Analyse de mélanges, séparation, purification en chimie organique
réaction de Wittig BUP juin 1999 2h
extraction de l'eugénol Chavanne p.227 1h30
séparation des pigments d'épinard Florilège p.159 2h
cétolisation de la propanone Bl p.282 3h *
MO 35 Réactions de formation de liaisons simples C-C
acylation de Friedel & Craft JD 51/84 3h
réaction de Heck Fuxa p.107 3h *
réaction de Diels-Alder Fieser p.184 2h30
polymérisation radicalaire Bl p.104 2h30
MO 36 Réactions de formation de liaisons doubles C=C
réaction de Wittig-Horner Dupont-Durst p.480 1h30
déshydratation du 2-méthylcyclohexanol Bl p.193 2h30
hydrogénation catalytique JD 19 2h30
synthèse de la tétraphénylcyclopentadiènone Bl p.288 1h30 *
MO 37 Utilisation des méthodes spectroscopiques en chimie organique
dosage par spectroscopie UV CPDej p.257 2h30 *
action du diiode sur la propanone BUP 762 p.447 2h
réaction de Diels-Alder Fieser p.184 2h30
étude de l'équilibre céto-énolique Bl p.278 2h30
MO 38 Réaction de formation de liaisons doubles C=O

oxydation de l'octanol JD 42 2h
transposition pinacolique Bl p.200 2h30
réaction de Ritter JCE 1989 p.776, BUP 717 1h30 *
procédé Wacker Bl p.116 2h30
MO 39 Réactions de formation de liaisons simples C-N et liaisons doubles C=N
nitration du toluène Bl p.135, Vernin p.125 1h30
réaction de Ritter JCE 1989 p.776, BUP 717 1h30 *
formation de l'oxime Bl p.365 1h30
synthèse de la 2,4 DNPH Vogel p.960 3h
MO 40 Synthèses de molécules utilisées en pharmacologie
précurseur d'anticancéreux JCE 1996 p.1036 3h
synthèse de l'aspirine JFLM orga 2h *
synthèse de la lidocaïne JCE 1999 p.1557 3h
synthèse de la benzocaïne Chimie tout p.65 3h
1
/
5
100%