malformations crânio- encéphaliques et syndrome de kallmann

MALFORMATIONS CRÂNIO-
ENCÉPHALIQUES
ET
SYNDROME DE KALLMANN-MORSIER
MALFORMATIONS CRÂNIO
MALFORMATIONS CRÂNIO-
-
ENC
ENCÉ
ÉPHALIQUES
PHALIQUES
ET
ET
SYNDROME DE KALLMANN
SYNDROME DE KALLMANN-
-MORSIER
MORSIER
F Pey, A Sevely, M Irsutti-Fjortoft, P Moulin*, C Pienkowski*, C Manelfe
Service de Neuroradiologie HÔPITAL PURPAN TOULOUSE
* Service d’Endocrinologie Pédiatrique HÔPITAL DES ENFANTS TOULOUSE

Le syndrome de Kallmann-Morsier ou dysplasie olfacto-génitale,
est défini cliniquement par un impubérisme et une absence plus ou
moins complète de l’odorat.
L’absence de puberté spontanée résulte d’un
hypogonadisme hypogonadotrophique, par déficit en
gonadolibérine (GnRH), sans atteinte des autres lignées
hypothalamo-hypophysaires.
L’hyposmie ou l’anosmie est secondaire à une hypoplasie
ou une aplasie des bulbes ou des tractus olfactifs.
Bien qu’apparemment très différents, ces symptômes sont pourtant liés
par les rapports topographiques étroits qu’entretiennent, au cours du
développement embryonnaire, les neurones synthétisant la GnRH et le
système olfactif.

RAPPELS EMBRYOLOGIQUES
RAPPELS EMBRYOLOGIQUES
Les neurones à GnRH prennent leur origine au niveau de la placode
olfactive médiane et vont migrer, dès la sixième semaine de vie
embryonnaire, vers le noyau infundibulaire hypothalamique (noyau
arqué), lieu de la neuro-sécrétion transmise à l’antéhypophyse. Cette
migration est guidée par la présence des fibres olfactives du nervus
terminalis qui relie l’épithélium olfactif à la région hypothalamique.
A la même période, les bulbes olfactifs se développent suite au
contact entre les axones de l’épithélium olfactif et le télencéphale rostral.
Il s’ensuit une prolifération et une différenciation des cellules neuro-
épithéliales qui entraînent l’évagination des bulbes primitifs.
Ces étapes complexes de la morphogenèse sont défectueuses dans le
syndrome de Kallmann-Morsier. De nombreux facteurs, notamment
génétiques, sont donc susceptibles d’être à l’origine de ces troubles de la
migration neuronale.

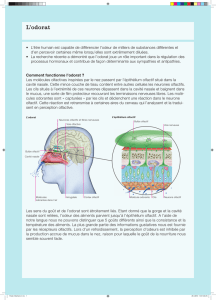
Face inférieure du cerveau
1. Bulbe olfactif ; 2. Tractus olfactif ; 3. Gyrus orbitaire ; 4. Gyrus rectus ; 5. Sillon
olfactif ; 6. Chiasma optique ; 7. Tige pituitaire ; 8. Corps mamillaire ; 9. Pôle
temporal

La plupart des cas sont diagnostiqués à l’adolescence devant
l’absence de puberté spontanée à laquelle s’associe le déficit olfactif. Ce
dernier est à rechercher par l’interrogatoire et les tests de perception
des odeurs car il n’est que très rarement mentionné spontanément.
Plus rarement, chez le garçon, le diagnostic est évoqué devant
l’existence d’une cryptorchidie voire d’un micropénis.
Un diagnostic rapide est alors essentiel car le traitement hormonal
substitutif, débuté dès que possible, permettra la correction de
l’ostéopénie induite par l’insuffisance hormonale et permettra une
reprise rapide de la croissance et l’apparition des caractères sexuels.
Associée, aux dosages hormonaux, l’imagerie par résonance
magnétique (IRM) occupe une place de choix dans la hiérarchie des
examens. Outre l’étude des voies olfactives et de l’hypophyse, elle
permet d’éliminer tout processus expansif de l’étage moyen et de
dépister toute malformation crânio-encéphalique associée.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
1
/
29
100%