cancers de la vulve - OncoBasseNormandie

CANCERS DE LA VULVE
PRISE EN CHARGE DIAGNOSTIQUE et THERAPEUTIQUE
Version 4.1 – 24 février 2011
- Ce référentiel a été réalisé en 2005 et révisé en 2008, sur la demande du conseil scientifique du
Réseau Régional de Cancérologie de Basse-Normandie "ANCELOT".
- Il a été rédigé par
- l'Unité d’Oncologie Gynécologique du Centre François Baclesse,
- le Service de Dermatologie du CHU de CAEN
- La Mise à jour 2011 a été corrigée et validée en réunion plénière du Réseau Régional de
Cancérologie de Basse-Normandie le 24 février 2011.
Rédacteurs (2008-2011)
Contributeurs (participants plénière) - suite
Dr Nejla ALLOUACHE, radiothérapeute
Dr BRACHET Pierre-Emmanuel, Caen
Dr Cécile BLANC-FOURNIER, pathologiste
Dr CONSTANT Jacques, Gynécologue, Caen
Dr Hubert CROUET, gynécologue, coordonnateur
Dr CROUET Hubert, Gynécologue, Caen
Dr Anne DOMPMARTIN-BLANCHERE, dermatologue
Dr DEON Gregory, Gynécologue, Alençon
Pr Jean-François HERON, oncologue médical
Dr DOMPMARTIN-BLANCHERE Anne, Caen
Pr Florence JOLY, oncologue médical
Dr GUARNIERI Séverine, Radiothérapeute, Caen
Dr Joëlle LACROIX, radiologue
Dr JEANNE-PASQUIER Corinne, Pathologiste, Caen
Dr Delphine LEROUGE, radiothérapeute
Dr KALUZINSKI Laure, Oncologue, Cherbourg
Dr François LESAUNIER, radiothérapeute
Dr LEBLANC François, Gynécologue, Bayeux
Dr Sandrine MARTIN-FRANCOISE, gynécologue
Dr LESAUNIER François, Radiothérapeute, Caen
Dr Laura MOÏSE, Oncologue médicale
Dr LHEUREUX Stéphanie, Oncologue, Caen
Dr Sixtine de RAUCOURT, dermatologue
Dr LUCAS Vincent, Gynécologue, Lisieux
Dr Emmanuel SEVIN, oncologue médical
Dr MARIE Gilles, Gynécologue, Cherbourg
Dr Marlon SILVA, radiothérapeute
Dr MARON Dominique, Radiothérapeute, Avranches
Dr Henri SOUFARAPIS, anesthésiste-réanimateur
Dr MARTIN-FRANCOISE Sandrine, Gynécologue, Caen
Sociétés savantes relectrices (2008)
Dr MICHELS Jean-Jacques, Pathologiste, Caen
Collège de gynécologie de Normandie
Dr MOISE Laure, Oncologue, Caen
Dr NGUYEN Nghia, Gynécologue, Caen
Association de FMC de Dermatologie
Vénérologie de Basse-Normandie
Dr PITON Serge, Gynécologue, Alençon
Collège de gynécologie-obstétrique de Basse-Normandie
Dr PURNICHESCU Vlad, Gynécologue, Cherbourg
Revue externe (2008)
Dr Sixtine de RAUCOURT, dermatologue, Caen
Professeur Jean-Charles Boulanger – Amiens -
Dr SELLAM Raphaël, Gynécologue, Caen
Contributeurs (participants à la plénière 2011)
Dr SEVIN Emmanuel, Oncologue, Caen
Dr AIDE Nicolas, Med. Nucléaire,Caen
Dr SILVA Marlon, Radiothérapeute, Caen
Dr ALLOUACHE Nejla, Radiothérapeute, Caen
Dr TURCK Mélusins, Gynécologue, Caen
Dr ANDRE Michel, Gynécologue, Flers
Dr VERNET Dominique, Gynécologue, Caen
Dr BARJOT Philippe, Gynécologue, Caen
Pr JOLY Florence, Oncologue, CFB
Dr BAZILLE Céline, Pathologiste, Caen
Dr BOURRET Antoine, Gynécologue, Caen

RRC_GYN_Vulve MAJ février 2011 1
1
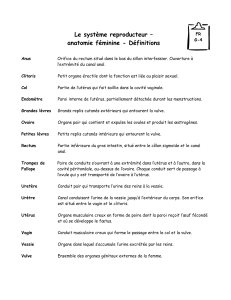
Cancers de la vulve, intraépithéliaux et invasifs
SOMMAIRE
RÉSUME, RECOMMANDATIONS, ARBRES DE DÉCISION 2-5
- 1 – DOMAINE 6
- 2 – CLASSIFICATIONS 6
- 2.1 – Classification clinique 6
- 2.2 – Classification histologique 7
- 2.3 – Compte-rendu histologique standard 7-8
- 3 – PARTICULARITES CLINIQUES 8
- 3.1 – Facteurs de risque 8
- 3.2 – Lésions intraépithéliales squameuses : nosologie 8
- 3.3 – Lésions intraépithéliales squameuses : particularités cliniques 9
- 3.4 – Lésions invasives squameuses : particularités cliniques 9
- 4 – MODALITES DU DIAGNOSTIC 10
- 4.1 – Lésions intraépithéliales squameuses : Bilan initial 10
- 4.2 – Lésions invasives squameuses : Bilan initial 11
- 5 – TRAITEMENT DES LESIONS VULVAIRES EPIDERMOÏDES 11
- 5.1 – Traitement des néoplasies intraépithéliales vulvaires (VIN) 11
- 5.2 – Traitement des lésions micro-invasives 12
- 5.3 – Traitement des lésions invasives localisées de stade IB 12
- 5.4 – Exploration inguinale 13
- 5.5 – Traitement des lésions invasives étendues Stade I multifocaux-Stade II 14
- 5.6 – Traitement des localisations ganglionnaires : Stades III ganglionnaires 14
- 5.7 – Traitement des lésions invasives localement évoluées Stades III et IV A 15
- 5.8 – Traitement des formes métastatiques stade IV B 16
- 6 – SURVEILLANCE DES LESIONS TRAITÉES 16
- 6.1 – Surveillance après traitement 16
- 6.2 – Prise en charge des récidives invasives 17
- 7 – FORMES HISTOLOGIQUES RARES 17
- 7.1 – Carcinome verruqueux 17
- 7.2 – Maladie de Paget vulvaire 17
- 7.3 – Adénocarcinome des glandes annexes de la vulve 18
- 7.4 – Carcinome baso-cellulaire 18
- 7.5 – Mélanome 18
- 7.6 – Sarcomes 19
- 7.7 – Tumeur du sinus endodermique 19
- 7.8 – Métastases à la vulve de tumeur d'autre origine 19
- 8 – RECHERCHE 19
- 9 – INFORMATION DES PATIENTES 19
- ANNEXE 1 : Classifications cliniques des cancers de la vulve 20
- ANNEXE 2 : Classification histologique des pathologies vulvaires 22
- ANNEXE 3 : Modalités thérapeutiques 23
- Chirurgie 23
- Radiothérapie et Chimio-radiothérapie 24
- ANNEXE 4 : Recherche 26
- ANNEXE 5 : Références, Bibliographie 27

RRC_GYN_Vulve MAJ février 2011 2
2
CANCERS DE LA VULVE :
RÉSUMÉ, RECOMMANDATIONS, ARBRES DE DECISION
Standard : Concertation pluridisciplinaire
Compte tenu de la rareté de ces situations, tous les cas de lésion maligne vulvaire,
intraépithéliale ou invasive, devront être soumis à une Réunion de Concertation
Pluridisciplinaire, sous couvert du respect de l'information et des droits des patients.
Recommandations : Traitement des lésions intraépithéliales
- Il n'y a pas de standard dans le traitement des lésions intraépithéliales
- Tout geste thérapeutique doit privilégier un résultat fonctionnel et esthétique favorable.
- Les méthodes d'excision doivent être préférées pour permettre un examen histologique à la
recherche d'une invasion occulte.
- En cas de lésion étendue ou plurifocale, une approche pluridisciplinaire sera privilégiée afin
d'éviter des séquelles importantes. Par exemple, excision chirurgicale de l'épicentre des
lésions, sans chercher des limites saines, complétée par une vaporisation laser des lésions
résiduelles, éventuellement en plusieurs séances.
- L'imiquimod peut être utilisé sur les condylomes associés. Il n'a pas l'AMM sur les VIN.
- Dans tous les cas, quels que soient la méthode choisie et l'état des limites d'exérèse, la
patiente doit être prévenue du caractère récidivant et multifocal des lésions et de la nécessité
d'une surveillance stricte et prolongée.
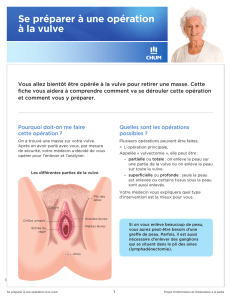
Diagnostic
Standard : Quel que soit le stade évolutif des lésions, le diagnostic des anomalies vulvaires
repose sur l'examen histologique. Aucune procédure thérapeutique ne peut être entreprise
avant la réalisation d'une biopsie de toutes les zones pathologiques.

RRC_GYN_Vulve MAJ février 2011 3
3
Exploration inguinale des lésions invasives (≥ Stade I B)
Standard :
- Le contrôle chirurgical des aires ganglionnaires inguinales doit être réalisé dans tous les
cancers invasifs de la vulve dès les Stades I B.
- La recherche de ganglion sentinelle inguinal par méthode combinée isotopique et colorant a
démontré sa fiabilité dans les stades IB, elle permet de réduire la morbidité du curage.
- Dans les stades II ou supérieurs, la lymphadénectomie inguino-fémorale superficielle et
profonde, par des incisions séparées, isolées de la zone d'exérèse vulvaire, reste le standard
malgré une morbidité importante.
Option :
- Dans les stades II ou supérieurs, la technique de recherche de ganglion sentinelle inguinal
peut être discutée en RCP en fonction des souhaits et des caractéristiques de la patiente (âge,
état des membres inférieurs, état général) et des données cliniques (ganglion palpable).

RRC_GYN_Vulve MAJ février 2011 4
4
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
1
/
29
100%