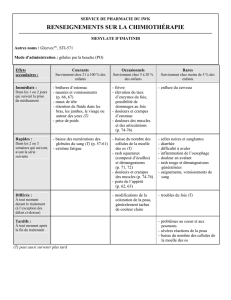
Place du dosage plasmatique de l`imatinib

Journal Identification = ABC Article Identification = 0795 Date: March 26, 2013 Time: 9:48 am
doi:10.1684/abc.2013.0795
203
Pour citer cet article : Trabelsi S, Gaïes E, Sraïri S, Sahnoun R, Daghfous R, Lakhal M, Aïdli SE, Klouz A. Place du dosage plasmatique de l’imatinib (Glivec®) dans la
prise en charge des effets indésirables cutanés à l’imatinib : étude de deux cas. Ann Biol Clin 2013 ; 71(2) : 203-6 doi:10.1684/abc.2013.0795
Biologie au quotidien
Ann Biol Clin 2013 ; 71 (2) : 203-6
Place du dosage plasmatique de l’imatinib (Glivec®)
dans la prise en charge des effets indésirables
cutanés à l’imatinib : étude de deux cas
Imatinib plasma levels in the management of cutaneous side effects
induced by imatinib (Glivec®): 2 cases reports
Sameh Trabelsi1,2
Emna Gaïes1,2
Samia Sraïri2,3
Rim Sahnoun1
Riadh Daghfous2,3
Mohamed Lakhal1,2,3
Sihem El Aïdli2,3
Anis Klouz1,2
1Service de pharmacologie clinique,
Centre national de pharmacovigilance,
Tunis, Tunisie
2Faculté de médecine, Tunis, Tunisie
<gaiesemna@yahoo.fr>
3Service de recueil et d’analyse des
effets indésirables, Centre national de
pharmacovigilance, Tunis, Tunisie
Article rec¸u le 6 juin 2012,
accept´
e le 24 septembre 2012
Résumé. L’imatinib, un antinéoplasique indiqué dans le traitement de certains
cancers, a de nombreux effets indésirables hématologiques, neurologiques ou
cutanés. Ces effets sont liés à une forte concentration plasmatique d’imatinib et
sont souvent contrôlés par la diminution de la dose du médicament ou par son
arrêt. Nous rapportons dans ce travail deux cas d’atteintes cutanées à l’imatinib
montrant la place du monitorage de ce médicament. Dans les deux cas, l’imatinib
était responsable de la survenue de ces effets indésirables. Le monitorage de
l’imatinib nous a permis de juger si nous étions dans la zone de toxicité et
d’éviter parfois son arrêt.
Mots clés : imatinib, effet indésirable cutané, dosage plasmatique
Abstract. Imatinib, an antineoplastic drug used to treat certain cancers, has
many side effects such as hematologic, neurologic or cutaneous toxicity. These
toxicities seem to be due to a high imatinib plasmatic concentration and are
frequently controlled by a discontinuation or a dosage reduction of the drug.
We report here in 2 cases of cutaneous side effects induced by imatinib in
order to demonstrate the necessity of drug monitoring in such cases. In our
cases, imatinib is responsable in the occurrence of these side effects. Monitoring
plasma levels of imatinib allowed us to judge if levels were toxic or not and to
avoid discontinuation of imatinib in some cases
Key words: imatinib, cutaneous side effect
L’imatinib est un antinéoplasique qui a révolutionné le trai-
tement et le pronostic de la leucémie myéloïde chronique
(LMC) à chromosome Philadelphie positif et des tumeurs
stromales gastro-intestinales (GIST) c-kit positives [1, 2].
Son mécanisme d’action repose sur l’inhibition spécifique
de certaines tyrosines kinases dont Bcr-Abl, constituant
anormal codé par le chromosome Philadelphie, surexprimé
dans la LMC et c-kit surexprimé dans les GIST [3-5].
Toutefois, la sélectivité d’inhibition des tyrosines kinases
n’est pas absolue ce qui peut être à l’origine de nombreux
effets indésirables. Ceux-ci peuvent être graves, à type de
toxicité hématologique, neurologique et hépatobiliaire ou
modérés et représentés principalement par de la rétention
hydrique, des nausées, fatigue, rash cutané, troubles gastro-
intestinaux et myalgies. Ces effets indésirables sont le plus
souvent de mécanisme toxique [6-8].
Contrairement à la majorité des autres médicaments utilisés
au cours de la chimiothérapie anticancéreuse convention-
nelle, ce médicament a l’avantage d’être administré par
voie orale. Toutefois, par cette voie, la biodisponibilité
de ce médicament est caractérisée par une grande varia-
bilité interindividuelle de ses concentrations plasmatiques.
En effet, plusieurs études ont montré l’absence de corréla-
tion entre les doses et les concentrations plasmatiques de ce
médicament, alors que la corrélation entre la réponse thé-
rapeutique (hématologique, cytogénétique et moléculaire)
et les concentrations plasmatiques est établie [8-14].
En pratique clinique, la survenue d’un effet indési-
rable à l’imatinib met le praticien entre deux situations
embarrassantes : l’arrêt de l’imatinib et le passage aux alter-
natives plus chères et plus agressives, ou la poursuite de
l’imatinib avec la possibilité de voir les effets indésirables
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

Journal Identification = ABC Article Identification = 0795 Date: March 26, 2013 Time: 9:48 am
204 Ann Biol Clin, vol. 71, n◦2, mars-avril 2013
Biologie au quotidien
s’aggraver, en particulier les effets hématologiques, cutanés
et hépatiques.
Dans tous les cas et quelle que soit la décision prise, cette
dernière doit être justifiée et argumentée en se basant sur
des critères objectifs évaluant la balance bénéfice-risque
du médicament. Si la poursuite du traitement a été préconi-
sée, elle ne peut être justifiée que si on trouve le moyen de
contrôler le risque encouru tout en s’assurant de l’efficacité
attendue. Le dosage des concentrations circulantes chez le
patient prenant ce médicament est capable de répondre à
cet objectif. En effet, le dosage permet de situer les concen-
trations plasmatiques par rapport au seuil d’efficacité.
Nous rapportons deux cas d’atteintes cutanées à l’imatinib
(rash lichénoïde et éruption eczémato-psoriasiforme),
observés en janvier 2010 au Centre national de pharmacovi-
gilance (CNPV) et validés selon la méthode d’imputabilité
de Bégaud et al. [15] afin de montrer la place du dosage
plasmatique de ce médicament dans la prise en charge de
ce type d’effet indésirable.
L’observation 1
Monsieur T., âgé de 68 ans, traité depuis le 25 octobre 2009
par imatinib à la dose de 400 mg/j pour une Gist opérée
le 6 octobre 2009. Le 20ejour de traitement, le patient
a présenté un œdème périorbitaire, suivi de l’apparition
d’un œdème des lèvres, et des extrémités (mains et pieds).
L’évolution a été marquée par la diminution de l’œdème du
visage, mais aussi par la persistance de l’œdème au niveau
des extrémités. Le 14 janvier 2010, soit 82 jours après
le début du traitement, le patient a présenté une éruption
cutanée prurigineuse pour laquelle il a consulté en phar-
macovigilance le 29 janvier 2010. À l’examen clinique,
l’éruption cutanée était de type eczémato-psoriasiforme
avec présence de quelques lésions lichénoïdes localisées
au niveau du tronc, des membres supérieurs et des ais-
selles. Ces lésions étaient associées à des œdèmes du visage
(périorbitaire et des lèvres) et des membres inférieurs. Les
muqueuses n’étaient pas atteintes mais l’examen a objec-
tivé 4 pustules au niveau palmaire. À l’interrogatoire, le
patient a rapporté la notion d’évolution des lésions en 2
phases. Une première phase pendant les 6 premiers jours
était marquée par l’accentuation des lésions et du prurit, et
une seconde phase était caractérisée par la stabilisation des
lésions et la diminution progressive de l’intensité du prurit.
Devant ce tableau clinique et en absence d’autres étiologies,
une origine médicamenteuse a été fortement suspectée et le
rôle de l’imatinib a été retenu puisqu’il était le seul médi-
cament pris par ce patient. Malgré cela, nous n’avons pas
arrêté l’imatinib en raison de la nécessité thérapeutique de
ce produit. Nous avons donc recommandé la poursuite de
l’imatinib à la même dose et la mise du patient sous trai-
tement symptomatique à base de dermocorticoïdes. Une
biopsie cutanée et un dosage des concentrations plasma-
tiques de l’imatinib ont été pratiqués le jour même.
Le patient a été revu à la consultation de pharmacovigi-
lance le 5 février 2010 (soit une semaine après la première
consultation) pour évaluation de l’état cutané après la pour-
suite du traitement pendant une semaine. Au cours de
cette consultation, l’examen clinique a objectivé une nette
régression des lésions eczémato-psoriasiformes et du prurit
avec disparition des pustules. La biopsie cutanée a montré
des remaniements dermo-épidermiques en accord avec une
toxidermie médicamenteuse. La concentration plasmatique
de l’imatinib dosée le 29 janvier 2010 était de 1 790 ng/mL.
La conduite à tenir était de continuer l’imatinib à la même
dose moyennant la poursuite du traitement symptomatique
et la surveillance rapprochée de l’état cutané. Deux mois
après, le patient était encore sous imatinib sans aggravation
de l’état cutané.
L’observation 2
Madame G.D., âgée de 50 ans, est traitée depuis le 18 sep-
tembre 2009 par imatinib à la dose de 400 mg/j pour LMC à
chromosome Philadelphie positive avec une bonne réponse
hématologique à 1 mois et à 2 mois. Le contrôle de la fonc-
tion rénale et hépatique n’a pas objectivé d’anomalie. Le
30 novembre 2009 (soit 74 jours après le début de traite-
ment par imatinib), la patiente a développé une éruption
érythémateuse, maculo-papuleuse, lichénoïde, non pruri-
gineuse. Les lésions sont apparues au début au niveau de
la face interne de la cuisse gauche puis se sont étendues
après une semaine vers la cuisse droite et ensuite vers les
faces internes des 2 bras et vers les flancs. La patiente
a consulté en dermatologie au mois de décembre, mais
elle n’a pas pris le traitement symptomatique qui lui a été
prescrit par peur des interactions médicamenteuses avec
l’imatinib. En raison de l’évolution vers l’extension des
lésions cutanées aux membres inférieurs et supérieurs et
au tronc, la patiente a consulté en pharmacovigilance le
5 février 2010 (soit 67 jours après le début des lésions).
À l’interrogatoire, l’imatinib était le seul médicament pris
par la patiente. Une biopsie pratiquée le 14 janvier 2010
en dermatologie (compte rendu apporté par la patiente) a
montré un aspect cadrant avec une toxidermie lichénoïde.
Le rôle de l’imatinib était fortement suspecté dans la genèse
de ces lésions cutanées et la conduite à tenir préconisée
était de poursuivre l’imatinib à la même dose de 400 mg/j,
de mettre la patiente sous dermocorticoïdes, et de revoir la
patiente après une semaine pour évaluation de l’état cutané.
Un dosage plasmatique de l’imatinib a été pratiqué. Une
semaine après, les lésions cutanées ont nettement diminué
sous traitement symptomatique et ce malgré la poursuite
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

Journal Identification = ABC Article Identification = 0795 Date: March 26, 2013 Time: 9:48 am
Ann Biol Clin, vol. 71, n◦2, mars-avril 2013 205
Imatinib plasmatique et effets indésirables
de l’imatinib à la même dose. Le dosage plasmatique de
l’imatinib a révélé une concentration de 1 094 ng/mL, nous
amenant à poursuivre l’imatinib à la même dose. Le 2 avril
2010, la patiente n’avait pas des lésions cutanées malgré la
poursuite de l’imatinib.
Discussion
Dans les deux cas, le rôle de l’imatinib dans la genèse des
lésions cutanées était retenu en raison du délai d’apparition
des lésions cutanées (80 j dans le premier cas et 72 j
dans le second cas), suggestif de l’origine médicamenteuse.
Par ailleurs, l’imatinib était le seul médicament pris dans
les deux cas ; la sémiologie et en particulier la diversité
des lésions élémentaires plaidaient également en faveur
de l’origine médicamenteuse et la biopsie a montré des
remaniements cadrant avec une toxidermie. Dans la lit-
térature, les effets indésirables cutanés de l’imatinib sont
bien décrits. Les éruptions maculo-papuleuses semblent
les plus fréquentes alors que les éruptions lichénoïdes et
psoriasiformes sont rares [16-19]. L’œdème périorbitaire a
également été rapporté [6].
La conduite à tenir dans les deux cas était de poursuivre
l’imatinib pendant une semaine à la même dose après mise
des patients sous traitement symptomatique à base de der-
mocorticoïdes avant de prendre la décision finale d’arrêter
ou de poursuivre l’imatinib. La décision de la poursuite
de l’imatinib pendant une semaine, malgré son implication
et le risque d’aggravation des lésions, a été basée sur les
arguments suivants :
– le mécanisme toxique et non allergique de ces atteintes
cutanées : en effet, en cas de mécanisme allergique, la
contre-indication absolue du médicament est la règle et la
poursuite du traitement est contre-indiquée ; par contre,
en cas de mécanisme toxique, les effets indésirables sont
dose-dépendants et plus particulièrement concentration-
dépendants, donc la diminution des doses peut entraîner
la disparition des effets ;
– sur le plan sémiologique, ilyaeustabilisation spontanée
des lésions cutanées et diminution du prurit rapportées dans
le 1er cas et extension très lente des lésions dans le second
cas ;
– l’absence d’alternative thérapeutique, en particulier dans
le premier cas : en effet, le sunitinib (Sutent®) qui est le
médicament de seconde intension dans le Gist est non com-
mercialisé en Tunisie et l’arrêt de l’imatinib aurait exposé
le patient aux risques liés à la prolifération tumorale. Dans
le second cas, les médicaments de deuxième intention dans
la LMC (dasatinib et nilotinib) sont disponibles, mais ils
sont beaucoup plus chers et plus agressifs que l’imatinib,
d’autant plus que l’imatinib a donné de bonnes réponses
hématologiques [20-22].
Toutefois, la décision finale de poursuivre l’imatinib à la
même dose n’a pu être prise qu’après :
– avoir vérifié l’évolution favorable des lésions après une
semaine à la poursuite du traitement et sous dermocorti-
coïdes. L’évolution était marquée dans le premier cas par la
stabilisation des lésions, l’apparition des squames, la dispa-
rition des pustules et la diminution du prurit. Dans le second
cas, il s’agissait d’une régression nette des lésions ;
– avoir réalisé le dosage plasmatique de l’imatinib. En
effet, plusieurs études ont montré une corrélation entre des
concentrations plasmatiques supérieures à 1 000 ng/mL et
une bonne réponse hématologique, cytogénétique et molé-
culaire dans la LMC et bonne réponse thérapeutique dans
les Gist [14]. Avant de prendre le risque de poursuivre
l’imatinib et de déclencher les lésions plus graves comme
le syndrome de Stevens-Johnson ou le syndrome de Lyell,
il a fallu vérifier l’efficacité de ce médicament dans les
deux cas. Dans le premier cas, il était très tôt (au 80ej)
pour vérifier l’efficacité de l’imatinib par des moyens cli-
niques et radiologiques. Dans le second cas, la patiente avait
une bonne réponse hématologique, mais il était également
trop tôt pour vérifier la réponse cytogénétique et molécu-
laire. Dans les deux cas, le dosage plasmatique était le seul
moyen objectif nous permettant de vérifier que les concen-
trations plasmatiques étaient au-dessus du seuil d’efficacité.
La décision finale était donc de poursuivre l’imatinib, dont
les concentrations plasmatiques étaient au-dessus du seuil
d’efficacité et dont les effets indésirables cutanés étaient
contrôlés par les dermocorticoïdes.
Deux mois après, les 2 patients étaient encore sous imatinib
sans aucune complication.
Conclusion
Dans les deux cas présentés, le dosage plasmatique de
l’imatinib a permis de vérifier que les concentrations plas-
matiques étaient supérieures au seuil d’efficacité. Ce dosage
a constitué un argument permettant de prendre la décision
de poursuivre l’imatinib.
La survenue d’effet indésirable cutané à l’imatinib ne doit
pas conduire systématiquement à l’arrêt de ce médicament
car, d’une part, c’est un médicament dont l’efficacité a
été démontrée dans des pathologies considérées comme
mortelles et, d’autre part, ces effets sont de mécanisme
toxique et peuvent être contrôlés soit par une réduction
de la dose (sans pour autant exposer le patient au risque
d’échec thérapeutique) soit par le maintien de la même dose
si on arrive à contrôler les lésions cutanées par un traite-
ment symptomatique et sous contrôle rigoureux des lésions
cutanées.
Liens d’intérêts : aucun.
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

Journal Identification = ABC Article Identification = 0795 Date: March 26, 2013 Time: 9:48 am
206 Ann Biol Clin, vol. 71, n◦2, mars-avril 2013
Biologie au quotidien
Références
1. Hochhaus A. Imatinib mesylate (Glivec, Gleevec) in the treatment of
chronic myelogenous leukemia (CML) and gastrointestinal stromal tumors
(GIST). Ann Hematol 2004 ; 83 : S65-6.
2. Wong DW, Lupton SC, Bhatt L, Gross L, Tanière P, Peake DR,
et al. Use of imatinib mesylate in gastrointestinal stromal tumours :
Pan-Birmingham Cancer Network experience. Clin Oncol 2008;20:
517-22.
3. Jabbour E, Cortés JE, Kantarjian H. Optimizing treatments with
Bcr-Abl tyrosine kinase inhibitors in Philadelphia chromosome-positive
chronic myeloid leukemia : focus on dosing schedules. Clin Lymphoma
Myeloma 2008;8:S75-81.
4. Novartis Pharma. Monographie du mesylate d’imatinib (STI571)
(GleevecMD) Dorval, Québec. Septembre 2001.
5. Liu Y, Perdreau SA, Chatterjee P, Wang L, Kuan SF, Duensing A.
Imatinib mesylate induces quiescence in gastrointestinal stromal tumor
cells through the CDH1-SKP2-p27Kip1 signaling axis. Cancer Res
2008 ; 68 : 9015-23.
6. McClelland CM, Harocopos GJ, Custer PL. Periorbital edema secon-
dary to imatinib mesylate. Clin Ophthalmol 2010 ; 14 : 427-31.
7. Cohen MH, Farrell A, Justice R, Pazdur R. Approval summary : imati-
nib mesylate in the treatment of metastatic and/or unresectable malignant
gastrointestinal stromal tumors. Oncologist 2009 ; 14 : 174-80.
8. Larson RA, Druker BJ, Guilhot F, O’Brien SG, Riviere GJ, Krahnke
T, et al. Imatinib pharmacokinetics and its correlation with response and
safety in chronic-phase chronic myeloid leukemia : a subanalysis of the
IRIS study. Blood 2008 ; 111 : 4022-8.
9. Picard S, Titier K, Etienne G, Teilhet E, Ducint D, Bernard MA, et al.
Through imatinib plasma levels are associated with both cytogenetic and
molecular responses to standard-dose imatinib in chronic myeloid leuke-
mia. Blood 2007 ; 109 : 3496-9.
10. Delbaldo C. Pharmacocinétique (PK) et pharmacodynamie (PD) de
l’imatinib (Glivec®). Therapie 2007 ; 62 : 87-90.
11. Marrari A, Trent JC, George S. Personalized cancer therapy for gas-
trointestinal stromal tumor : synergizing tumor genotyping with imatinib
plasma levels. Curr Opin Oncol 2010 ; 22 : 336-41.
12. Onitilo AA, Engel JM. Managing relapse of CML using therapeutic
imatinib plasma level. Clin Adv Hematol Oncol 2009;7:763-7.
13. Mahon FX. Pharmacologic monitoring and determinants of intracy-
toplasmic drug levels. Best Pract Res Clin Haematol 2009 ; 22 : 381-6.
14. Cortes JE, Egorin MJ, Guilhot F, Molimard M, Mahon FX. Pharmaco-
kinetic/pharmacodynamic correlation and blood-level testing in imatinib
therapy for chronic myeloid leukemia. Leukemia 2009 ; 23 : 1537-44.
15. Bégaud B, Evreux JC, Jouglard J, Lagier G. Imputabilité des effets
inattendus des médicaments. Thérapie 1985 ; 40 : 111-8.
16. Valeyrie L, Bastuji-Garin S, Revuz J, Bachot N, Wechsler J, Berthaud
P, et al. Adverse cutaneous reactions to imatinib (STI571) in philadelphia
chromosome-positive leukemias : a prospective study of 54 patients.JAm
Acad Dermatol 2003 ; 48 : 201-6.
17. Schmutz JL, Barbaud A, Trechot P. Effets secondaires cutanés de
l’imatinib (Glivec). Ann Dermatol Venereol 2004 ; 131 : 5178.
18. Roux C, Boisseau-Garsaud AM, Saint-Cyr I, Hélénon R, Quist D,
Delaunay C. Toxidermie lichénoïde à l’imatinib (Glivec). Ann Dermatol
Venereol 2004 ; 131 : 571-3.
19. Basso FG, Boer CC, Corrêa ME, Torrezan M, Cintra ML, de
Magalhães MH, et al. Skin and oral lesions associated to imatinib mesylate
therapy. Support Care Cancer 2009 ; 17 : 465-8.
20. Deremer DL, Ustun C, Natarajan K. Nilotinib : a second-generation
tyrosine kinase inhibitor for the treatment of chronic myelogenous leuke-
mia. Clin Ther 2008 ; 30 : 1956-75.
21. Cassier PA, Dufresne A, Arifi S, El Sayadi H, Ray-Coquard I,
Bringuier PP, et al. Novel approaches to gastrointestinal stromal tumors
resistant to imatinib and sunitinib. Curr Gastroenterol Rep 2008 ; 10 : 555-
61.
22. Shah NP. Loss of response to imatinib mechanisms and management.
Hematology Am Soc Hematol Educ Program 2005;1:183-7.
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.
1
/
4
100%