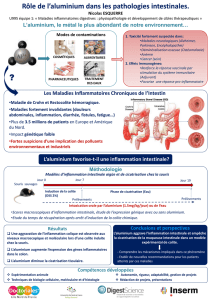
memoire - Thèses

1
Ecole Doctorale Biologie-Santé de Lille2 Unité de recherche : Inserm U995
MEMOIRE
En vue de l’obtention du
DOCTORAT DE
L’UNIVERSITE DE LILLE 2
Spécialité : Microbiologie
Soutenu publiquement le 12 juin 2012
Par Melle
DROUET Maryline
Influence de la mutation NOD2 et d’un traitement antibiotique
sur la colonisation et la pathogénicité d’AIEC dans l’exploration
de la maladie de Crohn.
MEMBRES DU JURY :
Rapporteurs : Docteur Chantal Le Bouguenec
Docteur Laurent Debarbieux
Examinateurs : Professeur Luc Dubreuil
Docteur Christel Neut
Professeur Pierre Desreumaux
Docteur Kristin Wannerberger

2
Remerciements
Ce travail a été réalisé au sein de l’Unité Inserm 995, dirigée par le Professeur Pierre
Desreumaux, Praticien Hospitalier en gastro-entérologie au CHRU de Lille, que je
remercie chaleureusement pour m’avoir accueillie dans son unité et pour tous ses
conseils et ses critiques pendant ces cinq années.
Je tiens à remercier également le Professeur Luc Dubreuil, doyen de la Faculté des
Sciences Pharmaceutiques et Biologiques de Lille et Praticien Hospitalier au CH de
Tourcoing, pour m’avoir permis de travailler au sein du laboratoire de Bactériologie
Clinique, ainsi que pour la bienveillance et la disponibilité dont il a fait preuve au
cours des cinq dernières années.
Je souhaiterais tout particulièrement remercier le Docteur Christel Neut, Maître de
Conférences en Bactériologie à la Faculté des Sciences Pharmaceutiques et
Biologiques, qui est à l’origine de ce travail, pour m’avoir encadrée durant mes cinq
années passées au laboratoire. Qu’elle trouve ici l’expression de ma reconnaissance
pour son aide, ses conseils et ses critiques qui m’ont permis de surmonter les
obstacles inhérents à toute thèse.
Je voudrais aussi remercier le Docteur Cécile Vignal, Maître de Conférences à la
Faculté de Médecine de Lille, pour m’avoir guidée techniquement et
intellectuellement tout au long de ce travail. Ces quelques lignes sont pour moi
l’occasion de la remercier très sincèrement pour sa disponibilité, sa sympathie et la
confiance qu’elle m’a apportée du début à la fin de mon parcours.
J’exprime également mes remerciements au Professeur Antoine Cortot, au Docteur
Elisabeth Singer et à Monsieur Madjid Djouina, pour leur précieuse collaboration à la
réalisation de ce travail.
Je remercie Madame Chantal Le Bouguenec, Directeur de Recherche dans l’Unité
de Biologie des Bactéries Pathogènes à Gram positif, et Monsieur Laurent
Debarbieux, Chargé de Recherche dans l’Unité de Biologie Moléculaire du Gène
chez les Extrêmophiles, à l’Institut Pasteur de Paris, pour avoir accepté de juger ce
travail en tant que rapporteurs.

3
Je remercie également Mme Kristin Wannerberger, Directeur de Projet chez Ferring,
pour sa participation à mon jury de thèse.
Je remercie l’IRMAD et l’Association François Aupetit pour avoir financé une partie
de ce projet.
Je tiens à remercier l’ensemble du Laboratoire de Bactériologie Clinique pour son
assistance technique essentielle, ainsi que pour ses conseils et ses
encouragements.
Un grand merci également à l’ensemble de l’U995, ainsi qu’aux stagiaires, passés et
présents, pour leur aide, leur sympathie, leur bonne humeur, et leur soutien dans les
périodes difficiles.
Merci enfin à ma famille et mes amis qui m’ont soutenue, encouragée, et supportée
pendant ces années d’études.

4
Sommaire
LISTE DES ABREVIATIONS ................................................................................................. 9
PARTIE 1 .............................................................................................................................13
DONNEES BIBLIOGRAPHIQUES .......................................................................................13
I) ASPECTS CLINIQUES ET EPIDEMIOLOGIQUES DE LA MALADIE DE CROHN .14
1) Historique, généralités : ..........................................................................................14
2) Description, diagnostic différentiel : ........................................................................14
3) Epidémiologie : .......................................................................................................17
4) Symptômes : ..........................................................................................................18
5) Complications : .......................................................................................................18
6) Traitement de la maladie de Crohn : ......................................................................19
a) Les anti-inflammatoires .......................................................................................19
- Les dérivés salicylés .......................................................................................19
- Les corticoïdes ................................................................................................20
b) Les anti-métabolites immunomodulateurs ...........................................................20
- Azathioprine et 6-mercaptopurine....................................................................20
- Le méthotrexate (MTX) ...................................................................................21
c) Les biothérapies .................................................................................................21
- Les anti-TNF ...................................................................................................21
- Les nouvelles cibles thérapeutiques ................................................................22
d) Les traitements d’appoints ..................................................................................22
e) La chirurgie .........................................................................................................23
7) Mécanismes inflammatoires : .................................................................................24
II) ETIOLOGIE DE LA MALADIE DE CROHN ............................................................27
1) Les mutations génétiques dans la maladie de Crohn: ............................................27
a) Le gène NOD2 / CARD15 ...................................................................................28
- Localisation chromosomique et structure ........................................................28
- Ligand de la protéine NOD2 ............................................................................29
- Fonctions de la protéine NOD2 .......................................................................30

5
- Polymorphismes de NOD2 ..............................................................................32
- Effets des mutations NOD2 .............................................................................33
- NOD2 et autres maladies ................................................................................35
b) Les autres gènes candidats associés au développement de la maladie de Crohn
35
2) La barrière intestinale dans la maladie de Crohn : ..................................................37
a) Le microbiote intestinal .......................................................................................38
- Mise en place de la flore intestinale .................................................................38
- Diversité de la flore intestinale .........................................................................39
- Le métagénome ..............................................................................................39
- Stabilité de la flore intestinale ..........................................................................40
- Fonction de la flore intestinale .........................................................................41
b) Les cellules épithéliales ......................................................................................41
c) Les défensines ...................................................................................................42
d) Le mucus ............................................................................................................42
e) Les jonctions intercellulaires ...............................................................................43
f) Le système immunitaire muqueux ......................................................................44
g) La graisse mésentérique .....................................................................................44
3) Les micro-organismes intestinaux dans la maladie de Crohn : ...............................45
a) Implication de la flore intestinale dans la MC ......................................................46
- Arguments cliniques ........................................................................................46
- Modèles animaux ............................................................................................46
- Perte de la tolérance vis-à-vis de la flore commensale ....................................46
- Perturbation de la translocation bactérienne ...................................................47
- Pathogènes candidats .....................................................................................47
b) La dysbiose chez les patients atteints de Maladie de Crohn ...............................48
c) Association entre maladie de Crohn et Escherichia coli adhérent et invasif (AIEC)
49
- Escherichia coli et maladie de Crohn ..............................................................49
- Identification et propriétés d’AIEC ...................................................................50
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
1
/
120
100%