Lien externe ou de téléchargement

Bulletin de la Recherche Agronomique du Bénin N° 41 – Septembre 2003
1
Quelques méthodes de détection de Xanthomonas campestris pv
vesicatoria dans les semences de la tomate et de l’aubergine
OUEDRAOGO
1
S. L. et MORTENSEN
2
C. N.
Résumé
Vingt huit échantillons de tomate (Lycopersicum esculentum Mill) et d’aubergine
(Solanum melongena) du Burkina Faso et de l’Indonésie ont été testés pour la présence
de Xanthomonas campestris pv. vesicatoria agent responsable de la gale bactérienne.
Le test en milieu aqueux, le semis direct sur milieu de culture et le test basé sur
l’apparition de symptômes sur les plantules sont les méthodes de détection utilisées.
Trois milieux de culture de bactéries, à savoir TWEEN B, KB et YDC, les tests
biochimiques et de pathogénie ont été utilisés pour l’identification et la caractérisation
des isolats. 14,3 % des échantillons de semences testées sont infectés par
Xanthomonas campestris pv. vesicatoria. Le test en milieu aqueux paraît donc la
meilleure méthode de détection de la bactérie dans les semences.
Mots clés : Xanthomonas campestris pv. vesicatoria, tomate, aubergine, semences.
Some methods for the detection of Xanthomonas campestris pv
vesicatoria in the tomato and eggplant seeds
Summary
Twenty eight seed samples of tomato (Lycopersicum esculentum Mill) and eggplant
(Solanum melongena) from Burkina Faso and Indonesia were tested for the detection of
Xanthomonas campestris pv. vesicatoria causing bacterial spot. Liquid assay
(stomacher extractions), direct seed planting and growing on test symptom tests were
used for the detection. Bacterial growth media, such as TWEEN B, KB and YDC,
biochemical tests and pathogenicity were used for the identification and characterization
of the isolates. 14.3 % of tested seed samples were infected by Xanthomonas
campestris pv. vesicatoria. The liquid assay seems to be the best method for the
detection of the bacteria in the seeds.
Key words : Xanthomonas campestris pv. vesicatoria, tomato, eggplant, seeds
1
Institut de l’Environnement et de Recherches Agricoles (INERA), BP 7192 Ouagadougou, Burkina Faso
2
Danish Government Institute of Seed Pathology for Developing Countries Thorvaldsensvej, 57 DK-1871
Frederiksberg C, Denmark

Bulletin de la Recherche Agronomique du Bénin N° 41 – Septembre 2003
2
Introduction
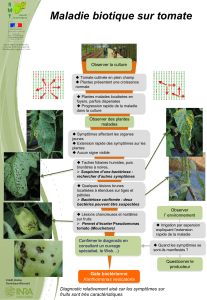
La tache bactérienne causée par
Xanthomonas campestris pv. vesicatoria
(Doidge) Dye est l’une des plus importantes
maladies bactériennes de la tomate
(Lycopersicum esculentum Mill) et du
poivron (Capsicum annuum L.) (Leite et al.,
1995). La maladie apparaît dans toutes les
régions de culture de la tomate (CMI, 1981).
Au Burkina Faso, la bactérie a été isolée des
feuilles de la tomate par Ouédraogo et
Rouamba (1996). Elle est caractérisée par
des taches brunes à noires, anguleuses sur
jeunes folioles et sur les tiges. Sur les fruits,
on observe des pustules liégeuses (4 à 5
mm de diamètre) entourées d’un halo
huileux. En climat chaud et humide, les
taches bactériennes peuvent causer une
sévère défoliation des plants et il en résulte
une réduction des récoltes. Des pertes de
rendement allant de 52 à 90 % (pertes de
poids des fruits commerciaux) ont été
signalées (Pohronezny et al., 1990 ; Jones
et al., 1986 ; Pohronezny et Volin, 1983).
Les lésions causées sur les fruits réduisent à
la fois la qualité pour la consommation en
frais et la transformation de la tomate
(OEPP/EPPO, 1992). Une baisse
significative du nombre de fruits, des
rendements et du poids par fruit a été notée
par Hartman et Hong (1991).
La bactérie survit d’une année à l’autre par
la semence mais aussi par les débris des
plants infectés. Elle est souvent isolée des
plantules ne présentant aucun symptôme sur
les cotylédons (Leben, 1963). Elle peut
survivre dans les résidus de cultures, le sol
et certainement dans les mauvaises herbes
pour de longue durée (Jones et al., 1986).
Des techniques convenables de production
tendant vers un programme de zéro
tolérance, la recherche des variétés
résistantes de tomate et d’aubergine,
l’utilisation des semences saines ainsi que
l’élimination des autres sources d’inoculum
provenant de plants vivants et de débris
végétaux sont essentielles pour le contrôle
de la maladie (Goode et Sasser, 1980)
Bien que Xanthomonas campestris pv.
vesicatoria ait été signalé dans plusieurs
pays, les informations sur le pathogène sont
rares au Burkina Faso. Des études n’ont pas
encore été conduites dans le pays pour
évaluer la présence de la bactérie dans les
semences de la tomate et de l’aubergine.
La présente étude a pour objectif d’évaluer
la prévalence de Xanthomonas campestris
pv. vesicatoria dans les semences de la
tomate et de l’aubergine collectées au
Burkina Faso et en Indonésie et de
comparer l’efficacité de 3 méthodes de
détection de la bactérie dans les semences.
Matériel et méthodes
Matériel biologique
Le matériel végétal est composé de 28
échantillons de semences dont 11 de
tomate, 6 d’aubergine violette et 4
d’aubergine locale produits au Burkina Faso,
tandis que 7 échantillons de semences de
tomate proviennent de l’Indonésie.
La tomate variété Rossol est utilisée pour le
test de pathogénie.

Bulletin de la Recherche Agronomique du Bénin N° 41 – Septembre 2003
3
La souche de référence de Xanthomonas
campestris pv. vesicatoria NCPPB 422R.129
a été fournie par le laboratoire de
bactériologie de l’Institut Danois de
Pathologie de Semences.
Matériel chimique
En tout 3 milieux de culture ont été utilisés et
il s’agit de :
- TWEEN B (peptone 8,0 g ; KBr 8,0 g ;
Cacl
2
0,20 g ; H
3
BO
3
0,24 g ; Agar
16,0 g ; eau distillée 800 ml). Après
avoir stérilisé à l’autoclave le milieu ci-
dessus décrit, on y ajoute stérilement :
8 ml de Tween 80 ; 80 mg de
cycloheximide ; 52 mg de
cephalexine ; 9,6 mg de 5-
fluorouracile ; 0,32 mg de
tobramycine
.
- King’s medium B (Protéose peptone
N°3 20,0 g ; Glycerol 15,0 ml ;
K
2
HPO
4
1,5 g ; MgSO
4
,7H
2
O 1,5 g ;
Agar 20,0 g ; eau distillée 1000 ml).
On ajuste le pH à 7,2 avant la
stérilisation à l’autoclave.
- YDC (Yest Dextrose Calcium
Carbonate agar) à savoir :
1) Yest extract 10,0 g ; Calcium Carbonate
(CaCO
3
) 20,0 g ; eau distillée 950 ml ;
2) Dextrose (L-glucose) 20,0 g ; eau distillée
50,0 ml.
On autoclave les 2 milieux séparément et on
les mélange bien à la température de 40 à
50 °C.
Méthodes de détection
Test sur symptômes de plantules
(Schackleton, 1962)
500 graines de tomate ou d’aubergine sont
prélevées une seule fois par échantillon et
placées sur 2 ou 3 couches de papier filtre
humide dans des boîtes en plastique dont
les dimensions internes sont : 30 cm x 22
cm x 8 cm. Les graines sont semées à la
densité de 2 à5 graines /cm
2
et incubées à la
température de 28 à 30 °C dans une
chambre de culture pendant 8 à 18 j avec
une alternance de 12 h d’obscurité et de 12
h de lumière (lumière du jour ou avec des
ampoules ordinaires à néon).
Les plantules montrant des décolorations
jaunes, des surfaces turgescentes, des
brunissements de tiges et des symptômes
de décolorations brunes sur les racines sont
sélectionnées et dilacérées finement à l’aide
de scalpel dans 3 à 4 ml d’eau distillée
stérile et salée (0,85 % de NaCl). La
suspension est laissée pendant 10 à 15 mn
à la température ambiante de laboratoire
pour obtenir ainsi plus de cellules
bactériennes dans l’eau.
En utilisant la pipette Pasteur stérile, une
goutte d’environ 50 µl est prélevée et
déposée sur le milieu de culture (Tween B)
dans une boîte de Pétri et étalée à l’aide du
manche Pasteur sur 3 secteurs de la boîte
afin d’obtenir des colonies séparées. Cette
opération est répétée dans 3 ou 4 boîtes de
Pétri.
Les boîtes de Pétri sont incubées en position
inversée à la température de 25 à 30 °C. La
souche de référence Xanthomonas
campestris pv. vesicatoria NCPPB 422R.

Bulletin de la Recherche Agronomique du Bénin N° 41 – Septembre 2003
4
129 est aussi étalée sur le même milieu
Tween B pour comparaison.
Les observations des boîtes de Pétri pour la
présence de Xanthomonas campestris pv.
vesicatoria sont faites après 4 à 5 j
d’incubation. Les colonies suspectes sont
transférées sur le milieu YDC pour la
purification.
Test en milieu liquide (Mortensen, 1997)
24 g de semence (approximativement
10.000 graines) sont placés dans un sachet
en plastique de dimension 20 cm x 25 cm et
d’épaisseur 0,15 mm contenant 100 ml de
phosphate buffer stérile et salé (PBS)
auxquels sont ajoutés 0,02 ml de tween 20,
le tout à un pH de 7,4. Le sachet plastique et
son contenu sont incubés dans un
réfrigérateur à 4 °C pendant 15 mn, puis
placés dans un mixeur (stomacher) et
secoués pendant 15 mn. La solution mère a
été diluée 3 fois à 1/10 et 50 µl (0,05 ml) de
chaque dilution y compris la suspension non
diluée, sont prélevés et étalés à l’aide d’un
étaloir dans une boîte de Pétri contenant le
milieu de culture Tween B. 3 boîtes de Pétri
sont utilisées par dilution. Elles sont
renversées et incubées pendant 4 à 5 j à la
température de 28 à 30 °C.
La bactérie de référence Xanthomonas
campestris pv. vesicatoria NCPPB 422R.129
est aussi étalée sur le même milieu pour une
comparaison. Le comptage du nombre de
colonies bactériennes formées par unité
(cful) est fait après la période d’incubation.
Ensemencement direct des graines
(Mortensen, 1997)
200 à 400 graines sont placées sur le milieu
Tween B contenu dans des boîtes de Pétri
(25 graines par boîte). On presse
légèrement les graines dans le milieu. Avant
l’ensemencement, les graines sont
désinfectées à la surface par immersion
dans une solution de 1 % de NaOCl pendant
3 mn suivi d’un lavage avec de l’eau distillée
stérile. On laisse les semences sécher à l’air
libre avant de les ensemencer. Les boîtes de
Pétri sont incubées à 28 à 30 °C pendant 4 à
5 j. La bactérie de référence de
Xanthomonas campestris pv. vesicatoria est
également étalée sur le milieu de culture.
Les pourcentages de semences entourées
de colonies bactériennes semblables à
Xanthomonas campestris pv. vesicatoria
sont calculés. Les colonies représentatives
sont transférées sur le milieu Tween B par
étalement de la culture bactérienne à l’aide
du manche Pasteur et les boîtes de Pétri
sont incubées à 30 °C pendant 4 à 5 j. Les
colonies de l’agent pathogène qui sont de
forme circulaire, en élévation, jaunes,
entourées de zones de cristaux blancs qui
sont des sels de calcium des acides gras
libérés du Tween B par les enzymes
lypolytiques sont retenues.
Purification et identification des colonies
isolées
Les colonies suspectes de Xanthomonas
campestris pv. vesicatoria obtenues quelle
que soit la méthode utilisée sont purifiées
sur le milieu de culture YDC et la souche de
référence Xanthomonas campestris pv.
vesicatoria NCPPB 422R.129 est aussi

Bulletin de la Recherche Agronomique du Bénin N° 41 – Septembre 2003
5
étalée sur le même milieu pour une
comparaison. Les tests biochimiques
standard utilisés pour l’identification des
bactéries après purification sont :
a) Réaction de Gram (Test de solubilité
dans KOH, Lelliot et Stead, 1987).
A l’aide du manche Pasteur les bactéries
sont prélevées à partir d’une culture pure de
24 à 48 h et frottées rapidement dans une
goutte d’une solution aqueuse de 3 % de
KOH préalablement déposée sur une lame
de verre. Au bout de quelques secondes on
soulève l’aiguille de quelques cm au-dessus
de la lame. S’il se forme un filet visqueux, la
bactérie est Gram négatif. En effet, les
bactéries de Gram positif ne produisent pas
de filet.
b) Test d’oxydase (Kovac’s 1956 ;
Hildebrand et Schroth, 1972)
Pour réaliser ce test on prépare une solution
aqueuse de 1 % de dihydrochlorure
tétraméthylparaphénylène diamine. Une
goutte de cette solution est déposée sur du
papier Whatman. Un prélèvement de culture
bactérienne de 24 à 48 h est effectué à l’aide
d’une anse et frottée dans la goutte
déposée. Si le réactif vire au pourpre de
façon instantanée ou dans les 10 secondes
qui suivent l’application de la culture, la
réaction est positive mais dans le cas
contraire elle est considérée comme
négative.
c) La fluorescence (King et al., 1954)
Concernant la fluorescence, les bactéries
sont cultivées sur le milieu King’s B pendant
24 à 48 h avant d’être passées sous des
radiations ultraviolettes fournies par des
lampes à UV. Pour les Xanthomonas une
pigmentation jaune est produite.
d) Oxydation/ Fermentation (O/F) (Fahy
et Persley, 1983).
Pour chaque isolat à tester, 2 tubes
contenant le milieu O/F sont inoculés à l’aide
d’une culture bactérienne de 24 à 48 h.
L’inoculation consiste à introduire une anse
pleine de bactéries directement au fond du
tube à essai et à la retirer aussitôt. L’un des
tubes est recouvert d’huile de paraffine de 1
à 2 cm d’épaisseur afin d’empêcher toute
infiltration d’oxygène. La bactérie de
référence est utilisée comme témoin positif.
Les tubes sont mis en incubation à 28 °C et
les observations sont faites quotidiennement
pendant 14 j. Un changement de couleur de
vert olive au jaune dans le tube non couvert
d’huile indique une oxydation tandis qu’une
coloration jaune dans les 2 tubes indique
une fermentation.
e) Test d’hydrolyse de l’amidon
(Lelliot et Stead, 1987)
Une culture bactérienne de 24 h est prélevée
à l’aide du manche Pasteur pour dessiner
une figure serpentée sur le milieu d’amidon
contenu dans une boîte de Pétri. Les boîtes
de Pétri inoculées (une boîte par isolat) sont
incubées pendant 4 j à la température de 28
à 30 °C. A la fin de la période d’incubation
les boîtes sont inondées avec de l’iode de
lugol. L’apparition d’une couleur jaunâtre
autour ou sous la culture bactérienne indique
une réaction positive. Par contre si le milieu
vire au bleu ou si on obtient une coloration
rougeâtre la réaction est négative, donc
l’amidon n’est pas hydrolysé.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%