Efficacité réelle des traitements de l`ostéoporose : l`observance en

La Lettre du Gynécologue - n° 327 - décembre 2007
Dossier
Dossier
23
Efficacité réelle des traitements de l’ostéoporose :
l’observance en question
Real effectiveness of osteoporosis treatments: the observance in question
IP P. Fardellone, L. Fages*
L’ostéoporose est une maladie généralisée du squelette
qui associe une raréfaction de la masse osseuse à des
altérations de la microarchitecture et conduit à une
fragilité excessive et donc à un risque accru de fracture (1). Les
traitements antiostéoporotiques doivent actuellement faire la
preuve scientifique de leur efficacité antifracturaire et le pra-
ticien dispose désormais de plusieurs molécules capables de
réduire l’incidence des fractures. Des zones d’ombre persis-
tent néanmoins à différents niveaux de la prise en charge des
femmes ostéoporotiques. Cela concerne notamment la défini-
tion des populations à traiter, la place respective des différents
traitements, la durée de prescription optimale de ces mêmes
traitements, les associations éventuelles entre molécules, la
meilleure façon de suivre le traitement, et l’adhésion des fem-
mes à leur traitements antiostéoporotiques…
L’adhésion au traitement (adherence pour les Anglo-Saxons)
est représentée par l’association de l’observance (compliance)
et de la persistance. L’observance est elle-même l’expression
du respect des modalités de prise du médicament (horaires de
prise, à jeun ou non…) et de leur régularité (oublis), alors que
la persistance concerne la durée effective du traitement par
rapport aux recommandations usuelles et à la prescription du
médecin. L’observance peut théoriquement se mesurer grâce
à l’indice MPR ou Medication Possession Ratio qui se calcule
en faisant le rapport du nombre de comprimé prescrits sur
une période donnée par le nombre de comprimés qui aurait
dû être pris. Lorsque le MPR est supérieur ou égal à 80 %, il est
considéré comme satisfaisant, notamment dans le cadre des
essais thérapeutiques. Les données sur l’adhésion aux traite-
ments antiostéoporotiques ont été obtenues de deux manières
:
– par des questionnaire ou des entretiens téléphoniques (2) ;
– en interrogeant des bases de données pharmaceutiques (3,
4).
L’adhésion au traitement est un problème majeur et très fré-
quent dans toutes les pathologies chroniques, surtout lors-
qu’elles sont longtemps cliniquement inapparentes. Près de la
moitié des patientes arrêtent leur traitement prématurément
ce qui compromet sévèrement leur efficacité au long cours,
même pour des pathologies aussi diverses que le diabète, l’épi-
lepsie, l’hyperlipidémie, l’hypertension et, bien entendu, l’os-
téoporose (5).
LES FAITS… !
Si les bisphosphonates représentent les traitements antiostéo-
porotiques les plus prescrits, les soucis commencent précoce-
ment puisque les études concernant l’alendronate ont montré
qu’une patiente sur six ne débutait même pas son traitement
(6). L’observance moyenne, mesurée par le MPR est meilleure
avec les bisphosphonates à prise hebdomadaire qu’avec ceux
à prise quotidienne. Elle est respectivement de 51,7 % versus
65 % (7), plus de la moitié des patientes n’atteignant pas le
niveau de MPR ≥ 80 %, seuil considéré comme acceptable (8).
Lorsque le traitement est débuté, la persistance est également
mauvaise au terme de la première année mais très variable, de
l’ordre de 25 à 70 % (9-11), mais elle reste toujours meilleure
avec les bisphosphonates hebdomadaires (4, 7, 9, 12). La plu-
part des arrêts sont précoces et surviennent dans les 6 à 7 mois
suivants le début de la prescription (2, 13). Après la première
année, la persistance reste médiocre, de l’ordre de 57 % (12).
Dans une étude dont les résultats sont issus d’un autoques-
tionnaire portant sur le risédronate, 19 % des patients traités
ont arrêté leur traitement, en grande partie à cause d’effets
secondaires et 26 % ne le prenaient pas correctement malgré
les conseils prodigués (13).
L’adhésion au traitement par les SERM (raloxifène : Evista
®
et Optruma
®
) est de l’ordre de 60 % à trois mois et 50 % à un
an (15) et se maintient à deux ans (16). Lorsqu’une meilleure
adhérence au traitement par le raloxifène était obtenue grâce
à un monitorage, l’efficacité du traitement, mesurée par des
paramètres intermédiaires comme les marqueurs urinaires
de la résorption osseuse (uNTX) et la densitométrie osseuse,
était meilleure (14). En revanche, aucun effet de l’adhérence
sur la qualité de vie n’était observé (15). La comparaison de
l’observance et de la persistance ainsi que de la satisfaction des
patientes traitées, soit par l’alendronate soit par raloxifène, au
cours d’une étude observationnelle et prospective (ouverte et
non randomisée) fournit des résultats en faveur du raloxifène
puisque les trois paramètres analysés au cours d’une année
de traitement, étaient plus satisfaisants avec le SERM (17).
La principale raison de la différence en termes de persistance
était représentée par les effets indésirables gastro-intestinaux
trois fois plus fréquents avec le bisphosphonate.
En ce qui concerne le traitement hormonal de la ménopause
(THM), il est interrompu une fois sur quatre chez des patien-
tes ménopausées ostéoporotiques (2, 16).
Le calcium à la posologie de 1 000 mg par jour et la vitami-
* Service de rhumatologie, hôpital Nord, Amiens, 80054 Cedex 1. INSERM, unité ERI 12.

La Lettre du Gynécologue - n° 327 - décembre 2007
Dossier
Dossier
24
ne D aux posologies de 400 à 800 UI par jour (CaVitD) sont
des traitements adjuvants des traitements antiostéoporoti-
ques. Leur association est systématique dans les études pivots
et devrait l’être également en pratique clinique. Cependant,
cette coprescription n’est effective que dans la moitié des cas
et la supplémentation est souvent arrêtée en raison de trou-
bles digestifs à type de constipation, douleurs abdominales.
Seule la forme quotidienne est possible pour ce qui est des
apports calciques. Ils doivent correspondre aux recomman-
dations tenant compte du sexe et de l’âge (apports journaliers
recommandés). La vitamine D, en revanche, peut s’adminis-
trer sous forme quotidienne ou bien en doses orales de charge
qui assurent une meilleure observance.
LES CONSÉQUENCES D’UNE MAUVAISE ADHÉSION
Les conséquences cliniques d’une mauvaise adhésion peuvent
se décliner selon les paramètres habituels témoignant de l’ef-
ficacité des traitements antiostéoporotiques, à savoir les mar-
queurs du remodelage osseux, la densité minérale osseuse et
l’incidence fracturaire.
C’est ainsi que le dosage des marqueurs de la résorption
osseuse tel le CTX sérique est couramment utilisé pour éva-
luer précocement l’efficacité des thérapeutiques antirésorban-
tes, comme les bisphosphonates. Une mauvaise adhérence
aux bisphosphonates oraux limite le freinage du remodelage
osseux, qui permet d’améliorer la minéralisation osseuse. Chez
des patients recevant des bisphosphonates en prévention de
l’ostéoporose cortisonée, une mauvaise observance définie par
la prise de moins de 80 % des comprimés prescrits ou bien un
arrêt prématuré du bisphosphonate réduit les gains de DMO
après trois années de traitement (18). Une bonne adhésion
au traitement par bisphosphonates optimise les effets de ces
traitements sur la réduction de l’incidence fracturaire (3, 19).
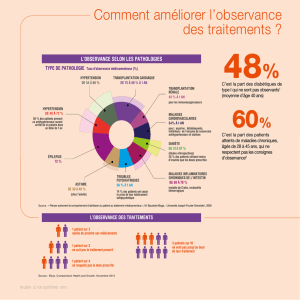
À un an de traitement antiostéoporotiques, l’analyse de bases
de données médico-administratives montre que les patien-
tes observantes présentent 16 % de fractures en moins (19).
D’autres auteurs ont rapporté qu’après deux ans de traitement
chez des femmes ménopausées ostéoporotiques, le risque
fracturaire était augmenté de 21 % chez celles qui étaient non
persistantes et de 26 % chez les non-observantes (20).
LES ORIGINES D’UNE MAUVAISE ADHÉSION
AUX TRAITEMENTS ANTIOSTÉOPOROTIQUES
Dans le domaine du traitement de l’ostéoporose comme dans
de nombreuses pathologies chroniques, les causes de mauvaise
adhésion sont nombreuses et complexes. Elles sont de trois
ordres : liées à la maladie, aux traitements ou bien aux patients.
La maladie ostéoporotique
L’adhésion d’un patient à son traitement dépend fréquemment
de sa propre appréciation de la gravité de la maladie. Cela
représente un problème en cas de maladie soi-disant “silen-
cieuse”, comme l’hypertension artérielle ou l’ostéoporose, car
les patients ne ressentent aucun soulagement de leurs symp-
tômes au cours du traitement et ils ne comprennent pas claire-
ment son intérêt. De plus, l’absence de critères intermédiaires
témoignant précocement de la réussite du traitement et per-
mettant une surveillance rapprochée est un handicap certain.
La densitométrie qui ne sera remboursée qu’au début et à la
fin du traitement ne montrera de toute façon que des progrès
peu spectaculaires en termes de gain de DMO, peut décevoir
la patiente (et le médecin…). Les traitements antiostéoporoti-
ques n’ont théoriquement pas d’effet sur les douleurs qui, lors-
qu’elles sont présentes, sont souvent d’origine arthrosique et
que la patiente rattache à tort à son ostéoporose. Ou, bien au
contraire, lorsque les violentes douleurs liées à un syndrome
vertébral fracturaire ont cessé, la patiente mal informée va
arrêter d’elle-même son traitement, s’estimant guérie. Il sem-
ble néanmoins qu’une meilleure observance soit obtenue en
présence de facteurs de risque connus et reconnus d’ostéopo-
rose et en cas de fractures vertébrales préexistentes (21).
Les thérapeutiques antiostéoporotiques
À côté des causes liées aux caractéristiques de la maladie, cer-
taines raisons de la mauvaise adhésion sont spécifiques des trai-
tements, tel est le cas des conditions d’administration qui sont
parfois contraignantes comme pour les bisphosphonates (Fosa-
max
®
, Fosavance
®
, Actonel
®
, Bonviva
®
, le ranélate de strontium
(Protelos
®
) ou la parathormone injectable (Forsteo
®
).
Dans une étude italienne portant sur un nombre très important
de femmes ménopausées ostéoporotiques, l’origine de l’arrêt
des traitements variait sensiblement en fonction des molécu-
les étudiées et des modes d’administration : supplémentation
en calcium et en vitamine D, traitement hormonal de la méno-
pause, raloxifène (RLX), risédronate quotidien (RIS), alendro-
nate à prise quotidienne (ALN10) ou hebdomadaire (ALN >
70) (21). Les meilleures observances des posologies recom-
mandées étaient observées pour ALN 70 et le THM, alors
qu’elles étaient les plus mauvaises pour CaVitD. Les question-
nements de la patiente à propos de la sécurité d’emploi étaient
les motifs les plus souvent invoqués pour expliquer l’arrêt du
THM, et l’absence de motivation pour celui du CaVitD et les
effets secondaires pour RIS, ALN et RLX. Ces données lati-
nes sont corroborées par les études anglo-saxonnes. À côté
des facteurs défavorables en termes d’observance et de persis-
tance déjà énoncés, on peut ajouter les difficultés inhérentes à
la prise médicamenteuse comme une fréquence d’administra-
tion trop élevée et ses implications sur la vie de tous les jours,
et la gestion des coprescriptions (10, 11).
La patiente ostéoporotique
Les interrogations de la patiente concernant la tolérance et la
peur des effets secondaires sont parfois des freins à l’adminis-
tration des traitements antiostéoporotiques. Parfois, c’est la
survenue de complications qui entraîne l’arrêt du traitement.
Dans une étude concernant l’alendronate, les motifs d’arrêt

La Lettre du Gynécologue - n° 327 - décembre 2007
Dossier
Dossier
25
les plus fréquents étaient représentés par les épigastralgies,
et les nausées (2). Enfin, l’ostéoporose est plus fréquente chez
les sujets âgés qui sont exposés vraisemblablement à un plus
grand nombre de comorbidités nécessitant la prescription
de traitements propres et donc la possibilité de survenues
d’interactions médicamenteuses qui nuisent, bien entendu, à
l’adhésion thérapeutique (4).
LES POSSIBILITÉS D’AMÉLIORATION
DE L’ADHÉSION AUX TRAITEMENTS
ANTIOSTÉOPOROTIQUES
L’amélioration de l’observance passe en premier lieu par une
meilleure information du patient. Cette information doit être
apportée par le médecin et relayée ou complétée par différents
acteurs de santé comme les pharmaciens. Cette information
permettra aux patientes de mieux comprendre les enjeux des
traitements antiostéoporotiques, leur maniement et leur sur-
veillance. De même, les patientes participeront au choix du
traitement le plus approprié ce qui optimisera l’observance
et la persistance. Lorsque l’information est apportée par une
personne humaine, les effets sur l’adhésion sont plus satisfai-
sants que lorsque seules des brochures sont proposées (15).
Plus de la moitié des patientes qui arrêtent précocement leur
traitement le font dans les six premiers mois, ce qui souligne
bien l’intérêt d’un accompagnement de bonne qualité dans les
premiers mois qui suivent la prescription initiale (21). D’une
façon plus générale, une meilleure connaissance de la maladie
ostéoporotique par la patiente permet d’influer sur ses habi-
tudes de vie, notamment en ce qui concerne l’alimentation et
l’exercice physique.
L’évolution sous traitement étant le plus souvent silencieuse, la
patiente admet parfois difficilement que le traitement améliore
son statut osseux. Le diagnostic d’ostéoporose est affirmé ou
confirmé par la densitométrie. Lorsque les résultats de celle-ci
sont correctement assimilés et restitués par la patiente, elle
consent plus volontiers à débuter puis à maintenir son trai-
tement (22). Cependant, bien que l’ostéodensitométrie ait été
proposée pour le suivi des traitements (23), elle n’est actuelle-
ment remboursée qu’en début et fin de traitement et ne peut
donc pas servir à l’évaluation de l’efficacité de ce dernier. C’est
pourquoi, l’utilisation des marqueurs du remodelage quoique
ne faisant pas l’objet d’un consensus, a été proposée comme
témoins précoces de l’efficacité thérapeutique. Les mesures
sériques du CTX et de la phosphatase alcaline osseuse (res-
pectivement marqueurs de la résorption et de la formation
osseuse) peuvent ainsi être réalisées avant la mise en route du
traitement et trois à six mois plus tard. La normalisation des
taux (baisse des concentrations à des niveaux équivalents de
ceux de la femme préménopausée ou calculés en pourcentage
de diminution) est un témoin précoce de la bonne efficacité
et s’accompagne d’une meilleure persistance du traitement
par bisphosphonate. Cela a été démontré par l’étude IMPACT
(24), randomisée, d’une durée d’un an et menée chez des
femmes ménopausées ostéoporotiques recevant toutes du
risédronate. La randomisation portait sur la communication
ou non du résultat du dosage des marqueurs de la résorption
osseuse. Les patientes recevant un message positif, c’est-à-dire
constatant une réduction de leur remodelage osseux cessaient
moins fréquemment leur traitement au bout d’un an.
La fréquence d’administration des traitements influe égale-
ment sur leur observance (25). C’est ainsi que le passage d’une
administration quotidienne des bisphosphonates à une prise
hebdomadaire s’est accompagné d’une amélioration d’environ
vingt pour cent de l’observance mesurée par le MPR, indépen-
damment de l’âge, de la gravité de l’ostéoporose ou du mode de
prise en charge (8, 26). Des modélisations et des enquêtes de
préférences (27) font espérer que l’avènement des bisphospho-
nates à prise orale mensuelle comme l’ibandronate (Bonviva
®
)
ou bien encore, dans un futur proche, les bisphosphonates
administrés en perfusion apportent leur contribution à l’adhé-
sion thérapeutique. L’utilisation de bisphosphonates injecta-
bles procure une biodisponibilité de 100 % et une observance
parfaite pendant la durée d’efficacité du produit. Ces bisphos-
phonates seront bientôt disponibles en injection trimestrielle
(ibandronate) ou annuelle (zolédronate).
Le conditionnement lui-même a son rôle à jouer dans l’adhé-
sion. C’est ainsi que le passage d’un conditionnement pour un
mois à un conditionnement de trois mois améliore la persis-
tance en réduisant la fréquence des achats.
La mise en place d’un monitorage par une équipe d’infirmières
formées permet d’augmenter l’adhésion au traitement de 57 %
ainsi que l’efficacité du traitement mesurée sur les marqueurs
de la résorption osseuse dans une étude portant sur le raloxi-
fène (14).
La prévention des fractures compliquant l’ostéoporose post-
ménopausique nécessite un traitement de longue durée et une
bonne adhésion de la patiente. L’amélioration de l’adhésion
des patientes aux traitements antiostéoporotiques est avant
toute chose la conséquence d’une relation de qualité entre le
médecin et sa patiente. Ce partenariat permet l’instauration
d’une relation de confiance et la transmission d’informations
concernant la maladie et les traitements. Les améliorations
technologiques que nous avons rapportées ne sont là que
pour étayer cette collaboration. Améliorer l’adhésion est évi-
demment bénéfique pour la patiente, mais l’est également en
termes de coûts de la santé pour la société.
n
références bibliograPhiques
1. National Institute of Health. Osteoporosis. Consensus conference. JAMA
1984;2525:799-802.
2. Tosteson AN, Grove MR, Hammond CS et al. Early discontinuation of treat-
ment for osteoporosis. Am J Med 2003;115:209-16.
3. McCombs JS, iebaud P, McLaughlin-Miley C et al. Compliance with
drug therapies for the treatment and prevention of osteoporosis. Maturitas
2004;48:271-87.
4. Solomon DH, Avorn J, Katz JN et al. Compliance with osteoporosis medica-
tions. Arch Intern Med 2005;165:2414-9.

Dossier
Dossier
26
RHOPHYLAC 200 microgrammes/2 ml, RHOPHYLAC 300 microgrammes/2 ml
Composition : Immunoglobuline humaine anti-D (Rh), solution injectable en seringue préremplie, 2 ml :
• Ig anti-D 1000 UI (200 microgrammes) soit 500 UI (100 microgrammes) par ml. Protéines plasmatiques
humaines
25 mg/ml* • Ig anti-D 1500 UI (300 microgrammes) soit 750 UI (150 microgrammes)
par ml. Protéines plasmatiques humaines
30 mg/ml*
* dont 10 mg/ml d'albumine humaine (stabilisant) et
95 % d'IgG. IgA
5 µg/ml.
Excipients : albumine humaine, glycine, chlorure de sodium, eau ppi.
Indications : Prévention de l’allo-immunisation fœtomaternelle Rh(D) chez les femmes
Rh(D)-négatif : grossesse / accouchement d’un enfant Rh(D)-positif, fausse couche / menace de fausse
couche / grossesse ectopique ou môle hydatiforme, hémorragie transplacentaire secondaire à une
hémorragie pré-partum, amniocentèse, biopsie de villosité choriale ou manœuvres obstétricales,
telles que version céphalique externe ou traumatisme abdominal. Traitement des sujets Rh(D)-
négatif après transfusions incompatibles de sang Rh(D)-positif ou d'autres produits contenant
des hématies Rh(D)-positif. •Posologie* : Respecter les directives professionnelles en vigueur.
Schémas recommandés : Prévention de l’allo-immunisation fœtomaternelle Rh(D) chez les
femmes Rh(D)-négatif • Prophylaxie avant l'accouchement : dose unique de 300 µg (1500 UI) IV
ou IM à 28-30 semaines de grossesse. • Prophylaxie après l'accouchement : 200 µg (1000 UI) IV
ou de 200 µg (1000 UI) à 300 µg (1500 UI) IM. Administrer RHOPHYLAC le plus tôt possible dans
les 72 heures qui suivent l'accouchement. Administrer également la dose postpartum si une
prophylaxie antepartum a été administrée. Si hémorragie fœtomaternelle importante (> 4 ml (0,7 % -
0,8 % des femmes)) soupçonnée (ex. : anémie fœtale, mort fœtale intra-utérine), estimer son
intensité par un test de Kleihauer-Betke : administrer des doses complémentaires d'Ig anti-D à raison
de 20 µg/100 UI par ml d'hématies fœtales.• Prophylaxie après une complication de la grossesse :
- Interventions et incidents 12 semaines de grossesse : 200 µg (1000 UI) IV ou IM. - Interventions
et incidents > 12 semaines de grossesse : au moins 200 µg (1000 UI) IV ou IM. - Prélèvement de villosités
choriales : 200 µg (1000 UI) IV ou IM. Administrer RHOPHYLAC dès que possible, sans dépasser
72 heures après l'événement à risque. Transfusions incompatibles : Dose recommandée : 20 µg
(100 UI) d’Ig anti-D pour 2 ml de sang Rh(D)-positif transfusés ou par ml de concentré érythrocytaire.
Injection IV recommandée. En cas d'injection IM : si les doses sont importantes, les administrer sur
plusieurs jours. Dose maximale de 3000 µg suffisante dans le cas d'importantes transfusions
incompatibles, indépendamment du fait que le volume de transfusion soit > à 300 ml de sang
Rh(D)-positif. Mode d'administration : RHOPHYLAC peut être administré par injection IV ou IM.
En cas de troubles hémorragiques contre-indiquant les injections IM, administrer par voie IV. Si dose
importante (> 5 ml) et voie IM, fractionner la dose et administrer en des sites différents. Contre-
indications Hypersensibilité à l'un des composants. Voie IM contre-indiquée en cas de
thrombocytopénie sévère ou d'autres troubles de l'hémostase. Mises en garde spéciales et
précautions particulières d’emploi* : Après l'accouchement, l'Ig anti-D est destinée à la mère.
Ne pas administrer au nouveau-né. Ne pas utiliser chez les sujets Rh(D)-positif. Maintenir les
patients en observation pendant 20 mn au moins après l’administration. En cas de réaction allergique
ou anaphylactique, interrompre immédiatement l'administration. Informer les patients des premiers
signes d'une réaction d'hypersensibilité. En cas de choc, instaurer un traitement symptomatique.
Les mesures habituelles de prévention du risque de transmission d’agents infectieux par les médicaments
préparés à partir de sang ou de plasma humain comprennent la sélection clinique des donneurs,
la recherche des marqueurs spécifiques d’infection sur chaque don et sur les mélanges de plasma
ainsi que la mise en œuvre dans le procédé de fabrication d’étapes efficaces pour l’inactivation /
élimination virale. Cependant, lorsque des médicaments préparés à partir de sang ou de plasma humain
sont administrés, le risque de transmission d’agents infectieux ne peut pas être totalement exclu.
Ceci s’applique également aux virus inconnus ou émergents ou autres types d’agents infectieux.
Les mesures prises sont considérées comme efficaces vis-à-vis des virus enveloppés (VIH, VHB et VHC).
Elles peuvent être d’efficacité limitée vis-à-vis des virus non enveloppés (VHA et parvovirus B19).
L’expérience clinique avec les Ig montre l’absence de transmission du VHA ou du parvovirus B19
et laisse également supposer que la présence d’anticorps contribue de façon importante à la
sécurité virale. Il est fortement recommandé lors de chaque administration de RHOPHYLAC à un
patient, d’enregistrer le nom et le numéro de lot du médicament, afin de maintenir un lien entre
le patient et le lot du produit. Interactions* : Reporter l'immunisation active avec des vaccins à
virus vivant atténué de 3 mois après la dernière administration de l'Ig anti-D car l'efficacité du vaccin
peut être altérée. Si l’Ig anti-D administrée dans les 2 à 4 semaines qui suivent cette vaccination, son
efficacité peut être altérée. Augmentation transitoire des anticorps transférés passivement dans le sang
du patient (p. ex. test de Coombs positif chez le nouveau-né). RHOPHYLAC peut renfermer des anticorps
dirigés contre d'autres antigènes Rh, p. ex. anti-Rh(C), qui peuvent être détectés après administration.
Grossesse et allaitement* : Médicament destiné à une utilisation pendant la grossesse. Aucun
événement indésirable imputable au médicament n'a été rapporté chez les enfants. Effets
indésirables* : Douleur et sensibilité locales au point d'injection. Hyperthermie, malaise, céphalées,
réactions cutanées et frissons occasionnels. Rares cas de nausées, vomissements, hypotension artérielle,
tachycardie et réactions de type allergique ou anaphylactique (dyspnée, choc), même en l'absence
d'hypersensibilité du patient lors d'une administration précédente. Surdosage* : Aucune donnée
disponible. Surveillance clinique et biologique en raison du risque de réaction hémolytique.
Incompatibilités : Ne pas mélanger avec d'autres médicaments. Conservation : 3 ans, conserver
la seringue (conditionnement primaire) dans l’emballage extérieur, au réfrigérateur (entre 2°C et 8°C)
et à l'abri de la lumière. Ne pas congeler. Tenir hors de la portée et de la vue des enfants. Précautions
particulières d’élimination et de manipulation* : Usage unique (une seringue-un patient).
Titulaire de l'Autorisation de Mise sur le Marché : LFB BIOMEDICAMENTS- 3, avenue des
Tropiques - BP 305 - LES ULIS - 91958 Courtabœuf Cedex - FRANCE. AMM n° : 363 970-2 : 2 ml
(200 microgrammes) - 363 971-9 : 2 ml (300 microgrammes). JUIN 2004/FEVRIER 2006. Liste I. Agréé
Collectivités. Remboursé Sécurité Sociale à 100 %. Prix public TTC : RHOPHYLAC 200 µg/2 ml : 61,57 €,
• RHOPHYLAC 300 µg/2 ml : 85,16 €.
*Pour une information complète, se reporter au RCP ou au dictionnaire des spécialités
pharmaceutiques.
JUILLET 2007 - 06G0486/3.0
RCP Rhophylac 180x120 24/09/07 13:59 Page 1
5. Emkey RD, Ettinger M. Improving compliance and persistence with bisphos-
phonate therapy for osteoporosis. Am J Med 2006;119:18S-24S.
6. Lombas C, Hakim C, Zanchetta J. Compliance with alendronate treatment in
an osteoporosis clinic. J Bone Miner Res 2001;15(Suppl):S529.
7. Bartl R, Goette S, Hadji P et al. Persistence and compliance with daily and
weekly-administered bisphosphonates for osteoporosis treatment in Germany.
Osteoporos Int 2005;16(suppl.3):S45.
8. Recker RR, Gallagher R, MacCosbe PE. Effect of dosing frequency on bisphos-
phonate medication adherence in a large longitudinal cohort of women. Mayo
Clin Proc 2005;80:856-61.
9. Cramer JA, Amonkar MM, Hebborn A et al. Compliance and persistence with
bisphosphonate dosing regimens among women with postmenopausal osteopo-
rosis. Curr Med Res Opin 2005;21:1453-60.
10. Carr AJ, ompson PW, Cooper C. Factors associated with adherence and
persistence to bisphosphonate therapy in osteoporosis: a cross-sectional survey.
Osteoporos Int 2006;17:1638-44.
11. Lo JC, Pressman AR, Omar MA, Ettinger B. Persistence with weekly alen-
dronate therapy among postmenopausal women. Osteoporos Int 2006;17:922-8.
12. Ettinger MP, Gallagher R, Amonkar M et al. Medication persistence is im-
proved with less frequent dosing of bisphosphonates, but remains inadequate.
Arthritis Rheum 2004;50:S513.
13. Hamilton B, McCoy K, Taggart H. Tolerability and compliance with risedro-
nate in clinical practice. Osteoporosis Int 2003;14:259-62.
14. Clowes JA, Peel NFA, Eastell R. e impact of monitoring on adherence
and persistence with antiresorptive treatment for postmenopausal osteoporosis:
a randomized controlled trial. J Clin Endocrinol Metab 2004;89:1117-23.
15. Guilera M, Fuentes M, Grifols M, Ferrer J et al. OPTIMA study investiga-
tors. Does an educational leaflet improve self-reported adherence to therapy in
osteoporosis? e OPTIMA study. Osteoporos Int 2006;17:664-71.
16. Kayser J, Ettinger B, Pressman A. Postmenopausal hormonal support: dis-
continuation of raloxifene versus estrogen. Menopause 2001;8:328-32.
17. Turbi C, Herrero-Beaumont G, Acebes JC et al. Compliance and satisfaction
with raloxifene versus alendronate for the treatment of postmenopausal osteopo-
rosis in clinical practice: an open-label, prospective, non randomized observatio-
nal study. Clinical erapeutics 2004;26:245-56.
18. Sebaldt R, Shane L, Pham B et al. Impact of non-compliance and non-per-
sistence with daily bisphosphonates on longer-term effectiveness outcomes in
patients with osteoporosis. J Bone Miner Res 2004;19(suppl.1):S445.
19. Caro JJ, Ishak KJ, Huybrechts KF et al. e impact of compliance with osteo-
porosis on fracture rates in actual practice. Osteoporos Int 2004;15:1003-8.
20. Siris E, Rosen C, Harris ST et al. Adherence to bisphosphonate therapy and
fracture rates in osteoporotic women: relationship to vertebral and nonvertebral
fractures from 2 US claims databases. Mayo Clin Proc 2006;81:1013-22.
21. Rossini M, Bianchi G, Di Munno O et al. Determinants of adherence to
osteoporosis treatment in clinical practice. Osteoporos Int 2006;17:914-21.
22. Pickney CS, Arnason JA. Correlation between patient recall of bone
densitometry results and subsequent treatment adherence. Osteoporosis Int
2005;16:1156-60.
23. Rolnick SJ, Kopher R, Jackson J et al. What is the impact of osteoporosis
education and bone mineral density testing for postmenopausal women in a ma-
naged care setting? Menopause 2001;8:141-8.
24. Delmas PD, Vrijens B, Eastell R et al. Effect of monitoring bone turnover
markers on persistence with risedronate treatment of postmenopausal osteopo-
rosis. J Clin Endocrinol Metab 2007;4:1296-304.
25. Chesnut III CH. Treating osteoporosis with bisphosphonates and addressing
adherence. Drugs 2006;66:1351-9.
26. Cramer JA, Amonkar MM, Hebborn A et al. Compliance and persistence
with bisphosphonate dosing regimens among women with postmenopausal os-
teoporosis. Curr Med Res Opin 2005;21:1453-60.
27. Simon JA, Beusterien KM, Hebborn A, et al. Women with postmenopausal
osteoporosis express a preference for once-monthly versus once-weekly bisphos-
phonate treatment. Female Patient 2005;30:31-6.
1
/
4
100%