Corrigé DS 6

Corrigé DS 6 - Biologie
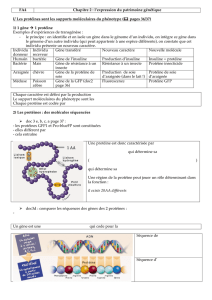
Document 1 - Analyse du phénotype de souris déficientes pour Lfng
Question 1 - Quelles parties du corps sont touchées et non touchées par la mutation de Lfng ?
La souris mutée ne mesure que 7 cm (corps total, queue incluse) contre 12 cm pour la souris témoin.
Cette taille s’explique par un sous-développement postérieur. Le développement de la tête ne semble
pas touché par la mutation, contrairement au tronc, visiblement plus court, ainsi que la queue, réduite
d’un facteur 5 environ.
Question 2 - Comparez les squelettes axiaux des 2 souris.
En vue de profil, la colonne vertébrale présente chez le témoin sauvage une succession de vertèbres
régulières et nombreuses (11 thoraciques portant des côtes et pas loin de 30 lombaires et caudales). La
souris mutante montre un empilement irrégulier de vertèbres tassées ainsi que des côtes déformées. La
vue de face permet de mieux discerner les 11 paires de côtes de la souris sauvage contre 8 paires de
forme relevée pour la souris mutée. Par contre, les proportions de régions osseuses et cartilagineuses
ne semblent pas affectées par la mutation de Lfng.
Question 3 - Concluez sur le rôle potentiel de Lfng. Comment qualifie-t-on un tel gène ?
La mutation semble donc toucher à la fois le développement (forme, organisation, taille) et le nombre
des vertèbres : le gène Lfng serait donc responsable de la mise en place de la colonne vertébrale. Il
s’agit d’un gène du développement.
Question 4 - Légendez l’image D pour l’individu sauvage.
On attend de la face dorsale à la face ventrale : épiderme, somite (ou mésoderme somitique), corde
probable, endoderme avec archentéron).
Question 5 - Identifiez la conséquence de la mutation de Lfng.
Il s’agit d’une mauvaise séparation des somites.
Question 6 - Indiquez l’objectif de l’hybridation in situ décrite en document E.
L’hybridation in situ permet de localiser l’ARNm du gène Uncx4.1. On recherche ainsi le lien entre
l’expression de ce gène somitique (plus précisément sa transcription) et la présence de la protéine Lfng.
Question 7 - Analysez le document E. Reliez vos analyses aux résultats D et formulez plusieurs
hypothèses. Précisez alors l’action de Lfng dans le développement.
Le gène Uncx4.1 ne s’exprime que dans la partie postérieure des somites dans l’embryon sauvage,
colorée en violet. L’expression est bien plus confuse et discrète chez le mutant. Cela indique l’action
activatrice de la protéine Lfng, qui permet l’expression du gène Uncx4.1 dans les cellules postérieures
des somites. En lien avec les résultats D, on peut alors émettre plusieurs hypothèses :
- Lfng est exprimé partout dans le mésoderme PS mais il active le gène Uncx4.1 uniquement dans la
partie postérieure des futurs somites, ce qui provoque leur scission ;
- ou alors Lfng provoque la scission du mésoderme PS en somites, et cette séparaion du territoire induit
l’activation de Uncx4.1 en région postérieure des territoires alors formés ;
- ou encore, Lfng ne s’exprime que dans la partie antérieure des somites et inhibe l’expression de
Uncx4.1 ; mais alors Uncx4.1 devrait être présent sur la totalité des somites visibles sur le document E
pour la souris -/- ;
- ou enfin, Lfng ne s’exprime que dans la partie postérieure des somites et stimule l’expression de
Uncx4.1.
Dans les 3 cas les plus probables, Lfng semble être un facteur de transcription spécifique, de type
activateur pour Uncx4.1. Le gène Lfng pourrait être un homéogène.

Document 2 - Patron d’expression cyclique du gène Lfng
Question 8 - Établissez une corrélation entre la limite du dernier somite formé et l’expression de
Lfng. Déduisez-en une chronologie d’expression de Lfng.
On observe 2 profils différents selon la durée de somitogenèse.
Aux temps t = 0 et t = 30 min, l’expression de Lfng est située environ 100 µm en arrière du dernier
somite. Pour les autres temps, les deux repères sont situés au même niveau sur l’axe A-P, visiblement
de plus en plus postérieur.
Lfng s’exprime donc toujours dans le mésoderme PS mais pas dans les somites formés. Son expression
est de plus en plus postérieure au cours du temps.
Question 9 - Analysez la zone d’expression de Lfng, colorée en violet, dans la partie caudale de
l’animal. Que suggère cette observation ?
À t = 0, la partie caudale présente une coloration faible, témoin d’une expression peu intense de Lfng. À
t = 30 min, Lfng ne s’y exprime plus mais l’expression est de nouveau visible à 60 min, plus faiblement à
90 min et elle devient invisible à 120 min.
Ce patron d’expression suggère une expression cyclique de Lfng dans le mésoderme PS.
Document 3 - Effet de Hes7 sur l’expression de Lfng
Document 3.1
Question 10 - Que permettent de localiser les expériences d’hybridations in situ et
d’immunocytochimie ?
L’hybridation in situ permet de visualiser les ARN codant pour Hes7, donc le niveau de transcription du
gène.
L’immunocytochimie permet de localiser les protéines Hes7 produites.
Question 11 - Que peut-on déduire des observations des groupes II et III ?
L’expression du gène Hes7 est surtout visible dans les zones où la protéine Hes7 est absente. Il
semblerait que la protéine Hes7 inhibe sa propre transcription.
Document 3.2
Question 12 - Les conclusions de la question 11 concernant Hes7 sont-elles confirmées par cette
expérience ? Justifiez votre réponse.
Au stade 10,5, les cellules caudales d’embryons transcrivent le gène Hes7 en ARN. Par contre, en
présence d’un inhibiteur de protéasome, l’ARN est absent. Cela signifie qu’il existe une protéine qui
bloque la transcription de Hes7 mais que cette protéine est normalement dégradée par le protéasome
dans les cellules caudales.
En milieu de culture, la protéine Hes7 est peu présente mais lorsque le milieu contient un inhibiteur de
protéasome, Hes7 est présente en grande quantité. La protéine Hes7 est donc détruite par le
protéasome.
La protéine Hes7 est un bon candidat pour être l’inhibiteur de sa propre transcription : l’expérience
valide donc l’hypothèse faite à la question 11.
Question 13 - Que nous apprend cette expérience sur le contrôle de Lfng ?
On observe pour la transcription de Lfng les mêmes conclusions que pour le gène Hes7. Il y a donc une
protéine inhibant la transcription de Lfng, et détruite par un protéasome : il s’agit probablement de Hes7.
Donc la protéine Hes7 inhibe la transcription de Lfng.

Document 4 - Modification de l’expression de Hes7
Document 4.1
Question 14 - Définissez un gène rapporteur et citez un exemple d’un tel gène. Expliquez l’intérêt
de la construction utilisée dans cette expérience.
Un gène rapporteur code pour un protéine facilement repérable et quantifiable par l’expérimentateur. Il
est alors aisé de quantifier sa présence, donc son taux d’expression. On peut citer le gène de la
luciférase (qui fluoresce), de la β-galactosidase (qui catalyse une réaction colorée en convertissant
l’ONPG en produit coloré)...
Dans cette expérience, le gène rapporteur est sous le contrôle du promoteur de Hes7. Donc là où le
gène rapporteur est actif, cela signifie que les cellules activent la transcription du gène Hes7.
Question 15 - Analysez et interprétez ces expériences.
On distingue deux groupes de mutants :
- les mutants K14R, K129R et K211R présentent une activité du rapporteur équivalente au sauvage. Le
gène rapporteur est peu actif. La protéine Hes7 est donc bien inhibitrice. Les mutations touchent des
secteurs hors du domaine Basic HLH (ou en limite pour K14R) : ces régions ne sont donc pas
nécessaires à l’activité de Hes7.
- les autres mutants présentent une activité du gène rapporteur équivalente au témoin sans protéine
Hes7. Cela indique donc que la protéine Hes7 mutée n’a pas pu inhiber le promoteur de Hes7. Les
acides aminés mutés sont localisés dans le domaine Basic HLH, nécessaire au contrôle du promoteur
de Hes7.
Donc la protéine Hes7 est un facteur de transcription spécifique qui se lie à l’ADN du promoteur de
Hes7 grâce à son domaine Basic HLH situé entre les acides aminés 17 et 55, et qui a un effet inhibiteur
de la transcription.
Document 4.2
Question 16 - Analysez les effets de Hes7 sur chacun des 3 gènes testés.
La colonne Hes7+/+ est le témoin positif de l’expérience. La colonne Hes7-/- sert de témoin négatif. La
colonne Hes7K14R/K14R représente un mutant dont la protéine Hes7 est modifiée dans son domaine
de liaison à l’ADN, ce qui modifie peu son activité mais augmente sa durée de vie de 50%.
Concernant l’expression de Uncx4.1
On observe que, chez le sauvage, le gène Uncx4.1 est transcrit de façon discontinue : cela correspond
probablement à la moitié postérieure des somites. On distingue clairement 8 somites mais rien encore
en partie caudale de l’animal.
En l’absence de Hes7, on observe que l’ARN Uncx4.1 est présent dans tout le mésoderme PS, de
manière continue.
Lorsque Hes7 a une durée de vie plus longue, l’expression dans les somites est normale en position
antérieure mais anormale en position postérieure. Le patron d’expression est moins net et moins coloré
(expression réduite ?).
On peut alors en déduire que :
- la protéine Hes7 inhibe l’expression de Uncx4.1 dans la région antérieure des somites ;
- si on augmente la durée de vie de Hes7, la protéine s’accumule et donc, comme elle inhibe sa propre
expression, cela diminue la production de Hes7.
Concernant Hes7
En position caudale, on remarque que Hes7 est transcrit et traduit dans un somite antérieur mais
uniformément en partie postérieure. En absence de Hes7, comme attendu, Hes7 n’est pas transcrit ni

traduit. Pour le mutant Hes7K14R/K14R, l’expression est diminuée. Cela peut paraître logique car Hes7, de
plus grande durée de vie, s’auto-inhibe. Donc en augmentant la dose de Hes7, on diminue sa quantité et
visiblement sa distribution.
Concernant Lfng
Les patrons d’expression de Hes7 et Lfng semblent en opposition. Le mutant Hes7-/- montre clairement
que, dans la zone dénuée de Hes7, le gène Lfng est très exprimé. On a une situation intermédiaire avec
le mutant Hes7K14R/K14R. Pour le sauvage, Lfng est transcrit dans les zones sans Hes7. Cela confirme les
résultats vus précédemment.
On arrive donc à préciser le modèle :
- Hes7 est un facteur de transcription qui inhibe l’expression de Hes7, Uncx4.1 et Lfng.
- il y a une variation temporelle de l’expression de Hes7, liée à sa durée de vie. Ainsi, si on considère
une évolution progressive du mésoderme PS du pôle antérieur vers le pôle postérieur, on peut
envisager que la partie antérieure du somite exprime Hes7 donc inhibe Uncx4.1 et Lfng et que Hes7
inhibe aussi de façon paracrine sa propre production. Donc lorsque l’arrière du somite se détermine, il
y a peu de Hes7 donc Lfng s’exprime, provoquant la scission de somite et Uncx4.1 s’exprime en partie
postérieure. Comme Hes7 n’est pas présent, alors la protéine Hes7 est produite et de façon paracrine
diffuse vers le mésoderme PS postérieur.
Hes7
-
Lfng
Uncx4.1
-
Hes7
-
Mésoderme
présomitique
Uncx4.1
Somite
Uncx4.1
Somite
Mésoderme
présomitique
Absence de Lfng
Absence de Uncx4.1
Absence de Hes7
Lfng
Uncx4.1
Hes7
Scission
diffusion
Uncx4.1
Somite
Uncx4.1
Somite
Hes7
-
Lfng
Uncx4.1
-
Hes7
-
Mésoderme
présomitique
ANTERIEUR
POSTERIEUR
1
/
4
100%