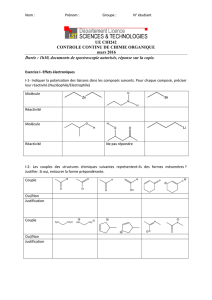
Chp 5 l analyse spectrale - Enseignement des Sciences Physiques

Terminale S_Thème 1_OBSERVER : ONDES ET MATIERE
chapitre 5_L’analyse spectrale
M.Meyniel 1/7
THEME
OBSERVER
Sous -thème
Analyse spectrale
Chapitre 5 : L’ANALYSE SPECTRALE
NOTIONS ET CONTENUS
COMPETENCES ATTENDUES
Spectres UV-visible
Lien entre couleur perçue et longueur d’onde au
maximum d’absorption de substances organiques ou
inorganiques
Spectres IR
Identification de liaisons à l’aide du nombre d’onde
correspondant ; détermination de groupes
caractéristiques.
Mise en évidence de la liaison hydrogène.
Spectres RMN du proton
Identification de molécules organiques à l’aide :
- du déplacement chimique ;
- de l’intégration ;
- de la multiplicité du signal : règle des (n+1)-uplets.
- Exploiter des spectres UV-visible.
- Exploiter un spectre IR pour déterminer des
groupes caractéristiques à l’aide de table de données
ou de logiciels.
- Relier un spectre RMN simple à une molécule
organique donnée, à l’aide de tables de données ou de
logiciels.
- Identifier les protons équivalents. Relier la
multiplicité du signal au nombre de voisins.
- Extraire et exploiter des informations sur différents
types de spectres et sur leurs utilisations.
- Mettre en œuvre un protocole expérimental pour
caractériser une espèce colorée.
- Pratiquer une démarche expérimentale mettant en
œuvre un capteur ou un dispositif de détection.
SOMMAIRE
I. Principe de la spectroscopie moléculaire.
II. La spectroscopie UV-visible.
1. Le spectre d’absorption : A = f (λ)
2. Exploitation du spectre.
III. La spectroscopie IR.
1. Le spectre IR : T = f (1/λ)
2. Exploitation du spectre.
IV. La spectroscopie RMN du proton.
1. Le spectre RMN : abscisse δ
2. Exploitation du spectre.
ACTIVITE
Activité expérimentale : Spectroscopie UV-visible Schtroumpf
Activité expérimentale : Dépouillement de spectres Thriller
EXERCICES
11 ; 16 ; 20 ; 21 p 123-127 (UV-IR) + 7 ; 16 ; 20 ; 22 p 143-146 (RMN)
MOTS CLES
Niveaux énergétiques, spectre UV-visible, spectre IR, bandes caractéristiques d’absorption, spectre
RMN, déplacement chimique, protons équivalents, multiplicité.

Terminale S_Thème 1_OBSERVER : ONDES ET MATIERE
chapitre 5_L’analyse spectrale
M.Meyniel 2/7
L’ANALYSE SPECTRALE
Nous avons déjà précisée que les ondes nous permettent d’obtenir des informations venant de l’infiniment loin mais aussi
de l’infiniment petit. Les OEM du domaine visible apportent des renseignements mais les domaines hors du visible aussi.
Ici, on se propose de réaliser ces analyses en nous intéressant notamment aux molécules qui interagissent comme toute matière
avec les ondes. Ces interactions mettent à notre disposition des informations permettant d’identifier les molécules et de connaître
leur architecture.
Comment réaliser et exploiter des spectres pour : identifier des atomes et des molécules ?
connaître l’enchaînement des atomes, les fonctions présentes ?
Pour tenter de répondre à ces questions, nous allons nous pencher sur l’étude des spectres issus des interactions ondes/molécules.
Nous verrons plus particulièrement la spectroscopie dans les domaines proches du visible avec les UV et les IR afin de caractériser
les molécules et de déterminer les fonctions qu’elles portent.
Pour compléter cette étude structurale, il conviendra de s’intéresser à la spectroscopie RMN qui nous aidera à établir
l’enchaînement des atomes dans une molécule.
I. Principe de la spectroscopie moléculaire.
Dans un spectrophotomètre, on fait passer une radiation
électromagnétique OEM à travers une solution.
L’énergie des molécules (ou atome ou noyau) est quantifiée.
Si l’énergie de la radiation correspond exactement à la différence
d’énergie entre deux niveaux de la molécule (ou de l’atome ou du
noyau) alors celle-ci absorbe la radiation en passant du niveau
fondamental (E1, état de repos, de plus basse énergie) dans un
niveau excité (E2) plus énergétique.
Rq : *L’énergie de l’onde doit être exactement égale à la différence d’énergie entre les deux niveaux de l’atome
(ou molécule ou noyau). ν est appelée la fréquence de résonance.
Document 1 : Grandeurs mesurées en spectroscopie
On mesure alors l’intensité I de la radiation transmise
inférieure à l’intensité I0 de la radiation incidente pour la
longueur d’onde utilisée.
On peut alors déterminer : - l’absorbance A de la solution :
- la transmittance T de la solution :
Si la radiation appartient : - au domaine UV-visible [200 nm ; 400 nm]-[400 nm ; 800 nm],
l’énergie est absorbée par des électrons de la molécule qui sont alors excités.
On parle de transition électronique.
- au domaine IR [800 nm ; 1 mm], l’énergie est absorbée par des
liaisons de la molécule qui vibrent alors. On parle de transition vibrationnelle
(moins énergétique que les transitions électroniques).
Rq : * L’absorbance varie entre 0 (corps transparent à la radiation lumineuse de longueur d’onde donnée) et l’infini (corps
opaque à l’OEM).
* Les molécules analysées sont, en général, dans un solvant. Ce solvant absorbe une partie du rayonnement, il faut
donc s’affranchir de son absorption en effectuant un blanc (≈ même principe que la tare sur une balance).
A = -log (
𝐈
𝐈𝟎 )
sans dimension
Ainsi, l’aspect qualitatif d’une solution, càd sa couleur, trouve
son pendant quantitatif avec une grandeur mesurable : A.
T =
𝐈
𝐈𝟎
en %
I0
I
espèce
analysée
Cuve contenant l’espèce
introduite dans le spectroscope
E (J)
E1
h.
E2
EOEM = h.ν = h.c / λ = E2 – E1
Cf ppt sur acide vanillique
Exp : cuve + spectro pr meee

Terminale S_Thème 1_OBSERVER : ONDES ET MATIERE
chapitre 5_L’analyse spectrale
M.Meyniel 3/7
II. La spectroscopie UV-visible.
1. Le spectre d’absorption : A = f (λ)
En réalisant la mesure de l’absorbance d’une solution à différentes longueurs
d’onde, on peut tracer un spectre d’absorption : A = f (λ)
On observe alors une ou plusieurs bandes d’absorption assez larges passant
par un maximum d’absorption pour une longueur d’onde donnée λmax.
Chaque bande d’absorption correspond aux radiations absorbées par les électrons de la molécule considérée.
2. Exploitation du spectre.
λmax est souvent caractéristique de la solution analysée.
Ex : amine : 195 nm / cétone : 200 nm / aldéhyde : 180 nm
Cas des alcènes : λmax = 170 nm
Si le nombre de liaisons multiples conjuguées (alternance de liaisons simples/multiples)
augmentent, λmax augmente.
Ex : Le carotène en est riche si bien qu’il absorbe vers 440 nm et apparaît orange.
Si le nombre de liaisons conjuguées est supérieur ou égale à 7, l’espèce absorbe
dans le visible. Elle est donc colorée.
La couleur perçue de la solution est la couleur complémentaire de la couleur
correspondant au maximum d’absorption :
- une solution de chlorophylle absorbe à λmax = 400 nm et λmax = 700 nm, elle apparaît verte,
- une solution de KMnO4 absorbe à λmax = 540 nm, elle apparaît magenta,
- une solution qui n’absorbe que dans l’UV et pas dans le visible apparaît incolore,
- une solution colorée absorbe dans le visible (et peut être dans l’UV aussi).
Rq : * L’absorbance A permet de remonter à la concentration C d’une solution à l’aide de la loi de Beer-Lambert :
A = k C = ε(λ,T).l.C (C < 0,1 mol/L sinon saturation du spectrophotomètre : A > 2 et Itransmis < 1%)
* Il y a additivité des absorbances : A = ∑ Ai = ε1.l.c1 + ε2.l.c2 + ε3.l.c3
* La solution n’est pas modifiée après la mesure : méthode physique non destructrice contrairement aux
méthodes chimiques.
* Solution de mélanine absorbe dans le proche UV tout comme les crèmes anti-UV (λ plus courte encore).
La spectroscopie UV-visible permet donc d’identifier des molécules et de présager des groupes fonctionnels.
Néanmoins, vu la proximité des maxima d’absorption, il convient d’utiliser une autre technique afin de confirmer ou non la
présence des groupes caractéristiques.
λ (m)
A
λmax

Terminale S_Thème 1_OBSERVER : ONDES ET MATIERE
chapitre 5_L’analyse spectrale
M.Meyniel 4/7
III. La spectroscopie IR.
1. Le spectre IR : T = f (1/λ)
Par convention, dans un spectre IR, on représente la transmittance
T (en %) en fonction du nombre d’onde σ, en cm-1 (l’inverse de la
longueur d’onde : σ = 1/λ) : T = f (σ)
Chaque creux correspond à un pic d’absorption,
donc la radiation absorbée par une liaison de la molécule qui vibre.
2. Exploitation du spectre.
On observe alors des bandes qui sont caractéristiques des groupes fonctionnels :
Ex : bande fine et intense vers 1 700-1 740 cm-1 (C=O) => groupe cétone
bande fine et intense vers 1 730 cm-1 + fine et intense entre 2 650-2 830 cm-1
(C=O) (C-H)
bande fine et intense vers 1 730 cm-1 + large et moyenne entre 2 500-3 200 cm-1
(C=O) (O-H)
bande fine et intense vers 1 650-1 700 cm-1 (C=O) => groupe amide
bande fine et intense vers 1 600 cm-1 (N-H) => groupe amine
Rq : * La position des bandes dépend peu du reste de la molécule d’où la notion de bandes caractéristiques.
* En dessous de 1 300 cm-1, il s’agit de « l’empreinte de la molécule » : partie peu exploitable pour nous mais
qui permet d’identifier les molécules à partir d’une banque de données.
* Spectre en σ = 1/λ car cela permet de faire le rapprochement avec énergie d’absorption car E = h.c/λ.
=> Plus une liaison est forte, plus il faut d’énergie pour la faire vibrer donc plus σ élevé.
Cas des alcools : * Si l’alcool est dilué, on observe une bande fine et intense vers 3 600 cm-1.
* Si l’alcool est concentré, on observe la bande s’élargit et s’affaiblit vers 3 300 cm-1.
L’allure du spectre est modifié par l’existence de liaisons hydrogènes.
(La liaison O-H est affaiblit donc on a besoin de moins d’énergie pour la faire vibrer donc λ plus longue donc ῦ plus petit)
Rq : * Il en va de même pour les amines et la liaison de l’azote (vers 3 300 cm-1).
(Il y a aussi dédoublement du pic si l’atome d’azote N porte deux atomes d’hydrogène H.)
Document 2 : Absorptions caractéristiques de quelques liaisons en spectroscopie infrarouge
La spectroscopie IR permet venir compléter les informations sur la présence de groupes caractéristiques dans une molécule (en
plus de permettre l’identification de cette molécule d’après son empreinte digitale).
Afin de connaître pleinement la structure d’une molécule, il convient d’établir l’enchaînement entre ses atomes, c’est ce que nous
permet de faire la spectroscopie RMN.
σ = 1/λ (cm-1)
T (%)
=> groupe aldéhyde
=> groupe carboxyle
Sur spectres, apparait pic entre 2 850-
3 000 car élongation C-H des alcanes
Si deuxième pic accolé entre 2 650-
2 830 alors C-H stretch aldéhyde
Liaison
Nombre d’onde σ (cm-1)
C–H
2 800 – 3 100
C–C
600 – 1 400
C=C
1 500 – 1 700
CC
2 200
C–O
1 000 – 1 300
C=O
1 700 – 1 750
O–H libre
3 600 (assez fine)
O–H lié
3 300 (large)
O–H acide carboxylique
2 500 – 3 200 (assez large)

Terminale S_Thème 1_OBSERVER : ONDES ET MATIERE
chapitre 5_L’analyse spectrale
M.Meyniel 5/7
IV. La spectroscopie RMN du proton.
1. Le spectre RMN : abscisse δ
Document 3 : Notion de relaxation
Lorsqu’il est soumis à un champ magnétique
, un noyau d’hydrogène (c’est-à-dire un proton !) est excité à
une fréquence νi correspondant à la différence d’énergie entre le niveau fondamental et le niveau excité ; on parle
alors de résonance magnétique nucléaire (RMN) du proton.
En arrêtant le champ magnétique, les protons vont se désexciter en émettant des ondes de fréquence νi
correspondant à la différence d’énergie entre le niveau fondamental et le niveau excité ; on parle de relaxation. Le
spectre RMN répertorie alors des différentes émissions.
Document 4 : Déplacement chimique
En RMN, on s’intéresse donc aux fréquences de résonance νi . Cependant, afin de mener une étude
comparative pour toutes les molécules, on considère l’écart relatif de la fréquence de résonance.
(1) On utilise alors une molécule de référence : le tétraméthylsilane, noté TMS :
Cette molécule présente l’avantage d’être inerte vis-à-vis des autres des molécules, volatile
et surtout tous ses protons résonnent à la même fréquence νréf .
On définit alors le déplacement chimique δ :
δ = 106.
sans dimension
(2) ν0 est une fréquence proportionnelle au champ magnétique
appliqué à l’échantillon. Ainsi, δ est
indépendant du champ magnétique appliqué et de la fréquence du rayonnement.
Rq : * Les déplacements chimiques étant de l’ordre du millionième, on préfère les exprimer en ppm (Cf 106).
Document 5 : Effet d’écran (ou blindage)
Le déplacement chimique d’un proton dépend de son environnement.
En effet, les électrons à proximité d’un proton (provenant des liaisons covalentes ou des atomes voisins) sont en
mouvement et diminuent l’effet du champ magnétique extérieur : c’est l’effet d’écran ou blindage.
(1) Si un proton est proche d’un atome électronégatif, avide d’électrons (O, N, F, Cl), les électrons
entourant le proton se déplacent vers cet atome. L’effet d’écran est alors faible, le proton est peu blindé (il est
déblindé). Il ressent donc intensément le champ magnétique. Sa fréquence de résonance νi est grande et son
déplacement chimique δ important.
(2) Au contraire, plus un proton est blindé, moins il ressent le champ magnétique. Sa fréquence de
résonance est donc faible et son déplacement chimique δ petit.
Ex : CHCl3 Cl très électronégatif donc H peu blindé. δ élevé (vers 7,2 ppm)
Si(CH3)4 Si peu électronégatif donc H très blindé. δ très petit => référence
Par convention, dans un spectre RMN du proton, on
présente les signaux de résonance des protons sur un
axe horizontal, orienté vers la gauche dans le sens du
déplacement chimique (en ppm) croissant.
Chaque pic correspond à la fréquence de résonance caractérisant l’onde émise
par un proton lors de sa relaxation.
Echantillon placé
dans un champ
magnétique 𝐁𝟎
Les noyaux d’hydrogènes
résonnent (excitation), chacun
à une certaine fréquence νi .
Les noyaux se désexcitent
(= relaxation) émettant une
onde de fréquence νi
Excitation par
onde radio
f > 108 Hz
Spectre
RMN
νi fréquence de résonance du proton (en Hz),
νréf fréquence de résonance du TMS (en Hz),
ν0 fréquence du rayonnement envoyé sur échantillon (en Hz).
Découverte en 45 RMN par Felix Bloch et Edward Purcell
du phénom de RMN dans la matière. Nobel en 52.
δ (ppm)
0
 6
6
 7
7
1
/
7
100%