corrigé

DEVOIR
SURVEILLÉ
SECONDE
THÈMES : SANTÉ- UNIVERS
CONCENTRATION MASSIQUE / MOLÉCULES / RÉFRACTION DE LA LUMIÈRE (CORRIGÉ)
DS 01 A
2011
NOM : ....................................... PRÉNOM : .................................... CLASSE : .............................. DATE : ...........................................
Rappel une formule littérale du résultat est exigée avant tout calcul numérique
I. Concentration massique d’une solution aqueuse
Un médicament antiasthénique peut être utilisé dans le
traitement d’appoint de la fatigue, lorsque celle-ci n’est pas due à
une maladie. Sa notice indique la composition ci contre les masses
sont données pour un comprimé de 4,3g à dissoudre dans un verre
d’eau.
On dissout un comprimé dans un verre d’eau le volume de la solution S obtenue est alors égal à v =200 mL.
a) Déterminer la concentration massique Cm de Glucuronamide de la solution S.
Cm = m
V
Masse de glucuronamide m = 400mg = 0,400 g
Volume de la solution obtenue par dissolution V =200 mL = 0,200 L
Cm= 0,400
0,200 =2,00 g.L–1
On souhaite confectionner un volume V' = 0,50 L d’une solution S’ 10 fois moins concentrée en Glucuronamide que la solution S
b) Donner le nom de l’opération réalisée pour obtenir cette solution S'?
L’opération qui permet d’obtenir une solution fille S’ dix fois moins concentrée est appelée dilution.
c) Quelle serait alors la concentration de la solution fille Cm
' obtenue ?
On souhaite que la solution fille soit dix fois moins concentrée donc C’m
Cm =
C’m= Cm
10
Cm = 2,00 g.L–1
C’m= 2,00
10 = 0,200 g.L-1
d) Expliquer le mode opératoire permettant d’obtenir cette solution S’ à partir de la solution S
- Prélever dans un becher, un volume V0 de solution mère à la pipette graduée ou pipette jaugée
- Transvaser le prélèvement de solution mère dans une fiole jaugée de volume V’ = 0.50 L
- Ajouter de l’eau distillée au deux tiers de la fiole jaugée
- Boucher la fiole et agiter
- Ajouter de l’eau distillée dans la fiole jusqu’au trait de jauge
- Boucher et agiter pour homogénéiser la solution
- Vérifier si le creux du ménisque de la solution fille effleure bien le trait de jauge de la fiole , ajouter de l’eau distillée si
nécessaire pour rétablir le niveau.
e) Déterminer le volume V0 de solution S à prélever pour obtenir la solution diluée S’
La conservation de la masse m0 de soluté prélevé dans la pipette et celle m’ se retrouvant dans la solution fille
obtenue permet d’écrire : m0 = m’
or : m0 = Cm0
V0 et m’ = C’m
V’
On en déduit la relation de la dilution
Cm0
V0 = C’m
V’
On en déduit le volume V0 de solution mère à prélever
V 0= C’m
V’
Cm0
Application numérique
C’m = 0,200g.L–1
V’ = 0,50 L
Cm0= 2,00 g.L–1
V0 = 0,200
0,50
2,00
V0 = 0,050 g.L–1

f) Déterminer la masse de m1 de Glucuronamide que renferme un volume V1 = 200 mL de solution fille ainsi préparée
qu’un patient s’apprête à ingérer.
La concentration en glucuronamide contenu dans le volume V1est :
C’m = m
V
d’où
m1 = C’m
V1
application numérique
C’m = 0,200g.L–1
V1 = 200 mL = 0,200 L
m1 = 0,200*0,200
m1 = 0,0400 g.L-1
g) Déterminer volume V2 de la solution S’ qu’il faudrait prélever pour disposer d’une masse m2 = 10 g de
glucuronamide en solution
La concentration en glucuronamide de la solution fille est :
C’m = m
V
Pour disposer de la masse m2 de soluté il faudra prélever un volume V2 :
V2 = m
C’m
Application numérique
m2= 10 g
C’m = 0,200g.L–1
V2 =
,
V2=50,0 L
Pour disposer de 10g de glucuronamide il faudrait 50,0 L de la solution fille S’
h)
II. Des molécules de principes actifs dans les médicaments
1/ Nombre de liaisons qu’établissent les atomes dans une molécule
i)
Le modèle moléculaire ci-contre représente la molécule d’aspirine (acide
acétylsalicylique). Cette molécule renferme des atomes d’hydrogène d’oxygène et de
carbone .Les atomes d’oxygène ont été marqué par la lettre O
j)
a) Compléter le tableau ci-dessous en indiquant le nombre de liaison qu’établissent
chacun des atomes
atome
H
C
O
Nombre de liaisons
1
4
2
k)
Donner sa formule brute
C9H8O4
b) Représenter sa formule développée
c) Représenter sa formule semi
développée
l)
d) Représenter ci-contre une molécule isomère de l’aspirine
(molécule qui a même formule brute mais pas la même formule
développée)
Acide 3-oxo-3-phenoxypropanoïque(C9H8O4)
m)

III. Loi de la réfraction de Snell Descartes
L’astronome danois Tycho Brahé (1546-1601), insatisfait de la précision des
tables astronomiques d’avant 1563, a voué une grande partie de sa vie à refaire
les mesures des positions des étoiles avec une précision exceptionnelle pour
l’époque. Par exemple, il a corrigé ses valeurs pour tenir compte de la réfraction
atmosphérique. L’air, en effet, n’a pas le même indice que le vide interstellaire.
Les rayons lumineux provenant des étoiles sont donc déviés à l’entrée dans
l’atmosphère. La simplification suivante permet d’évaluer ce phénomène : la
portion de la Terre où se trouve l’astronome est considérée comme plate,
l’atmosphère est assimilée à une couche d’air homogène d’indice nair = 1,0003
(fig. 4). L’indice du vide est nvide= 1,0000.
n)
a) Compléter le schémas ci contre en faisant apparaître un rayon lumineux
allant de l’étoile E à l’œil de l’observateur O.(prendre la pupille de l’œil de
l’observateur pour O)
b) Faire apparaître l’angle d’incidence i de ce rayon à l’entrée de l’atmosphère,
ainsi que l’angle de réfraction r.
o)
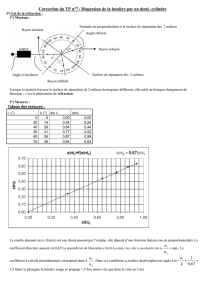
On donne la loi générale de Snell Descartes : n1sin(i1) = n2sin(i2)
c) En déduire une expression littérale du sinus de l’angle de réfraction sin(r) en fonction de nair et du sinus de l’angle
d’incidence sin(i)
La loi de Descartes s’écrit dans le cas présent
nvide sin(i) = nair sin(r)
On en déduit
sin( r) = nvide
sin(i)
nair
n1 est l’indice de réfraction du vide n1 = 1,0000
n2 est l’indice de réfraction du second milieu c'est-à-dire l’air n2 = 1,0003
p)
d) Calculer la valeur de sin(r) en prenant pour i =85,00 °
sin( r) = nvide
sin(i)
nair
application numérique:
n1 est l’indice de réfraction du vide n1 = 1,0000
n2 est l’indice de réfraction du second milieu c'est-à-dire l’air n2 = 1,0003
i = 85°
sin( r) =
,
sin
°
,
=
,
,
=0,99954784
q)
e) En déduire la valeur de l’angle de réfraction r et conclure en comparant la valeur de r trouvé à celle de i
la recherche de l’angle correspondant s’obtient en utilisant la touche SIN-1 ou Asin de la calculette
on trouve
r=88,27694132
r= 88,28 °
r)
O
E
atmosphère
Vide interstellaire
r
i

DEVOIR
SURVEILLÉ
SECONDE
THÈMES : SANTÉ- UNIVERS
CONCENTRATION MASSIQUE / MOLÉCULES / RÉFRACTION DE LA LUMIÈRE(CORRIGÉ)
DS 01 B
2011
NOM : ....................................... PRÉNOM : .................................... CLASSE : .............................. DATE : ...........................................
Rappel une formule littérale du résultat est exigée avant tout calcul numérique
I. Concentration massique d’une solution aqueuse
Un médicament antiasthénique peut être utilisé dans le
traitement d’appoint de la fatigue, lorsque celle-ci n’est pas due à
une maladie. Sa notice indique la composition ci contre les masses
sont données pour un comprimé de 4,3g à dissoudre dans un verre
d’eau.
On dissout un comprimé dans un verre d’eau le volume de la solution S obtenue est alors égal à v =200 mL.
a) Déterminer la concentration massique Cm d’acide ascorbique de la solution S.
Cm = m
V
Masse de d’acide ascorbique m = 500mg = 0,500 g
Volume de la solution obtenue par dissolution V =200 mL = 0,200 L
Cm= 0,500
0,200 =2,50 g.L–1
On souhaite confectionner un volume V' = 0,50 L d’une solution S’ 10 fois moins concentrée en acide ascorbique que la solution S
b) Donner le nom de l’opération réalisée pour obtenir cette solution S'?
L’opération qui permet d’obtenir une solution fille S’ dix fois moins concentrée est appelée dilution.
c) Quelle serait alors la concentration de la solution fille Cm' obtenue ?
On souhaite que la solution fille soit dix fois moins concentrée donc C’m
Cm =
C’m= Cm
10
Cm = 2,50 g.L–1
C’m= 2,50
10 = 0,250 g.L-1
d) Expliquer le mode opératoire permettant d’obtenir cette solution S’ à partir de la solution S
- Prélever dans un becher, un volume V0 de solution mère à la pipette graduée ou pipette jaugée
- Transvaser le prélèvement de solution mère dans une fiole jaugée de volume V’ = 0.50 L
- Ajouter de l’eau distillée au deux tiers de la fiole jaugée
- Boucher la fiole et agiter
- Ajouter de l’eau distillée dans la fiole jusqu’au trait de jauge
- Boucher et agiter pour homogénéiser la solution
- Vérifier si le creux du ménisque de la solution fille effleure bien le trait de jauge de la fiole , ajouter de l’eau distillée si
nécessaire pour rétablir le niveau.
e) Déterminer le volume V0 de solution S à prélever pour obtenir la solution diluée S’
La conservation de la masse m0 de soluté prélevé dans la pipette et celle m’ se retrouvant dans la solution fille
obtenue permet d’écrire : m0 = m’
or : m0 = Cm0
V0 et m’ = C’m
V’
On en déduit la relation de la dilution
Cm0
V0 = C’m
V’
On en déduit le volume V0 de solution mère à prélever
V 0= C’m
V’
Cm0
Application numérique
C’m = 0,250g.L–1
V’ = 0,50 L
Cm0= 2,50 g.L–1
V0 =
,
,
,
V0 = 0,050 g.L-1

f) Déterminer la masse de m’ de Acide ascorbique que renferme un volume V1 = 200 mL de solution fille ainsi préparée
qu’un patient s’apprête à ingérer.
La concentration en glucuronamide contenu dans le volume V1est :
C’m = m
V
d’où
m1 = C’m
V1
application numérique
C’m = 0,250g.L–1
V1 = 200 mL = 0,200 L
m1 = 0,250*0,200
m1 = 0,0500 g.L-1
g) Déterminer volume V2 de la solution S’ qu’il faudrait prélever pour disposer d’une masse m2 = 20 g de acide
ascorbique en solution
La concentration en glucuronamide de la solution fille est :
C’m = m
V
Pour disposer de la masse m2 de soluté il faudra prélever un volume V2 :
V2 = m
C’m
Application numérique
m2= 20 g
C’m = 0,250g.L–1
V2 =
,
V2= =40 L
Pour disposer de 20g de glucuronamide il faudrait 50,0 L de la solution fille S’
h)
II. Des molécules de principes actifs dans les médicaments
1/ Nombre de liaisons qu’établissent les atomes dans une molécule
i)
Le modèle moléculaire ci-contre représente la molécule d’acide salicylique. Cette molécule
renferme des atomes d’hydrogène d’oxygène et de carbone .Les atomes d’oxygène ont été
marqué par la lettre O
j)
a) Compléter le tableau ci-dessous en indiquant le nombre de liaison qu’établissent chacun des
atomes
b)
c)
d)
atome
C
O
H
Nombre de liaisons
4
2
1
k)
b) Donner sa formule brute
C8H8O4
c) Représenter sa formule développée
d) Représenter sa formule semi
développée
l)
 6
6
1
/
6
100%