TS Chimie L`histoire des piles Exercice résolu

Page 1 sur 5
Histoire des piles Document M.Moppert
TS Chimie
L’histoire des piles Exercice
résolu
- Enoncé –
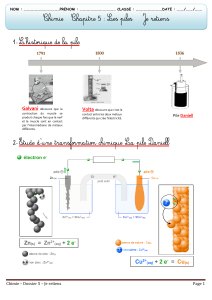
Luigi Galvani (1737-1797), anatomiste italien, avait l’habitude d’étudier les tressaillements des
pattes de grenouilles (il travaillait sur des cadavres de grenouilles) lorsque celles-ci étaient
soumises à des décharges d’électricité statique. Un jour, alors qu’il y avait du vent, il suspendit
les cadavres de grenouilles à son balcon en fer, par un fil de cuivre… Les cadavres se mirent à
tressaillir et Galvani en conclut à l’existence d’une « électricité animale » provenant des
grenouilles.
Dans les années 1800, le comte Alessandro Volta (1745-1827), physicien, compatriote et
contemporain de Galvani, pensa lui à une « électricité extérieure ». Il s’appuya sur les
observations de Galvani, et après plusieurs essais avec des métaux et des solutions différentes,
il réalise enfin un empilement qui lui convient : il empile toujours dans le même ordre, une rondelle
de zinc, une rondelle de carton imbibée d’eau acidifiée puis une rondelle de cuivre, et ainsi de
suite pendant plus de soixante fois. Lorsqu’il rapproche deux fils qu’il avait fixés aux deux
extrémités de sa pile, une étincelle bleue et très lumineuse jaillit.
Cependant, la pile voltaïque, toute révolutionnaire que fut sa découverte, a mérité de nombreuses
modifications :
• La solution aqueuse s’écoulait, provoquant des court-circuits à l’intérieur de la pile.
• Les rondelles de carton se desséchaient.
• Un phénomène de polarisation apparaissait, ce qui diminuait notablement la f.é.m de la pile…
Cette polarisation est due à un dépôt de dihydrogène sur une des électrodes de la pile. Ce dépôt
forme une couche isolante, un écran, qui gêne la circulation des charges.
De nombreux physiciens se sont penchés sur le problème de l’amélioration de la pile voltaïque.
Ainsi, d’une position verticale, les empilements se sont faits à l’horizontale, les surfaces
métalliques ont été agrandies… Mais le problème de la polarisation demeurait…
En 1829, Antoine César Becquerel se préoccupe de ce problème. Il invente une pile qui évite ce
phénomène parasite. Il enferme la plaque de zinc baignant dans l’eau acidifiée à l’intérieur d’un
sac en baudruche, et il plonge le tout dans un vase rectangulaire rempli d’une solution saturée de
sulfate de cuivre. La baudruche empêche le mélange défavorable des deux solutions, sans gêner
la circulation des porteurs de charge.
En 1836, John Frédéric Daniell (1790-1845) a l'idée de
remplacer la baudruche par un vase en terre poreuse, un peu
par hasard, parce qu'elle n'avait été cuite qu'en partie…
La pile de Daniell eut un grand succès. Elle fut longtemps
utilisée par ceux qui recherchaient un courant stable.

Page 2 sur 5
Histoire des piles Document M.Moppert
Les couples oxydant-réducteur mis en jeu sont : Cu
2+ (aq)
/Cu
(s)
- Zn
2+ (aq)
/Zn
(s)
- H
2
O/H
2(g)
A. Première partie : l’histoire de la pile en questions
1.
a)
Quels sont les trois éléments nécessaires à la fabrication d’une pile selon Volta ?
b)
Pour arriver à construire sa pile, Volta s’est appuyé sur les observations de Galvani. Quels sont
les trois éléments de la « pile de Galvani » qui ont mis Volta sur la voie de sa propre invention ?
2.
a)
Légender le schéma n°1 en annexe, représentant schématiquement un élément de la pile de
Volta.
b)
Au cours de la transformation le zinc est oxydé. Écrire la demi-équation chimique
correspondante. Quelle est la polarité de cette électrode ?
c)
La formation du dihydrogène résulte de la réduction de l’eau acidifiée. Écrire la demi-équation
électronique correspondante. Sur quelle électrode se forme le dihydrogène ?
3.
a)
Légender le schéma n°2 en annexe, représentant la pile de Becquerel.
b)
Afin d’empêcher la polarisation de l’électrode, les ions cuivre II réagissent avec le
dihydrogène, selon l’équation chimique : Cu2+(aq) + H2(g) + 2 H2O = Cu(s) +2 H3O+(aq)
Représenter sur le schéma 2, le sens de circulation des ions H3O+(aq) et celui des électrons.
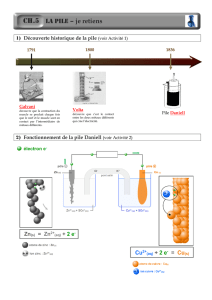
B. Deuxième partie : la pile Daniell
Données :
• Masse molaire du zinc : M = 65,4 g.mol-1
• 1 F = 9,7 x 104 C.mol-1
Une pile Daniell est représentée sur le schéma n°3 de l’annexe. Elle est constituée d’une
électrode de zinc et d’une électrode de cuivre. L’électrode de zinc plonge dans une solution
aqueuse de chlorure de zinc. L’électrode de cuivre plonge dans une solution aqueuse saturée de
chlorure de cuivre II, elle-même contenue dans un creuset en terre, constituant un diaphragme
poreux.
1. En branchant un voltmètre aux bornes du dispositif, de façon à ce que sa borne COM soit
reliée à la lame de zinc, on relève une tension de U0 = 1,1 V.
a)
Indiquer la polarité de la pile sur le schéma n°3.
b)
En déduire l’équation de la réaction qui a lieu lorsque la pile débite un courant.
c)
Quel est le rôle de la paroi poreuse ?
2.
a)
Quel est l’intérêt d’utiliser une solution saturée de chlorure de cuivre II ?
b)
La solution de chlorure de zinc doit-elle être également très concentrée ?
3. Dans le creuset, on a introduit un volume V1 = 250 mL d’une solution saturée de chlorure de
cuivre II de concentration molaire apportée c1 = 8,6 mol.L-1. A l’extérieur, se trouve un volume V2
= 500 mL d’une solution de chlorure zinc de concentration molaire apportée c2 = 0,10 mol.L-1.
On relie les deux bornes de la pile par l’intermédiaire d’un conducteur ohmique de faible
résistance.
a)
Calculer le quotient de réaction dans l’état initial du système.
b)
Une pile en fonctionnement est-elle un système en équilibre, ou hors de son état d’équilibre ?
c)
Comment doit alors évoluer le quotient de réaction ?
d)
A température ambiante, la constante d’équilibre du système est K = 1,0 x 1034. Cette valeur
confirme-t-elle la réponse précédente ? Que peut-on conclure de la valeur de K ?

Page 3 sur 5
Histoire des piles Document M.Moppert
4. La partie immergée de l’électrode de zinc a une masse m = 70 g. On suppose que la pile débite
un courant d’intensité constante, I = 150 mA.
a)
Vérifier que le zinc est le réactif limitant.
b)
Exprimer la durée maximale Δt de fonctionnement en fonction des données.
c)
Faire l’application numérique et exprimer le résultat à l’aide d’une unité adaptée…
ANNEXE
Schéma 1
R
Schéma 2
R
Schéma 3
lame de cuivre
lame de zinc
(Zn
2+
(aq) + 2Cl
-
(aq)) (Cu
2+
(aq) + 2Cl
-
(aq))
creuset en terre
cristaux de chlorure
de cuivre II

Page 4 sur 5
Histoire des piles Document M.Moppert
- Corrigé –
A. Première partie : L’histoire de la pile en questions
1. a) Quels sont les trois éléments nécessaires à la fabrication d’une pile selon Volta ?
Deux métaux et une solution conductrice.
b) Pour arriver à construire sa pile, Volta s’est appuyé sur les observations de Galvani. Quels sont les trois
éléments de la « pile de Galvani » qui ont mis Volta sur la voie de sa propre invention ?
Dans la « pile de Galvani », le balcon en fer joue le rôle d’une électrode, le fil de cuivre étant
l’autre électrode. Les grenouilles font office d’électrolyte.
2. a) Légendez le schéma 1 en annexe, représentant schématiquement
un élément de la pile de Volta.
b) Au cours de la transformation le zinc est oxydé. Écrivez la demi-
équation chimique correspondante. Quelle est la polarité de cette
électrode ?
Zn(s) = Zn2+(aq) + 2 e- : la lame de zinc constitue le pôle
négatif de la pile.
c) La formation du dihydrogène résulte de la réduction de l’eau
acidifiée. Écrivez la demi-équation électronique correspondante. Sur
quelle électrode se forme le dihydrogène ?
Les électrons libérés par l’oxydation de la lame de zinc
circulent dans les fils conducteurs et arrivent sur la lame
de cuivre où ils permettent la réduction de l’eau suivant la
demi-équation :
2 e- + 2 H+(aq) + H2O = H2(g) + H2O soit 2 H+(aq) + 2 e- =
H2(g)
Le dihydrogène se forme donc sur l’électrode de cuivre.
3. a) Légendez le schéma 2 en annexe, représentant la pile de Becquerel.
b) Afin d’empêcher la polarisation de l’électrode, les ions cuivre II réagissent avec le dihydrogène, selon l’équation
chimique : Cu
2+ (aq)
+ H
2(g)
+ 2 H
2
O = Cu
(s)
+2 H
3
O
+(aq)
Représentez sur le schéma 2, le sens de circulation des ions H
3
O
+(aq)
et celui des électrons.
Schéma 1
R
Lame de zinc
Lame de cuivre
Eau acidifiée
Schéma 2
R
Lame de cuivre Lame de zinc
Solution aqueuse
saturée de sulfate
de cuivre
Sac en
baudruche
Eau acidifiée
Electrons
H3O
+
(aq)

Page 5 sur 5
Histoire des piles Document M.Moppert
B. Deuxième partie : la pile Daniell
1. En branchant un voltmètre aux bornes du dispositif, de façon à ce que sa borne COM soit reliée à la lame de
zinc, on relève une tension de U
0
= 1,1 V.
a) Indiquez la polarité de la pile sur le schéma 3.
La tension lue sur le voltmètre est positive : l’électrode de cuivre est donc la borne positive et
l’électrode de zinc est la borne négative.
b) Déduisez-en l’équation de la réaction qui a lieu lorsque la pile débite un courant.
Sur l’électrode de zinc : Zn = Zn2+ + 2 e- (oxydation)
Sur l’électrode de cuivre : Cu2+ + 2 e- = Cu (réduction)
Bilan : Zn(s) + Cu2+(aq) = Zn2+(aq) + Cu(s)
c) Quel est le rôle de la paroi poreuse ?
La paroi poreuse, en permettant aux ions de la traverser, permet d’assurer la circulation des
porteurs de charge et donc la circulation du courant électrique.
2. a) Quel est l’intérêt d’utiliser une solution saturée de chlorure de cuivre (II) ?
Les ions cuivre (II) sont réduits et donc consommés pendant que le pile fonctionne. Utiliser une
solution saturée de chlorure de cuivre (II) permet de disposer d’ions cuivre (II) le plus
longtemps possible et donc de s’assurer que la pile débitera un courant le plus longtemps possible.
b) La solution de chlorure de zinc doit-elle être également très concentrée ?
Des ions zinc se forment pendant que le pile fonctionne : du seul point de vue de la durée de
fonctionnement, l’utilisation d’une solution saturée de chlorure de zinc est sans intérêt.
3. a) Calculez le quotient de réaction dans l’état initial du système.
Qr,i=
2
(aq)
2
(aq)
[Zn ]
[Cu ]
+
+ => Qr,i =
2
1
C
C
soit Qr,i =
0,10
8,6
= 1,2 x 10-2
b) Une pile en fonctionnement est-elle un système en équilibre, ou hors de son état d’équilibre ?
Une pile en fonctionnement est le siège d’une transformation chimique : ce système, hors état
d’équilibre, évolue jusqu’à atteindre un état d’équilibre.
c) Comment doit alors évoluer le quotient de réaction ?
La réaction a lieu dans le sens direct de l’équation : Zn(s) + Cu2+(aq) = Zn2+(aq) + Cu(s). Le quotient de
réaction va donc augmenter jusqu’à atteindre la valeur de la constante d’équilibre.
d) A température ambiante, la constante d’équilibre du système est K = 1,0 x 10
34
. Cette valeur confirme-t-elle
la réponse précédente ? Que pouvez-vous conclure de la valeur de K ?
Qr,i < K : le système évolue dans le sens direct… ce qui confirme la réponse précédente.
D’autre part, K > 104 : la réaction est quasi-totale.
4. a) Vérifiez que le zinc est le réactif limitant.
Quantité de zinc présent initialement : n(Zn)0 =
m
M(Zn)
soit n(Zn)0 =
70
65,4
= 1,1 mol.
Quantité d’ions cuivre (II) présents initialement : n(Cu2+)0 = 8,6 x 0,250 = 2,2 mol.
La réaction s’effectuant mole à mole, le zinc est bien le réactif limitant.
b) Exprimez la durée maximale Δt de fonctionnement en fonction des données.
D’après les demi-équations électroniques : n(Zn)consommé = n(Zn)0 =
n(e )
2
−
=> n(e-) = 2.n(Zn)0
Or : I =
Q
t
∆
avec Q = n(e-). F =>
t
∆
= 2.F.
m
M(Zn).I
c) Faites l’application numérique et exprimez le résultat à l’aide d’une unité adaptée…
∆
∆∆
∆t = 2 x 9,7 x 104 x
70
65, 4 0,15
×= 1,4 x 106 s (ou environ 16 jours)
1
/
5
100%