La cellule de Sertoli, une cellule endocrine - iPubli

SYNTHÈSE
ene/sens 1995 ; 11 : 537-46
Naalie Josso
Rodolfo Rey
293
La cellule de Sertoli,
une cellule endocrine
C

J
J
J
1


�
e
�
I

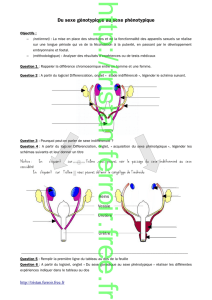
SRY,
SRY
SRY
I
?
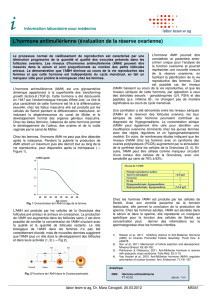
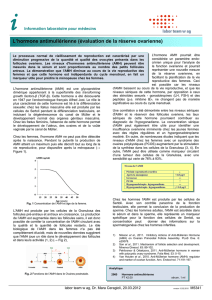
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%