Redondance fonctionnelle cachée de deux structures d`ARN viral

Journal Identification = VIR Article Identification = 0537 Date: December 10, 2013 Time: 1:35 pm
éditorial
Virologie 2013, 17 (6) :383-6
Redondance fonctionnelle cachée de deux
structures d’ARN viral non similaires révélées
grâce à la bioinformatique
Bruno Blondel
Florence Colbère-Garapin
Francis Delpeyroux
Institut Pasteur, Inserm U994, biologie
des virus entériques, 28, rue du
Docteur-Roux, 75724 Paris cedex 15,
France
<bruno.blondel@pasteur.fr>
Les éléments de séquences agissant en cis dans le génome des virus
à ARN jouent un rôle-clé au cours du cycle viral [1]. La fonction-
nalité de ces éléments dépend principalement pour certains de leur
séquence, et pour d’autres, de leur structure. Jusqu’à présent, les méthodes bio-
informatiques ont permis de prédire la présence de séquences ou de structures
importantes, parce que phylogénétiquement conservées ou favorisées d’un point
de vue thermodynamique. Afin de découvrir de nouvelles séquences fonction-
nelles dans le génome du poliovirus, Song et al. [2] dans le laboratoire d’Eckard
Wimmer (Stony Brook, États-Unis) ont développé une élégante stratégie basée
sur l’utilisation d’un logiciel bioinformatique permettant de programmer la syn-
thèse chimique de génomes viraux infectieux dont la séquence nucléotidique
est modifiée, tout en respectant la séquence des protéines codées, la fréquence
des codons synonymes, et celle des paires de codons adjacents, qui sont propres
à une espèce. Ce groupe avait montré précédemment qu’un poliovirus infec-
tieux pouvait être reconstitué in vitro après transcription d’un ADN génomique
complémentaire synthétisé chimiquement en absence de matrice et transfection
de l’ARN correspondant dans des cellules [3]. Grâce à leur approche bioinforma-
tique, Song et al. [2] ont identifié deux séquences fonctionnellement redondantes
dans la séquence codante du génome du poliovirus, l’une de ces séquences au
moins étant nécessaire à la réplication de l’ARN viral.
Le poliovirus est l’agent responsable de la poliomyélite paralytique aiguë [4].
Il appartient au genre Enterovirus (entérovirus humain de l’espèce C) et à la
famille des Picornaviridae. Cette famille représente l’un des plus grands groupes
de pathogènes humains et animaux. Elle comprend notamment les rhinovirus
humains (agents infectieux responsables du rhume) récemment reclassés dans
le genre Enterovirus, le virus humain de l’hépatite A et le virus de la fièvre
aphteuse.
Le poliovirus possède une capside de symétrie icosaédrique non enveloppée
d’environ 30 nm de diamètre, constituée de 60 copies de chacune des quatre
protéines structurales VP1, VP2, VP3 et VP4. Son génome est une molécule
d’ARN monocaténaire de polarité positive, d’environ 7 500 nucléotides (nt),
poly-adénylée à l’extrémité 3et dont l’extrémité 5est liée de fac¸on covalente à
une petite protéine virale (VPg) (figure 1). Cette molécule d’ARN comprend une
unique longue phase de lecture ouverte, codant les protéines de capside (région
P1) et les protéines non structurales (régions P2 et P3), encadrée par deux régions
non codantes (RNCs) en 5et en 3.
Suite à l’interaction du poliovirus avec son récepteur CD155, le génome viral
est libéré dans le cytoplasme de la cellule infectée et la traduction débute par
la fixation de la sous-unité 40S du ribosome au niveau d’un segment hautement
structuré, nommé IRES (internal ribosome entry site), localisé dans la RNC 5.
Le génome du poliovirus est traduit en une seule polyprotéine dont les clivages
protéolytiques successifs produisent les différentes protéines de capside et les
protéines non structurales impliquées notamment dans la réplication du génome
viral et les clivages de la polyprotéine.
Tirés à part : B. Blondel
doi:10.1684/vir.2013.0537
Virologie, Vol 17, n◦6, novembre-décembre 2013 383
Pour citer cet article : Blondel B, Colbère-Garapin F, Delpeyroux F. Redondance fonctionnelle cachée de deux structures d’ARN viral non similaires révélées grâce à la bioinformatique. Virologie
2013; 17(6) : 383-6 doi:10.1684/vir.2013.0537
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

Journal Identification = VIR Article Identification = 0537 Date: December 10, 2013 Time: 1:35 pm
éditorial
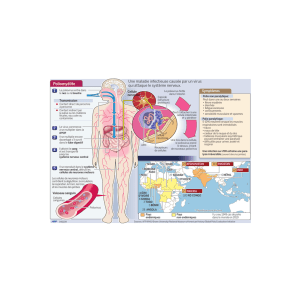
Organisation du génome du poliovirus
Protéines
de capside
P1
743
VP4
VPg
cre
cre
3B (VPg)
3386
3386 5599
5606
6995
7069
7220
7294
Condon
d´initiation
7369
5111 7369
7441
poly A
RNC 3´
RNC 5´
RNC 5´
IRES
IV
I
II III
VVI
VP2 VP3 VP1
Fragment A
Fragment B
Élément αÉlément β
Feuille de trèfle
αβ
2A 2B 2C 3A 3C 3D pol
3´
3´
5´ VPg
743
AUG
A
A
A
(n)
P2 P3
Protéines
non structurales
Figure 1. Localisation et prédiction de la structure des éléments fonctionnellement redondants ␣et dans la séquence codante du
génome du poliovirus (adaptée d’après Song et al. [2]). L’organisation du génome du poliovirus de type 1 est représentée. Deux régions
non codantes (RNC) en 5et 3encadrent une unique longue phase ouverte de lecture qui code pour une polyprotéine dont les clivages
protéolytiques successifs, assurés par les protéases virales 2A, 3C et 3CD, génèrent l’ensemble des protéines virales. La région P1 code les
protéines de capside et les régions P2 et P3 codent les protéines non structurales impliquées notamment dans les clivages protéolytiques
et la réplication du génome viral. Les positions des nucléotides (nt) délimitant les régions P1, P2 et P3 et les fragments A et B (voir texte)
sont indiquées. La protéine virale VPg (3B) est liée à l’extrémité 5-terminale du génome par une liaison covalente. L’extrémité 3-terminale
possède une queue de poly-A. Les séquences codant les protéines virales et les éléments ␣et sont indiquées ici. Un agrandissement
de la RNC 5montre six structures secondaires en tige-boucle notées I à VI. La structure I en feuille de trèfle correspond au site d’initiation
de la réplication du génome et les structures II à VI comprennent le site d’initiation interne de la traduction (IRES), en amont du codon
initiateur (AUG). La structure de l’élément «cre »dans la région codant la protéine 2C et les deux structures en épingle à cheveux de la
RNC 3impliquées dans la réplication du génome viral sont représentées. La structure secondaire théorique des éléments ␣et jouant un
rôle redondant dans la réplication du génome du poliovirus, est présentée. Les domaines actifs identifiés dans les éléments ␣et (48 et
37 nt respectivement) sont indiqués en trait gras.
384 Virologie, Vol 17, n◦6, novembre-décembre 2013
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

Journal Identification = VIR Article Identification = 0537 Date: December 10, 2013 Time: 1:35 pm
éditorial
La réplication du génome du poliovirus est assurée par
l’ARN polymérase virale ARN-dépendante 3D (3Dpol) en
association avec la plupart des protéines non structurales
et plusieurs facteurs cellulaires. Dans une première étape,
le génome viral sert de matrice pour la synthèse d’une
molécule d’ARN de polarité complémentaire (négative) et
dans un second temps, le brin négatif néosynthétisé sert
lui-même de matrice pour la synthèse de nombreuses molé-
cules d’ARN de polarité génomique (positive). Les RNCs
du génome du poliovirus jouent un rôle important dans
l’initiation de la synthèse des brins de polarités positive
et négative : la RNC 3possède deux structures en épingle
à cheveux et le poly(A) impliqués principalement dans la
synthèse des brins négatifs et la RNC 5comprend en amont
de l’IRES, une structure en feuille de trèfle suivie d’une
séquence riche en C, impliquée dans la synthèse des brins
positifs (figure 1). De plus, un élément nécessaire en cis àla
réplication (« cre », cis replication element) a été découvert,
par des analyses phylogénétiques et des méthodes bioinfor-
matiques, dans la région codant la protéine non structurale
2C de la région P2 [5]. Cet élément, nommé cre(2C), cor-
respond à une petite épingle à cheveux qui sert de matrice
pour l’uridylylation de la protéine terminale VPg par l’ARN
polymérase 3Dpol. Des séquences « cre » ont été retrouvées
dans tous les génomes des picornavirus, souvent dans des
endroits différents [1].
La nature dégénérée du code génétique permet d’avoir un
très grand nombre de séquences codantes pour une même
séquence polypeptidique. Cette très grande diversité est
cependant limitée dans les gènes naturels par deux biais : la
fréquence d’usage, pour un même acide aminé, des codons
synonymes et la fréquence d’usage des paires de codons
adjacents. En effet, les fréquences d’utilisation des codons
synonymes pour chaque acide aminé varient considérable-
ment entre les espèces et, éventuellement, même entre les
différents tissus de la même espèce. Par exemple, chez
l’homme, le codon GCC de l’alanine est utilisé quatre fois
plus fréquemment que le codon synonyme GCG. De même,
mais de manière indépendante, certaines paires de codons
synonymes adjacents sont utilisées plus ou moins fréquem-
ment par rapport à l’estimation tenant uniquement compte
du biais d’usage de chacun des codons pris séparément. Il
y a quelques années, Mueller et al. [6] et Coleman et al. [7]
ont montré que le recodage du génome du poliovirus en uti-
lisant des codons rares ou des paires de codons synonymes
adjacents peu fréquentes, tout en conservant les séquences
protéiques codées, réduisait l’efficacité de la traduction du
génome et atténuait le phénotype neurovirulent du virus
dans un modèle de souris exprimant le récepteur humain
du poliovirus. Burns et al. [8] ont obtenu concomitamment
des résultats similaires.
Dans le but d’identifier de nouvelles séquences ou struc-
tures fonctionnelles dans le génome du poliovirus, Song
et al. [2], les auteurs de l’article que nous mettons ici
en perspective, ont utilisé un programme bioinformatique
appelé « scrambled design » (SD). Ce programme introduit
dans une séquence codante, le maximum de substitutions
nucléotidiques tout en respectant la séquence des acides
aminés codés ainsi que, dans la mesure du possible, la fré-
quence de l’usage des codons synonymes, et celle des paires
de codons adjacents. Le SD permet de muter la majorité des
signaux dépassant 3 ou 4 nt.
Song et al. [2] ont tout d’abord confirmé que les substitu-
tions nucléotidiques par SD effectuées dans la région P1,
codant les protéines de capside du poliovirus, n’affectent
pas (ou très peu) la réplication virale [6, 7]. Ils ont ensuite
modifié les régions P2 et P3 par SD. Ces régions ont été
découpées en deux fragments (figure 1) recouvrant, d’une
part, la région P2 et l’extrémité 5de la P3 (fragment A)
et, d’autre part, le reste de la P3 codant notamment la
3Dpol (fragment B). Les fragments programmés par SD
ont été synthétisés chimiquement et utilisés pour remplacer
les séquences sauvages homologues. Les ARN transcrits in
vitro à partir de ces variants ont été transfectés dans des
cellules permissives.
Le virus ayant le fragment A modifié par SD s’est avéré non
viable. Ce résultat était attendu car cette région contient
l’élément cre(2C) (figure 1) impliqué dans la réplication de
l’ARN viral (voir ci-dessus). Cette expérience a donc servi
de contrôle d’efficacité de la stratégie SD. La réinsertion
d’un élément cre(2C) fonctionnel a permis de récupérer
un virus viable, démontrant que cet élément est le seul
élément essentiel pour la réplication dans cette région du
génome viral.
Lorsque le fragment B a été modifié par SD, le virus cor-
respondant s’est aussi avéré non viable, suggérant que ce
fragment comporte au moins un élément d’ARN fonction-
nel qui n’avait pas été mis en évidence jusqu’à présent.
Pour préciser la localisation de cet (ou ces) élément(s), les
auteurs ont divisé le fragment B en plusieurs segments et
construit une série de virus synthétiques, avec différentes
combinaisons dans lesquelles chaque segment était soit de
génotype SD soit de génotype sauvage. Les tests de viabi-
lité de ces virus ont tout d’abord suggéré que l’inactivation
de plus d’un segment est requise pour causer le défaut de
réplication mis en évidence avec les modifications par SD
du fragment B complet. La réduction progressive de la taille
des segments SD a ensuite permis l’identification de deux
éléments de 75 nt de long, nommés ␣et , séparés par
150 nt dans la séquence codant la polymérase virale 3Dpol
(figure 1). Les cellules infectées avec le virus possédant les
deux éléments ␣et de type SD ne présentent un effet
cytopathogène qu’après deux passages « en aveugle ». De
plus, ce virus forme des plages de lyse minuscules alors
que ceux ne possédant qu’un seul de ces éléments (␣ou
) de type SD se répliquent comme le virus non muté. Ce
Virologie, Vol 17, n◦6, novembre-décembre 2013 385
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

Journal Identification = VIR Article Identification = 0537 Date: December 10, 2013 Time: 1:35 pm
éditorial
résultat indique que les éléments ␣et ont des fonctions
similaires.
Song et al. [2] ont montré que les éléments ␣et sous
forme SD n’affectent ni la traduction ni la maturation pro-
téolytique de la polyprotéine. En revanche, un réplicon
exprimant la luciférase à la place des protéines de capside
et possédant les deux séquences ␣et de type SD est pra-
tiquement incapable de se répliquer, ce qui indique que ces
éléments jouent un rôle lors de la réplication virale. De
fac¸on surprenante, ces éléments fonctionnellement redon-
dants ne se ressemblent ni par leur séquence ni par leur
structure (figure 1). En effet, en utilisant un programme de
prédiction des structures secondaires de molécules d’ARN à
simple brin (programme MFold), les auteurs ont montré que
l’élément ␣de type sauvage forme une structure instable,
alors que l’élément forme une structure en « épingle à
cheveux » stable, entourée de séquences non structurées.
Les auteurs ont ensuite localisé les domaines actifs de ces
éléments (figure 1). Au sein de l’élément ␣, se trouve une
séquence de 48 nt, bien conservée chez les entérovirus
humains de l’espèce C. D’après l’étude fonctionnelle, ces
48 nt sont d’une importance primordiale pour la réplication.
Il est possible que cette séquence soit également importante
pour d’autres entérovirus que ceux de l’espèce C, même si
sa localisation est variable selon les virus, comme c’est le
cas pour l’élément « cre » [1]. Des études complémentaires
seront nécessaires pour tester cette hypothèse. Une épingle
à cheveux de 37 nt au sein de l’élément , est conservée
quant à elle dans tout le genre Enterovirus. La mutagenèse
de cette structure a confirmé son importance fonctionnelle.
Ces résultats, ainsi que le biais de la fréquence d’usage
des codons mentionnés plus haut, permettent de mieux
comprendre pourquoi des mutations silencieuses dans la
région codante du poliovirus peuvent être sélectionnées de
manière répétée [9].
Grâce à la méthode bioinformatique SD, Song et al. [2]
ont ainsi pu mettre en évidence et caractériser deux élé-
ments fonctionnels (␣et ) qui jouent des rôles redondants
dans la réplication du génome du poliovirus. Des éléments
fonctionnels ont été mis en évidence précédemment dans
la région codant la polymérase de virus à ARN positif, par
exemple dans celle (NS5B) du virus de l’hépatite C où deux
éléments ont été découverts [10, 11]. Cependant, ces élé-
ments ont des fonctions distinctes. Bien que le rôle exact
des éléments ␣et dans la réplication virale du poliovirus
reste à étudier, c’est la première fois que de tels éléments,
différents par leur séquence et leur structure, mais redon-
dants par leur fonction, sont mis en évidence dans le génome
d’un virus à ARN de polarité positive. Song et al. [2] font
l’hypothèse qu’une protéine virale ou cellulaire pourrait se
lier à chacun des deux éléments, et que l’interaction avec
un seul d’entre eux serait suffisante pour permettre la répli-
cation.
Ce travail montre l’importance des méthodes bioinforma-
tiques qui offrent notamment l’avantage, par rapport aux
techniques classiques de mutagenèse, d’obtenir un degré
élevé de modifications génomiques dans des régions ciblées
tout en respectant un ensemble de règles complexes liées
aux mécanismes de traduction. Comme cela est illustré ici,
ces méthodes permettent l’identification d’éléments struc-
turaux fonctionnels localisés dans les phases ouvertes de
lecture des génomes des virus à ARN. Elles pourraient éga-
lement, comme évoqué plus haut, permettre d’envisager de
renforcer la sécurité de certains vaccins vivants atténués en
rendant quasi-impossible leur réversion vers un phénotype
neurovirulent.
Remerciements. Nous remercions vivement Laurent
Blondel pour son aide précieuse dans la réalisation de la
figure qui illustre cet éditorial.
Liens d’intérêts : les auteurs déclarent n’avoir aucun lien
d’intérêt en rapport avec l’article.
Références
1. Liu Y, Wimmer E, Paul AV. Cis-acting RNA elements in human and
animal plus-strand RNA viruses. Biochim Biophys Acta 2009 ; 1789 : 495-
517.
2. Song Y, Liu Y, Ward CB, et al. Identification of two functionally
redundant RNA elements in the coding sequence of poliovirus using
computer-generated design. Proc Natl Acad Sci U S A 2012 ; 109 :
14301-7.
3. Cello J, Paul AV, Wimmer E. Chemical synthesis of poliovirus cDNA:
generation of infectious virus in the absence of natural template. Science
2002 ; 297 : 1016-8.
4. Blondel B, Autret A, Brisac C, et al. [Genetic evolution of poliovirus:
success and difficulties in the eradication of paralytic poliomyelitis]. Med
Trop 2008 ; 68 : 189-202.
5. Goodfellow I, Chaudhry Y, Richardson A, et al. Identification of a
cis-acting replication element within the poliovirus coding region. J Virol
2000 ; 74 : 4590-600.
6. Mueller S, Papamichail D, Coleman JR, Skiena S, Wimmer E. Reduc-
tion of the rate of poliovirus protein synthesis through large-scale codon
deoptimization causes attenuation of viral virulence by lowering specific
infectivity. J Virol 2006 ; 80 : 9687-96.
7. Coleman JR, Papamichail D, Skiena S, Futcher B, Wimmer E, Mueller
S. Virus attenuation by genome-scale changes in codon pair bias. Science
2008 ; 320 : 1784-7.
8. Burns CC, Shaw J, Campagnoli R, et al. Modulation of poliovirus repli-
cative fitness in HeLa cells by deoptimization of synonymous codon usage
in the capsid region. J Virol 2006 ; 80 : 3259-72.
9. Borzakian S, Pelletier I, Calvez V, Colbère-Garapin F. Precise missense
and silent point mutations are fixed in the genomes of poliovirus mutants
from persistently infected cells. J Virol 1993 ; 67 : 2914-7.
10. Friebe P, Boudet J, Simorre JP, Bartenschlager R. Kissing-loop inter-
action in the 3end of the hepatitis C virus genome essential for RNA
replication. J Virol 2005 ; 79 : 380-92.
11. Lee H, Shin H, Wimmer E, Paul AV. cis-acting RNA signals in the
NS5B C-terminal coding sequence of the hepatitis C virus genome. J Virol
2004 ; 78 : 10865-77.
386 Virologie, Vol 17, n◦6, novembre-décembre 2013
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.
1
/
4
100%