ZINC INJECTABLE A 1 mg/ml, solution injectable pour

CIS 6 248 674 4 M000/1000/003 1
ANNEXE I
RESUME DES CARACTERISTIQUES DU PRODUIT
1. DENOMINATION DU MEDICAMENT
ZINC INJECTABLE A 1 mg/ml, solution injectable pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Gluconate de zinc 3 H2O ........................................................................................................................779,6 mg
Pour 100 ml de solution
Un flacon de 10 ml correspondant à 10 mg de zinc-élément
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Solution injectable pour perfusion.
4. DONNEES CLINIQUES
4.1. Indications thérapeutiques
Soluté de supplémentation en nutrition parentérale prolongée et dans les situations ou une carence accentuée
doit être redoutée: dénutrition avancée, hypercatabolisme, fistules digestives, diarrhées chroniques...
La supplémentation doit couvrir les besoins de (3 à 4 mg/j chez l'adulte) et compenser des pertes
anormalement élevées (jusqu'à 15 mg/jour).
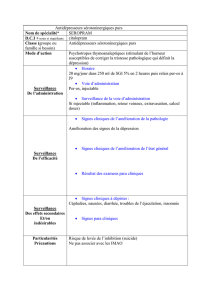
4.2. Posologie et mode d'administration
• 1 ml contient 1 mg de zinc élément
La posologie est à adapter à chaque cas en fonction des pertes et du status en zinc.
Le soluté est un soluté de supplémentation de l'alimentation parentérale à utiliser en mélange dans les solutés
de nutrition parentérale ou à diluer dans un soluté isotonique.
* Les apports usuels recommandés sont par voie intraveineuse
• en pédiatrie:
o prématuré: 0,3 à 0,35 mg/kg/jour
o nourrisson: 0,1 à 0,2 mg/kg/jour
o enfant: 5 mg/jour
• chez l'adulte: 3 à 15 mg/jour
4.3. Contre-indications
Hypersensibilité à l’un des constituants.
4.4. Mises en garde spéciales et précautions d'emploi
Mise en garde
Ce produit ne doit en aucun cas être injecté pur mais dilué dans une solution pour perfusion.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Dans le cadre d'une nutrition parentérale complexe, il y a lieu de prendre des précautions pour éviter des
incompatibilités entre les ajouts médicamenteux.

CIS 6 248 674 4 M000/1000/003 2
4.6. Grossesse et allaitement
Compte tenu des données disponibles, l’utilisation chez la femme enceinte ou qui allaite est possible.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Sans objet.
4.8. Effets indésirables
Les effets indésirables sont observés à fortes doses (voir rubrique 4.9).
4.9. Surdosage
Aucun cas n’a été rapporté avec ZINC INJECTABLE A 1 mg/ml, solution injectable pour perfusion.
Cependant, des cas de surdosage de zinc en intraveineux ont été rapportés, où les manifestations d’une
toxicité aigue incluent une transpiration profuse, vision floue, conscience diminuée, hypothermie, tachycardie,
jaunisse et œdème pulmonaire. Une hyperamylésémie peut être un signe d’un possible surdosage en zinc.
Une supplémentation en calcium pourra conférer un effet protecteur.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : AUTRES SUPPLEMENTS MINERAUX, Code ATC A12CB02.
Le zinc est un constituant essentiel d'au moins 120 métalloenzymes parmi lesquelles l'anhydrase carbonique,
les phosphatases alcalines, la carboxypeptidase, les oxydoréductases, les transférases, les ligases, les
hydrolases, les isomérases, l'alcool déshydrogénase.
Il a également, un rôle important dans la synthèse des acides nucléiques ARN et ADN et dans la régulation du
catabolisme de l'ARN.
Il joue aussi un rôle dans la transformation des lymphocytes T et aurait un rôle dans la synthèse de l'insuline.
Ainsi, le zinc participe-t-il au métabolisme des glucides, des lipides, des protéines.
Il a ainsi un rôle indispensable dans la croissance du prématuré, du nourrisson et de l'enfant.
5.2. Propriétés pharmacocinétiques
Non renseigné.
5.3. Données de sécurité préclinique
Non renseigné.
6. DONNEES PHARMACEUTIQUES
6.1. Liste des excipients
Eau pour préparation injectable.
6.2. Incompatibilités
En l’absence d’études de compatibilité, ce médicament ne doit pas être mélangé avec d’autres médicaments.
6.3. Durée de conservation
2 ans
Après ouverture et/ou dilution et/ou reconstitution : le produit doit être utilisé immédiatement.

CIS 6 248 674 4 M000/1000/003 3
6.4. Précautions particulières de conservation
Pas de précautions particulières de conservation.
6.5. Nature et contenu de l'emballage extérieur
Flacon en verre de 10 ml ; boite de 10 flacons.
6.6. Précautions particulières d’élimination et de manipulation
Pas d’exigences particulières.
Tout produit non utilisé ou déchet doit être éliminé conformément à la règlementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
LABORATOIRE AGUETTANT
1, rue Alexander Fleming
69007 Lyon Cedex
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
• 333 414-4:10 ml en flacon (verre), boîte de 10.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter par le titulaire]
11. DOSIMETRIE
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
CONDITIONS DE PRESCRIPTION ET DE DELIVRANCE
Médicament non soumis à prescription médicale.

CIS 6 248 674 4 M000/1000/003 5
ANNEXE IIIA
ETIQUETAGE
MENTIONS DEVANT FIGURER SUR L’EMBALLAGE EXTERIEUR ET SUR LE
CONDITIONNEMENT PRIMAIRE
NATURE/TYPE Emballage extérieur ou Conditionnement primaire
Emballage extérieur.
1. DENOMINATION DU MEDICAMENT
ZINC INJECTABLE A 1 mg/ml, solution injectable pour perfusion
2. COMPOSITION EN SUBSTANCES ACTIVES
Gluconate de zinc 3 H2O ........................................................................................................................779,6 mg
Pour 100 ml de solution
Un flacon de 10 ml - correspondant à 10 mg de zinc-élément
3. LISTE DES EXCIPIENTS
Eau pour préparation injectable.
4. FORME PHARMACEUTIQUE ET CONTENU
Solution injectable pour perfusion ; flacon de 10 ml.
Boite de 10 flacons.
5. MODE ET VOIE(S) D’ADMINISTRATION
Perfusion
Lire la notice avant utilisation.
6. MISE EN GARDE SPECIALE INDIQUANT QUE LE MEDICAMENT DOIT ETRE CONSERVE
HORS DE LA PORTEE ET DE LA VUE DES ENFANTS
Tenir hors de la portée et de la vue des enfants.
7. AUTRE(S) MISE(S) EN GARDE SPECIALE(S), SI NECESSAIRE
Ce médicament ne doit en aucun cas être injecté pur mais dilué dans une solution pour perfusion.
8. DATE DE PEREMPTION
EXP {MM/AAAA}
Après ouverture et/ou dilution et/ou reconstitution : le produit doit être utilisé immédiatement.
9. PRECAUTIONS PARTICULIERES DE CONSERVATION
Sans objet.

CIS 6 248 674 4 M000/1000/003 6
10. PRECAUTIONS PARTICULIERES D’ELIMINATION DES MEDICAMENTS NON UTILISES OU
DES DECHETS PROVENANT DE CES MEDICAMENTS S’IL Y A LIEU
Sans objet.
11. NOM ET ADRESSE DU TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
Titulaire
LABORATOIRE AGUETTANT
1, rue Alexander Fleming
69007 Lyon Cedex
Exploitant
LABORATOIRE AGUETTANT
1, rue Alexander Fleming
69007 Lyon Cedex
Fabricant
Sans objet.
12. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
Médicament autorisé N° :
13. NUMERO DE LOT
Lot {numéro}
14. CONDITIONS DE PRESCRIPTION ET DE DELIVRANCE
Médicament non soumis à prescription médicale.
15. INDICATIONS D’UTILISATION
Ce médicament est un soluté de supplémentation en nutrition parentérale et dans les situations où une carence
accentuée doit être redoutée: dénutrition avancée, hypercatabolisme, fistules digestives, diarrhées
chroniques...).
La supplémentation doit couvrir les besoins et compenser des pertes anormalement élevées.
16. INFORMATIONS EN BRAILLE
Conformément à la réglementation en vigueur.
PICTOGRAMME DEVANT FIGURER SUR L’EMBALLAGE EXTERIEUR OU, EN L’ABSENCE
D’EMBALLAGE EXTERIEUR, SUR LE CONDITIONNEMENT PRIMAIRE
Sans objet.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%