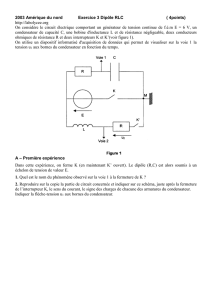
PROGRAMME DE COLLES N°12 Cours :

Programme de colles n°12 09/01 au 13/01
PROGRAMME DE COLLES N°12
Cours :
CTM2 : Evolution temporelle en réacteur fermé
I Définition de la vitesse d’une réaction chimique en système homogène
1. Vitesse de réaction
a. Définition / b. Cas d’un système isochore / c. Détermination graphique
2. Vitesses de formation ou de disparition d’une espèce chimique
II Quelques facteurs influençant la cinétique de réaction
1. Le facteur concentration
a. Ordre d’une réaction / b. Loi de Van’t Hoff
2. Le facteur température
a. Loi d’Arrhénius / b. Applications
III Etudier « théoriquement » la cinétique d’une réaction : cas simples
1. Méthode générale
2. Réactions d’ordre 0
3. Réactions d’ordre 1
4. Réactions d’ordre 2
IV Etudier expérimentalement la cinétique d’une réaction
1. Méthode différentielle
2. Méthode intégrale
3. Méthode des temps dse demi-réaction
4. Dégénérescence de l’ordre
CAM5 : Forces intermoléculaires
I Interactions de Van der Waals
1. Observations expérimentales
2. Nature des forces de Van der Waals
a. Interaction de Keesom : dipôle permanent – dipôle permanent / b. Interaction de Debye : dipôle permanent – dipôle induit / c. Interaction
de London : dipôle induit – dipôle induit / d. Bilan
3. Conséquences sur les propriétés physico-chimiques
II La liaison hydrogène (LH)
1. Mise en évidence
2. Description de la liaison hydrogène
3. Conséquences sur les propriétés physico-chimiques
a. Liaisons hydrogène intermoléculaires / b. Liaisons hydrogène intramoléculaire
III Solvants
1. Principes élémentaires
2. Classification des solvants
a. Polarité / b. Pouvoir dispersant / c. Proticité / d. Exemples de solvants
3. Extraction liquide-liquide
4. Solvant et chimie verte
IV Analyse documentaire

PSBT2 : Introduction à l’électrocinétique
I Charges électriques
1. Notion de charge
2. Porteurs de charges
II Grandeurs électriques
1. Intensité du courant
2. Tension électrique
a. Définitions / b. Conducteur parfait / c. Masse
III Lois générales de l’électrocinétique
1. Définitions
2. Approximation des régimes quasi-stationnaires (ARQS)
3. Lois de Kirchhoff
a. Loi des nœuds / b. Loi des mailles
4. Puissance électrique
a. Définitions / b. Conventions récepteur et générateur
PSBT3 : Circuits linéaires en régime continu
I Dipôles linéaires
1. Définition
2. Dipôles actifs/passifs
3. Rappels
II Exemples de dipôles linéaires
1. Résistor
1. Relation tension/intensité : Loi d’Ohm / 2. Association de résistances / 3. Puissance dissipée
2. Générateur
1. Sources idéales / 2. Générateurs réels / 3. Equivalences entre les deux modèles
III Etudes de circuit
1. Notion de point de fonctionnement
2. Utilisation des modèles de Thévenin et Norton
a. Recherche d’un courant : méthode des mailles / b. Recherche d’une tension: méthode des nœuds / c. Utilisation de générateurs équivalents
3. Utilisation des ponts diviseurs
a. Pont diviseur de tension / b. Pont diviseur de courant
PSBT4 : Circuits RC en régime transitoire
I Le condensateur
1. Présentation
2. Energie emmagasinée
3. Association de condensateurs
a. En série / b. En parallèle
II Circuit RC Série
1. Equation différentielle du circuit pour la charge
2. Equation différentielle pour la décharge du condensateur
3. Aspect énergétique
a. Charge du condensateur / b. Décharge du condensateur
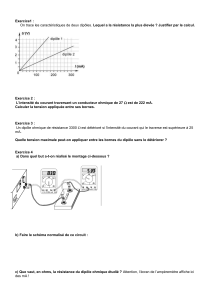
Exercices :
CTM2 : Evolution temporelle en réacteur fermé
CAM5 : Forces intermoléculaires
PSBT2 : Introdution à l’électrocinétique
PSBT3 : Circuits linéaires en régime continu
1
/
2
100%