L`étude qualitative de l`état d`équilibre

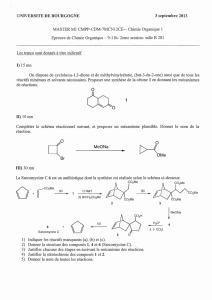
Notre planète est un immense système qui tend
constamment vers l’équilibre. Qu’est-ce que l’équilibre ?
Quelles sont les conditions pour atteindre l’équilibre ?
Quels facteurs peuvent le perturber ?
■
L’étude qualitative
de l’état
d’équilibre
295
7
CHAPITRE
7.1
Le smog, un brouillard
épais formé de
particules de suie
et de gouttes d’eau,
recouvre parfois
le centre-ville
de Montréal.
11120_cyr_ch_07-p293-304_Layout 1 2013-06-05 10:18 Page295

D
© ERPI Reproduction interdite
296
PARTIE IV
❙
L’ÉQUILIBRE CHIMIQUE
❙
THÉORIE
Dans ce chapitre, nous ferons l’étude qualitative de l’état d’équilibre et des fac-
teurs qui l’influencent. Cela nous permettra de prévoir l’évolution des systèmes
dont les conditions ont été modifiées.
Jusqu’à maintenant, nous avons vu que des transformations peuvent se réaliser
dans les deux sens.
●Si on interprète l’équation de gauche à droite:
H2O(l) ➞H2O(g) Réaction directe: vaporisation
●Si on interprète l’équation de droite à gauche:
H2O(l) ➞H2O(g) Réaction inverse: condensation
La synthèse et la décomposition, la respiration et la photosynthèse sont d’autres
exemples de transformations qui s’effectuent dans les deux sens.
De plus, nous n’avons considéré que des réactions complètes, selon des propor-
tions définies.
7.1
Qu’est-ce que l’équilibre
chimique ?
CONCEPT DÉJÀ VU
oTransformations
physiques et
chimiques
LABO
23. L’OBSERVATION D’UN ÉTAT
D’ÉQUILIBRE
DÉFINITION
Une réaction complète survient lorsque au moins un des réactifs d’une trans-
formation s’est complètement transformé en produits.
Toutefois, malgré la présence de réactifs en quantité suffisante et de conditions
favorables, de nombreuses transformations ne parviennent pas à se réaliser com-
plètement. Les réactifs coexistent alors avec les produits d’une même transforma-
tion; il s’agit d’une réaction incomplète. Par exemple,
l’eau d’un lac ne gèle pas complètement en hiver, même
si la température du milieu environnant descend sous
le point de congélation. Le calcaire (CaCO3), qui
forme les roches sédimentaires et qu’on trouve dis-
sous dans les cours d’eau, ne précipite pas complète-
ment, même s’il s’agit d’un sel peu soluble.
Pourquoi ces réactions sont-elles in-
complètes ? C’est que des réactifs se
transforment en produits, tandis
qu’au même moment des produits se
transforment en réactifs. Ces réac-
tions s’effectuent dans les deux sens
en même temps. On dit que ce sont
des réactions réversibles: la réaction
directe et la réaction inverse se pro-
duisent simultanément. En théorie,
dans des conditions favorables, toute
réaction est réversible. En pratique,
certaines le sont plus facilement que
d’autres.
ÉTYMOLOGIE
«Sédiment» vient du mot
latin sedimentum, qui si-
gnifie «tassement, fond»,
et du verbe italien sedere,
«être assis, séjourner,
demeurer fixé».
7.2
Malgré des températures hivernales, l’eau de ce lac n’est pas complètement
gelée.
➞
11120_cyr_ch_07-p293-304_Layout 1 2013-06-05 10:18 Page296

© ERPI Reproduction interdite
CHIMIE
■
CHAPITRE
7
CHAPITRE 7
❙
L’ÉTUDE QUALITATIVE DE L’ÉTAT D’ÉQUILIBRE
❙
THÉORIE
297
DÉFINITION
Une réaction réversible survient lorsque, au même moment et au même endroit,
les réactifs se transforment en produits et les produits se transforment en réactifs.
7.4
Trois ballons reliés
à un manomètre.
Note: À 25 °C, l’augmentation de pression équivaudrait à 3,2 kPa (voir le chapitre 2),
soit la pression de vapeur de l’eau.
Pour représenter une réaction réversible, on utilise deux demi-flèches pointant en
sens opposés, superposées l’une à l’autre, comme ceci:
Réactifs Produits
En guise d’exemple, prenons la réaction réversible de la dissolution et de la préci -
pi tation du carbonate de calcium, qui se traduit par l’équation suivante:
CaCO3(s) Ca2+(aq) + CO32-(aq)
Le carbonate de calcium, un électrolyte, est notam-
ment sécrété par les coraux. Il s’ionise dans l’eau, for-
mant des ions Ca2+, dont la présence est caractéris-
tique de l’eau dure et contribue à la salinité de l’eau de
mer. Comme il s’agit d’un sel peu soluble, il précipite.
C’est ce précipité qui forme les structures spectacu-
laires des récifs coralliens.
Illustrons de nouveau le phénomène de réaction réver -
sible, cette fois à partir d’une manipulation faite en
labo ratoire.
●On met de l’eau dans un contenant, qu’on ferme.
Le contenant ne contient alors que de l’eau sous
forme liquide et une certaine quantité d’air (voir la
FIGURE 7.4
).
●De la vapeur d’eau se forme peu à peu à la surface du liquide: c’est le début de
l’évaporation. La pression augmente alors graduellement en fonction du nom-
bre de molécules de gaz formées.
●La pression partielle du gaz finit par égaler la pression de la vapeur d’eau asso-
ciée à la température du système. À cette étape, il n’y a plus de changements
apparents: le volume d’eau, la pression, la température sont constants.
7.3
La dissolution et la précipitation du carbonate de calcium
est caractéristique des récifs coralliens.
ANIMATION
Phase liquide Phases liquide
et gazeuse Équilibre des phases
liquide et gazeuse
25 °C 25 °C 25 °C
H2O(l) H2O(l)
H2O(g) H2O(g)
H2O(l)
11120_cyr_ch_07-p293-304_Layout 1 2013-06-05 10:18 Page297

© ERPI Reproduction interdite
298
PARTIE IV
❙
L’ÉQUILIBRE CHIMIQUE
❙
THÉORIE
DÉFINITION
L’équilibre est un état dans lequel la vitesse de la réaction directe (vdir) est
égale à la vitesse de la réaction inverse (vinv).
vdir = vinv
L’équilibre a un caractère dynamique puisqu’il y
a un échange perpétuel entre les réactifs et les
produits. C’est pour cette raison qu’on parle
souvent d’«équilibre dynamique», par opposi-
tion à «équilibre statique», où il n’y a pas
d’échange possible.
ÉTYMOLOGIE
«Équilibre» vient du latin
æquilibrium, qui signifie «exacti-
tude des balances».
7.5
Comme la bouteille ne
contient qu’une
substance en phase
liquide, il s’agit d’un
exemple d’équilibre
statique.
7.6
L’échange perpétuel
entre un liquide et sa
vapeur est un exemple
d’équilibre dynamique.
Le système d’emprunt de livres dans une bibliothèque est une
ana logie qui illustre bien ce qu’est un état d’équilibre. Si le
nombre d’emprunts est égal au nombre de retours, la quan tité
de livres à la bibliothèque demeure constante. On dit alors que
le système formé par la bibliothèque est à l’équilibre. De plus, il
s’agit d’un équilibre dynamique puisque ce ne sont pas toujours
les mêmes livres qu’on trouve sur les rayons de la bibliothèque.
L’équilibre peut être physique ou chimique. Il est physique lors -
qu’il est associé à une transformation physique, par exemple
l’équi libre entre un liquide et sa vapeur. Il est chimique lorsqu’il
est associé à une transformation chimique. Par exemple, la syn-
thèse du HI:
7.7
L’emprunt et le retour des livres dans une
bibliothèque illustrent bien l’état d’équilibre.
H2(g)
Incolore
+I
2(g)
Violet
2 HI(g)
Incolore
À vue d’œil, aucune transformation ne semble avoir lieu. Dans les faits, il y a une
transformation perpétuelle entre les molécules d’eau liquide et la vapeur d’eau.
Comme les quantités de molécules de chaque phase ne varient pas, on peut sup-
poser que la vitesse d’évaporation de l’eau est égale à la vitesse de condensation
de la vapeur. On dit alors qu’il y a un équilibre entre l’eau dans sa phase liquide et
l’eau dans sa phase gazeuse.
11120_cyr_ch_07-p293-304_Layout 1 2013-06-05 10:18 Page298

© ERPI Reproduction interdite
CHIMIE
■
CHAPITRE
7
CHAPITRE 7
❙
L’ÉTUDE QUALITATIVE DE L’ÉTAT D’ÉQUILIBRE
❙
THÉORIE
299
Si on effectue cette transformation dans un milieu
clos, on peut suivre la progression de la réaction par
la disparition de la couleur violette, caractéristique
du diiode gazeux. Après un certain temps, la cou -
leur se stabilise: son intensité ne change plus. On en
déduit que les réactifs ne se sont pas complètement
transformés en produits.
Cette observation est confirmée par l’analyse de la
FIGURE 7.8
. Ainsi, à partir du temps te, il n’y a plus de
changements apparents: les concentrations des
réac tifs et des produits demeurent constantes. La
réaction semble complètement arrêtée. Toutefois,
grâce à nos connaissances des transformations de la
matière, nous savons que ce n’est pas le cas: le sys-
tème a simplement atteint l’équilibre. La vitesse de
la synthèse de l’iodure d’hydrogène est alors égale à
la vitesse de sa décomposition.
Les conditions nécessaires
pour atteindre l’équilibre
Comme l’équilibre n’est pas visible, il importe d’établir des critères pour le recon-
naître. Ainsi, pour atteindre l’équilibre, un système doit respecter trois conditions:
1. Contenir une réaction réversible.
2. S’effectuer dans un système fermé.
3. Présenter des propriétés macroscopiques constantes.
Voyons plus en détail ce qu’implique chacune des conditions.
1. CONTENIR UNE RÉACTION RÉVERSIBLE
Une réaction réversible s’effectue dans les deux sens. Elle implique la présence, au
même moment et au même endroit, de tous les réactifs et de tous les produits
d’une même transformation. S’il manque un réactif ou un produit, la réaction est
irréversible. Voici des exemples où la réaction est irréversible:
●Si un ou plusieurs réactifs sont complètement transformés en produits, c’est-
à-dire qu’il y a eu réaction complète.
●S’il y a perte d’un produit dans le milieu environnant. Cette condition est
intimement liée au système dans lequel la transformation s’effectue: système
ouvert ou fermé (condition 2).
2. S’EFFECTUER DANS UN SYSTÈME FERMÉ
Qu’est-ce qu’un système fermé ? Voyons d’abord ce qu’est un système ouvert
(voir aussi le chapitre 5). Pre nons l’exemple d’une bouteille d’eau. Si la bouteille est
ouverte, la vapeur résul tant de l’évaporation de l’eau s’échappera du contenant.
La bouteille cons titue alors un système ouvert pour cette transformation.
7.8
LES VARIATIONS DE CONCENTRATION
DE H2, DE I2ET DE HI EN FONCTION
DU TEMPS
Concentration (mol/L)
Temps (s)
te
[H2] = [I2]
[HI]
DÉFINITION
Un système ouvert est un système réactionnel qui permet un échange de
matière, un gain ou une perte, avec le milieu environnant.
11120_cyr_ch_07-p293-304_Layout 1 2013-06-05 10:18 Page299
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
1
/
38
100%