Cours cytosquelette

Biocell : cytosquelette 2010 Page 1
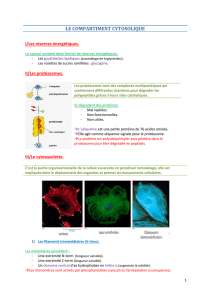
BIOCELL : LE CYTOSQUELLETTE
Le cytosquelette est la charpente de la cellule qui la maintient en place. Il est dynamique (en perpétuel
organisation/désorganisation) et permet, en plus du maintien cellulaire, le déplacement des organites
rapide grâce à la coordination entre la protrusion de la membrane et la translocation du corps
cellulaire.
L’organisation et la dynamique des filaments sont régulés par des protéines qui leur sont associées.
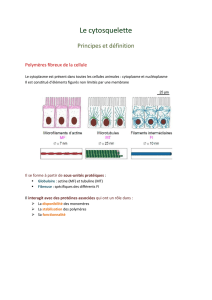
Microfilaments d’actine :
Rôles :
- Contraction musculaire
- Adhésion cellulaire
- Modification de la forme des cellules : rigidité et souplesse des érythrocytes (= globules
rouges), microvillosités (augmentation de la surface d’échange), formation de filopodes…
- Mobilité cellulaire : au cours du développement pour la mise en place mais également en cas
de réponse immunitaire ou pour transporter des organites + déplacements des bactéries
intracellulaires.
- Intervient dans la formation du fuseau mitotique (division cellulaire)
Composés de 2 brins de monomères globulaires d’actine qui s’assemblent en hélice, diamètre 7nm.
Représente 5 à 20% du contenu protéique cellulaire.
L’actine G (globulaire) porte un ATP ou un ADP dans son sillon.
La polymérisation du filament n’a pas besoin d’apport d’énergie, mais elle est plus rapide à
l’extrémité + qu’{ l’extrémité –
Organisation en faisceaux (= fibres de stress) ou en réseaux grâce à des protéines associées.
Filaments intermédiaires :
Rôles :
- Support mécanique : forces, résistances des cellules exposées aux contraintes (ex : épithéliales)
- Protection l’ADN dans le noyau
- Cohésion entre cellules ou au niveau des tissus (jonctions, contacts avec la matrice).
- Architecture de la cellule (lamines nucléaires, desmines et kératines interviennent aussi dans la
cyto-architecture)
- Migration cellulaire : disposition en « cage » (résistance aux stress mécaniques) ou périnucléaire
(assouplissement du cytoplasme pour permettre la pliabilité de la cellule et son extravasation)
(ex : vimentine intervient dans la migration des lymphocytes).
- Modulation des voies de signalisation : liaison à des récepteurs membranaires ou à des protéines
adaptatrices pour réguler la transmission du signal (extint)
Forment des câbles qui ne sont pas polarisés, de diamètre de 8 à 12 nm
Présents dans le cytosol et dans le nucleoplasme (doublent l’enveloppe nucléaire et la stabilisent)
Microtubules (MT) :
Rôles :
- Motilité des cils et des flagelles
- Fuseau mitotique en cas de division cellulaire
- Transport des organites.
Association des hétérodimères en protofilament 13 protofilaments tube creux polarisé
Le pôle (-) se trouve au centre initiateur du microtubule, le MTOC appelé centrosome, et le (+) est
l’extrémité grandissante allant vers la membrane plasmique.
Hétérodimères de tubulines α et β qui porte une molécule de GTP ou GDP par sous-unité (jamais
hydrolysé sur la sous-unité α) indispensable pour un filament fonctionnel.

Biocell : cytosquelette 2010 Page 2
Polymérisation plus lente que dépolymérisation (à cause du GTPGDP). En plus de la ligation au
GTP, il faut que la concentration en tubuline soit donc bonne : au-delàs de la concentration critique
Cc, il y a polymérisation, en-dessous il y a dépolymérisation.
Les MT peuvent être stables, mais aussi éphémères, de même que parfois, ils ne sont pas reliés au
MTOC : ce sont des MT non-centrosomaux comme les dendrites neuronaux. C’est un type de MT
servant au transport de protéines motrices par treadmilling (décroissance côté (-) et croissance
côté (+), causant un déplacement). Majoritairement, ils sont associes en réseaux.
I. Les protéines associées aux microtubules : les MAPs
Les MAPs s’associent latéralement la paroi des MT et leur confèrent des propriétés particulières
(physico-chimiques, biologiques) et les guident vers des localisations cellulaires spécifiques.
Elles possèdent 2 domaines :
- Un domaine basique de fixation aux MT
- Un domaine acide, en sailli sur la paroi des MT qui se lie soit aux membranes, soit aux filaments
intermédiaires, aux microfilaments d’actine ou { d’autres MT et qui permet e régler la distance
entre les MT.
Les MAPs structurales
- Organisation et modelage des réseaux de MT (MAPs d’assemblage)
- Régulation de la polymérisation et stabilité des MT (MAPs stabilisantes/déstabilisantes)
Les MAPS motrices
- Déplacement des organites cellulaires
- Régulation de l’instabilité des MT
1) Les MAPs structurales
Les MAPs d’assemblage
- De type 1A, 1B, 1S :
Longues protéines filamenteuses,
flexibles et structurellement très
proches (à la différence de 1A, le type
1B possède une tête globulaire),
stabilisent les microtubules dans les
neurones (1A et 1B) et d’autres types
cellulaires (1S).
(Sur l’image, M= site de liaison aux MT)
- De types 2, 4 ou τ:
Même séquence de 18 A.A. répétées 3 ou 4 fois
dans leur domaine de liaison au microtubule.
MAP 2 : dans les dendrites, faisant des ponts
entre MT et filaments intermédiaires.
MAP 4 : dans les cellules non-neuronales,
associées aux MT pendant l’interphase et la
mitose.
τ : dans les axones/dendrites, accélérant la polymérisation et organisant les microtubules en
épais faisceaux stables.
Les MAPs qui se fixent latéralement sur les MT sont stabilisantes.

Biocell : cytosquelette 2010 Page 3
Elles inhibent la dépolymérisation : empêchent les protomères de tubuline de quitter le centre et les
extrémités des MT, tau accélère la polymérisation dans les cônes de croissance des neurones et les
MAPs de type 2 rajoutées à une solution de tubuline accélèrent la nucléation (=formation du noyau).
Les substances chimiques qui affectent les MT
Les voies de signalisation
C’est une phosphorylation/déphosphorylation qui régule la fixation des MAPs aux microtubules.
La forme des MAPS liée aux MTs est déphosphorylée. Kinases impliqués :
- MAP Kinase (prot activée par des mitogènes)
- MARKs Kinase (in vitro MARK augmente l’instabilité dynamique des MT tau phosphorylé par
MARK en présence d’ATP se dissocie des MT entrainant leur dépolymérisation)
- Cdc2 Kinase
La phosphorylation entraine le détachement des MAPs et la déstabilisation des microtubules et donc
leur raccourcissement.
Ex dans la maladie d’Alzheimer : tau est hyperphosphorylé et entraines la dégénérescence des
neurofibrilles.
Les protéines de séquestration
La stathmine (op18) stabilise les tubulines sous forme
d’hétérodimères, (en se liant à eux) inhibant leur
polymérisation en MT et stimulant les phénomènes de
catastrophe. Régulation par phosphorylation (inactive) et
déphosphorylation (active). Elle est surexprimée dans les
cellules en prolifération et cancéreuses.
Elle a un rôle important pendant la mitose : elle est active en
prophase, se désactive par phosphorylation au début de la
prophase puis se réactive à la fin de la cytodirèse.

Biocell : cytosquelette 2010 Page 4
Les protéines de coiffe
A l’extrémité (-) :
- La tubuline γ permet la nucléation des MT en croissance et l’ancrage des MT au niveau du MTOC
selon 2 modèles possibles :
Template model : la tubuline γ s’associe latéralement pour former un anneau
protéique.
Protofilament model : la tubuline γ s’associe longitudinalement en protofilaments
prolonge par les dimères d’α et β (le tube est ainsi referme).
Elle affecterait aussi la dynamique des MT { l’extrémité (+) par des mécanismes mal connus.
- La catastrophine (centrosome)
A l’extrémité (+) :
- La catastrophine (kinétochore) : déstabilisatrice des MTdépolymérisation. Ce sont des
dépolymérases membres de la famille des kinésines, induisent des catastrophes en déparant les
protofilaments.
- (+) Tip : stabilisateurs des MT (régissent les forces appliquées au MT), régulent différents
aspects de l’architecture cellulaire en interagissant avec les facteurs de signalisationassurent
un lien avec des structures cellulaires (cortex cellulaire, kinétochore, vésicules d’endocytose…)
Clip : lient les vésicules d’endocytose, participent au trafic vésiculaire, { la formation
de faisceaux, régulent la localisation des dynéines/dynactines. Clip 115 : très
présente dans les dendrites des neurones.
Clasp : stabilise les MT et intervient dans leur dynamique en interagissant avec les
Clip.
APC : à proximité de la membrane plasmique des cellules en migration, stabilise les
MT et intervient dans la formation des faisceaux. Présente dans les cônes de
croissance des neurones.
EB1 : interagit avec APC, intervient dans la pousse neuritique.
Les protéines de fragmentation
- La Katanine casse les MT, les libère de leurs attaches sur le MTOC, rôle crucial dans la
dépolymérisation rapide des MT au pôle du fuseau mitotique au cours de la mitose mais aussi
dans les neurones. Nécessite de l’ATP.
- La protéine STOP dans le système nerveux : confère une résistance à la dépolymérisation (inhibe
la dynamique, stabilise les MT), au froid et au nocodazole, permet l’initiation de la pousse
neuritique. Lorsqu’elle est phosphorylée, elle se détache des MT et va s’associer { l’actine et aux
protéines synaptiques mais elle est pratiquement tout le temps associée aux MT, leur conférant
leur grande stabilité.
2) Les MAPs motrices
Fonctions des moteurs moléculaires :
- Transport des vésicules de sécrétion, d’endocytose et entre le RE et Golgi
- Tri et adressage des protéines dans les cellules polarisées
- Mouvements et organisation spatiale des organites
- Transport viral
- Mise en place du fuseau mitotique
- Battements des cils et flagelles

Biocell : cytosquelette 2010 Page 5
2 types :
- La Kinésine : transporte des vésicules du
corps cellulaire vers la terminaison
nerveuse de l’axone qui correspond {
l’extrémité (+) des MT (identifiée dans
l’axone géant de calmar).
- La Dynéine : assure le transport en sens inverse, vers l’extrémité (-)
des MT. Elle est associée à un complexe multiprotéique de dynactine
comprenant un filament d’Arp1 apparenté { l’actine.
Fonctionnement :
La fixation d’ATP sur la tête antérieure (1) tire la tête postérieure (2) vers
l’avant de 8nm. La libération d’ADP de la tête (2) et l’hydrolyse d’ATP de la
tête (1) remettent les têtes dans la même position.
Mise en place de l’appareil de Golgi
Une des principales fonctions des moteurs moléculaires dans les cellules en interphase est de
transporter et placer les organites entourés d’une membrane.
Le remodelage du réseau de MT pendant la mitose induit un remodelage de l’appareil de Golgi. La
dépolymérisation des MT par le nocodazole entraine une fragmentation de l’appareil de Golgi.
L’altération des protéines motrices altère la morphologie de l’appareil de Golgi. Si on laisse les MT se
reformer, les mini-citernes se déplacent vers le MTOC et fusionnent pour reformer le Golgi.
Dynéine associée au Cis-Golgi et Golgi médian : maintien à proximité du MTOC.
Kinésine associée au trans-Golgi : transport vers la membrane plasmique.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%