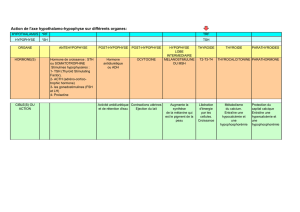
Rôle de l`endothélium vasculaire dans l`hypothalamus

247
Métabolismes Hormones Diabètes et Nutrition (XI), n° 6, novembre-décembre 2007
Dossier
thématique
P
our exercer les fonctions les
plus variées et complexes, les
organismes supérieurs requiè-
rent un système de contrôle central.
Ce rôle de chef d’orchestre ou de
coordinateur de l’activité des diffé-
rents tissus et organes est l’apanage
du système nerveux central. Pour
l’exercer, le cerveau dispose de deux
moyens : des signaux électriques
véhiculés directement vers les sites
d’action par l’intermédiaire de nerfs,
et des messages chimiques (hormo-
nes) distribués par le courant san-
guin. Tous les tissus de l’organisme
sont en communication constante
entre eux et avec le système nerveux
central par l’intermédiaire de la cir-
culation générale.
L’hypothalamus, à la base du
cerveau (figure 1), contient des
neurones responsables de la sécré-
tion d’hormones peptidiques, ou
neuro-hormones. On distingue à ce
niveau deux systèmes neurosécré-
toires. L’un est constitué par des
neurones sécrétant la vasopressine
et l’ocytocine, deux peptides actifs
respectivement au niveau des reins
et de la glande mammaire, essentiel-
lement. L’autre, plus complexe, est à
destinée antéhypophysaire. Dans ce
cas, le cerveau n’envoie pas direc-
tement ses messages aux organes
périphériques, mais il se sert de l’an-
téhypophyse comme amplificateur.
Les six hormones principales sécré-
tées par l’adénohypophyse sous la
direction de l’hypothalamus hypo-
physiotrope sont l’hormone de crois-
sance (GH), l’hormone corticotrope
(ACTH), l’hormone lutéinisante
(LH), l’hormone folliculostimulante
(FSH), l’hormone tyréotrope (TSH)
et la prolactine (PRL). La sécré-
tion de ces différentes hormones
adénohypophysaires est contrôlée
de façon constante et précise par
des neuro-hormones sécrétées par
l’hypothalamus et transportées aux
cellules cibles de l’adénohypophyse
par le système porte hypothalamo-
hypophysaire. L’objectif de cet
article de synthèse est de rappeler
les structures employées par le
cerveau pour contrôler la fonction
pituitaire et d’explorer le rôle dyna-
mique que pourrait jouer l’endo-
thélium vasculaire dans le contrôle
Rôle de l’endothélium vasculaire dans l’hypothalamus
neuroendocrine : exemple de l’axe gonadotrope
Vascular endothelial cells are involved in the control of neurosecretion
in the neuroendocrine brain
Vincent Prévot*
* Inserm U837, Centre de recherche Jean-Pierre
Aubert, équipe développement et plasticité du
cerveau postnatal, université de Lille 2.
L’étude des interactions entre cellules non neuronales et neurones
constitue un tout nouveau champ d’investigation qui change radicale-
ment notre façon d’appréhender le mode de fonctionnement du cerveau
neuroendocrine.
Les cellules endothéliales stimulent la neurosécrétion de gonadolibé-
rine (GnRH) par la synthèse et la libération d’un messager hautement diffu-
sible : le monoxyde d’azote, ou NO.
Le NO endothélial pourrait être l’un des éléments synchronisateurs de
la libération de GnRH dans le sang porte hypothalamo-hypophysaire.
Les cellules endothéliales seraient capables de promouvoir une plas-
ticité neurogliale dans le tissu nerveux et ainsi d’avoir un impact signifi-
catif sur la neurosécrétion de GnRH en régulant la formation de jonctions
neuronales spécialisées : les jonctions neurovasculaires.
L’inhibition sélective du dialogue instauré entre cellules endothéliales,
neurones à GnRH et tanycytes dans l’éminence médiane entraîne un arrêt
de la fonction de reproduction chez la rate adulte.
Mots-clés : Cellules endothéliales – Neurone à GnRH – Tanycytes –
Plasticité neurogliale – Monoxyde d’azote – Neurosécrétion – Émi-
nence médiane – Hypothalamus – Reproduction.
Keywords: Endothelial cells – GnRH neuron – Tanycytes – Neuroglial
plasticity – Nitric oxide – Neurosecretion – Median eminence – Hypo-
thalamus – Reproduction.
▲
▲
▲
▲
▲
points FORTS

248
Métabolismes Hormones Diabètes et Nutrition (XI), n° 6, novembre-décembre 2007
thématique
Dossier
Figure 1. Représentation schématique de
l’axe gonadotrope chez la femme. Les neu-
rones à gonadolibérine (GnRH), pris comme
exemple, libèrent leur neurohormone dans
les capillaires du plexus primaire du système
porte. La GnRH peut ainsi atteindre rapi-
dement et avec un minimum de dilution les
cellules cibles gonadotropes de l’adénohy-
pophyse. Les neurones à GnRH voient leur
activité modulée par de multiples réseaux
neuronaux assujettis eux-mêmes à une in-
fluence modulatrice des stéroïdes gonadiques
(voir texte).
EAA : acides aminés excitateurs – NE : nora-
drénaline – NPY : neuropeptide Y.
Influx neuronaux
+ EAA, NE & NPY
– GABA, opioïdes
Hypothalamus
LHRH (GnRH)
Hypophyse
LH, FSH
Ovaires
Estrogènes
Progestérone
de la neurosécrétion au sein même
de l’hypothalamus en prenant pour
exemple la sécrétion de la gonado-
libérine (GnRH), qui est impliquée
dans le contrôle central de la fonc-
tion de reproduction.
Anatomie du complexe
hypothalamo-
hypophysaire
Anatomiquement, l’hypothalamus
correspond à l’ensemble des noyaux
gris diencéphaliques situés dans la
partie latérale du troisième ventri-
cule. Chez l’homme, il est délimité
en haut par le sillon hypothalamique,
en arrière par la partie postérieure
des corps mammilaires, et latérale-
ment par un plan unissant le bord
latéral du tractus optique au bord
inféro-médial du thalamus. C’est
une zone paradoxalement de petite
taille (moins de 1 % du volume du
cerveau) ayant pour rôle essentiel la
survie de l’individu et celle de l’es-
pèce. Il est important de noter qu’en
plus de sa fonction neuroendocrine,
l’hypothalamus a une fonction de
régulation des comportements,
par ses relations étroites avec le
système limbique, et une fonction
de maintien de l’homéostasie, par
sa régulation du système neurové-
gétatif. Les terminaisons nerveuses
des neurones sécrétant les hormones
hypophysiotropes sont situées dans
la partie externe de l’éminence
médiane, cette partie de l’hypotha-
lamus qui contient le réseau capil-
laire primaire du système porte
hypothalamo-hypophysaire et
représente le point de contact entre
le système nerveux et le système
sanguin (figure 2) transportant les
hormones hypothalamiques à l’adé-
nohypophyse (1, 2). Les branches
artérielles qui donnent naissance
à ce réseau capillaire dans l’émi-
nence médiane de l’hypothalamus
proviennent de la carotide interne et
de l’hexagone de Willis. Ce plexus
primaire se regroupe ensuite en
sinusoïdes qui descendent le long
de la tige pituitaire pour se distri-
buer en un autre réseau capillaire
ou plexus secondaire destiné aux
cellules de l’adénohypophyse. La
presque totalité de l’apport sanguin
de l’adénohypophyse provient du
système porte hypothalamo-hypo-
physaire (figure 1). Ensuite, passant
à travers les capillaires de l’adéno-
hypophyse, le sang recueille les
hormones hypophysaires destinées
à la périphérie. Ces capillaires se
regroupent dans les veines hypophy-
saires qui rejoignent les sinus caver-
neux puis les veines jugulaires.
Le système à GnRH
La GnRH est la neurohormone qui
contrôle la maturation sexuelle et
la fonction de reproduction adulte
(3). Elle est synthétisée par une
poignée de neurones (entre 1 000 et
3 000 neurones) dont les corps cellu-
laires sont distribués de manière
diffuse dans la région préoptique et
la région tubérale de l’hypothalamus
chez l’homme (4). La majorité de
ces neurones se projette dans l’émi-
nence médiane de l’hypothalamus,
où ils sécrètent la GnRH dans le
sang porte hypothalamo-hypophy-
saire (figure 1). Une fois la GnRH
déversée dans la circulation porte,
elle est véhiculée vers l’hypophyse
antérieure, où elle stimule la synthèse
et la sécrétion des gonadotropines
hypophysaires LH et FSH par les
cellules gonadotropes via l’activa-
tion de récepteurs membranaires
spécifiques. Les gonadotropines
libérées dans la circulation générale
modulent l’activité des gonades et la
sécrétion des stéroïdes gonadiques.
Se trouvant être les effecteurs finaux
pour le contrôle par le cerveau de
la sécrétion des gonadotropines, les
neurones à GnRH voient leur activité
modulée par de multiples réseaux
neuronaux (5), eux-mêmes assujettis
à une influence modulatrice des
stéroïdes gonadiques (6) [figure 1].
En plus d’un contrôle transsynap-
tique s’effectuant au niveau des corps
cellulaires (5), la fonction sécrétoire
des neurones à GnRH est fortement
régulée au niveau des terminaisons
nerveuses à GnRH dans l’éminence
médiane (7).
L’éminence médiane est une struc-
ture hypothalamique qui est issue
de la différenciation du plancher
du troisième ventricule. Elle est
composée d’une couche épendy-
maire contenant les corps cellulaires
des tanycytes, qui sont des épen-
dymocytes tout à fait particuliers
dans la mesure où ils contactent non
seulement le liquide céphalorachi-
dien à leur pôle apical, mais aussi la
surface piale du cerveau par l’exten-

249
Métabolismes Hormones Diabètes et Nutrition (XI), n° 6, novembre-décembre 2007
Dossier
thématique
Figure 2. L’éminence médiane de l’hypothalamus constitue, anatomiquement et physiologi-
quement, l’interface entre l’hypothalamus et l’adénohypophyse.
A. Image de microscopie confocale montrant l’arrivée des terminaisons nerveuses à GnRH
(bleu) à proximité des capillaires du plexus porte hypothalamo-hypophysaire (rouge, les cellules
endothéliales vasculaires sont marquées à la BSLI). Les tanycytes, cellules épendymogliales
spécialisées de l’éminence médiane, sont marquées en vert (immunoréactivité pour le DARPP-
32) [3V : troisième ventricule. Barre d’échelle : 35 µm].
B. Image de microscopie électronique montrant une terminaison à GnRH (grande tête de flèche,
vert) dans la zone externe de l’éminence médiane à proximité immédiate des capillaires fenêtrés
de la vascularisation porte (Cap, rouge ; petite flèche montrant une fenestration). Notons que
la terminaison nerveuse à GnRH est séparée de l’espace périvasculaire (p.s., rose), délimité
par la lame basale parenchymateuse (petite flèche), par un pied tanycytaire (Tan, jaune) qui
l’enrobe littéralement [barre d’échelle : 0,5 µm]. Ces illustrations sont extraites de (10, 20).
sion de prolongements cellulaires,
appelés pieds tanycytaires, abou-
chant sur l’espace périvasculaire
des capillaires fenêtrés du système
porte hypothalamo-hypophysaire
dans la zone externe de l’éminence
médiane (figure 2A) ; d’une zone
interne, contenant, entre autres, des
astrocytes et les axones des neurones
à ocytocine et à vasopressine qui y
transitent avant d’atteindre la neuro-
hypophyse ; et d’une zone externe
principalement constituée des termi-
naisons nerveuses neuroendocrines,
telles que les terminaisons nerveuses
à GnRH (figure 2B), des pieds tany-
cytaires qui les enrobent (figure 2B)
et de quelques astrocytes.
La fonction sécrétoire des neurones à
GnRH semble être fortement régulée
par les cellules astrogliales (astrocytes
et tanycytes) de l’éminence médiane.
En effet, les études réalisées ces dix
dernières années sur des modèles
animaux (rat, souris) montrent que
celles-ci influencent la sécrétion
de GnRH à la fois par la sécrétion
de facteurs de croissance et/ou de
molécules bioactives telles que les
prostaglandines E2 (PGE2) et par des
remaniements structuraux qui modu-
lent l’accès direct des terminaisons
nerveuses à GnRH aux capillaires
du plexus porte hypothalamo-hypo-
physaire, régulant ainsi l’efficacité
du passage de la neurohormone entre
les terminaisons nerveuses et le sang
porte (8).
Implication
de l’endothélium vasculaire
dans le contrôle
de la libération de GnRH
La participation des cellules endothé-
liales de l’éminence médiane dans le
contrôle de la sécrétion de neuro-
hormones est un nouveau concept
qui a émergé de récentes études sur
l’effet du monoxyde d’azote (NO)
produit dans l’éminence médiane
sur la libération de GnRH (pour
revue [9]). Dans le système nerveux
central, le NO est un neurotransmet-
teur gazeux qui est généré, dans des
conditions physiologiques, par deux
principales isoformes de la NO-
synthétase (NOS) – la NOS neuro-
nale (nNOS) et la NOS endothéliale
(eNOS) – qui ont des distributions
spatiales très différentes. Dans l’émi-
nence médiane, la nNOS est confinée
aux fibres axonales qui se projet-
tent dans la neurohypophyse et qui
sont séparées anatomiquement des
axones à GnRH, alors que la eNOS
est exprimée dans les cellules endo-
théliales des vaisseaux portes hypo-
physaires sur lesquels abouchent
les neurones à GnRH (figure 3C)
[10, 11]. Il était connu depuis le
début des années 1990 que l’admi-
nistration intracérébroventriculaire
de donneurs de NO ou d’inhibiteurs
de NOS influençait la sécrétion
de GnRH/LH (pour revue [11]).
Cependant, ce n’est que le récent
développement de méthodes ampéro-
métriques permettant de mesurer en
temps réel la libération de NO qui a
permis de démontrer que le NO était
produit spontanément par l’éminence
médiane (12). Chez la rate, le profil
de sécrétion du NO est pulsatile et
cyclique (figure 3A). La fréquence
des efflux spontanés de NO (un pulse
toutes les 32 ± 1 minutes) est éton-
namment similaire à celle mesurée
pour la sécrétion de GnRH dans des
conditions expérimentales similaires
(13). L’amplitude des pulses de NO
varie à travers le cycle œstral et est
maximale le jour du proestrus (12),
jour de la survenue du pic préovu-
latoire de GnRH. Ces observations,
conjuguées aux expériences montrant
que la sécrétion de GnRH le jour du
proestrus est bloquée par le L-NIO
(figure 3B), un inhibiteur sélectif de
la eNOS, démontrent que la sécrétion
de NO et celle de GnRH sont causa-
lement liées (12), et suggèrent que
cette production de NO modulant la
sécrétion de GnRH dans l’éminence
médiane est principalement d’origine

250
Métabolismes Hormones Diabètes et Nutrition (XI), n° 6, novembre-décembre 2007
thématique
Dossier
Figure 3. Dans l’éminence médiane de l’hypothalamus, la sécrétion de monoxyde d’azote (NO) par l’endothélium vasculaire pourrait être l’un
des éléments clés de la synchronisation de la libération de GnRH dans le sang porte hypophysaire.
A. Mesures ampérométriques en temps réel de la sécrétion de NO par des explants d’éminence médiane prélevés à différents temps du cycle œstral
chez la rate [DiII, diestrus II ; PRO, proestrus ; E, estrus].
B. Le jour du proestrus, le pic préovulatoire de GnRH/NO est bloqué par le L-NIO, un inhibiteur sélectif de la NO-synthétase endothéliale (eNOS)
[a et *, p < 0,05 versus les échantillons traités par le L-NIO. AUC, mesure de l’aire sous la courbe pendant une période de 30 minutes].
C. Image d’immunofluorescence montrant les fibres axonales à GnRH (flèches fines, vert) dans la zone externe de l’éminence médiane à proximité
immédiate de la zone capillaire fortement immunoréactive pour la eNOS (flèches, rouge) [3V : troisième ventricule (délimité par les pointillés)].
Barre d’échelle : 75 µm. Ces illustrations sont extraites de (11, 12).
Aire sous la courbe
Libération de GnRH (pg/éminence médiane)

251
Métabolismes Hormones Diabètes et Nutrition (XI), n° 6, novembre-décembre 2007
Dossier
thématique
Figure 4. Le jour du proestrus, au moment de
la survenue du pic préovulatoire de GnRH/
LH, une proportion significative de termi-
naisons nerveuses à GnRH (grosse tête de
flèche, vert) contacte directement l’espace
périvasculaire (p.s., rose), soit via l’exten-
sion de phyllopodes (A. petites flèches), soit
par l’intermédiaire d’évaginations de la lame
basale parenchymateuse (B. petite tête de
flèche) qui permettent à l’espace péricapil-
laire (astérisque, rose) de pénétrer dans le
parenchyme nerveux [Tan : tanycytes. Barre
d’échelle : 0,5 µm]. Ces illustrations sont ex-
traites de (17).
A
B
endothéliale. L’importance physio-
logique de la sécrétion de NO dans
l’éminence médiane est renforcée
par les récentes études montrant que
l’inhibition ciblée de la production
de NO dans cette région de l’hypo-
thalamus résulte en un arrêt de la
cyclicité œstrale (10).
Étant donné que la supplémentation
en estrogènes de femelles ovariecto-
misées résulte en une forte augmen-
tation de l’activité NOS et de la
libération de GnRH dans l’éminence
médiane au bout de 48 heures de trai-
tement (12), les estrogènes semblent
être les principaux stéroïdes gona-
diques impliqués dans la régulation
de la sécrétion de NO/GnRH dans
l’éminence médiane au cours du
cycle œstral. Il est vraisemblable
que les estrogènes exercent direc-
tement leur action sur les cellules
endothéliales de l’éminence médiane
puisque ces dernières expriment le
récepteurs alpha aux estrogènes (14).
Ces stéroïdes gonadiques auraient à
la fois une action génomique positive
sur l’expression du gène de la eNOS
(15) et une action aiguë stimulatrice
sur son activité (16).
Ces découvertes nous laissent entre-
voir la possibilité qu’une communi-
cation entre cellules endothéliales et
neurones ait lieu dans des systèmes
neuroendocrines autres que celui
des neurones à GnRH et qu’une telle
voie de signalisation inter-tissulaire
soit utilisée par l’organisme pour
transmettre des informations péri-
phériques vers le système nerveux
central.
Endothélium vasculaire
et plasticité neurogliale
dans l’éminence médiane
de l’hypothalamus
L’accès des terminaisons neuroen-
docrines à GnRH à l’espace péri-
capillaire dans la zone externe de
l’éminence médiane est hautement
régulé par les pieds tanycytaires qui
les enrobent littéralement à GnRH
(figure 2B). Des études de micros-
copie électronique destinées à établir
la dynamique des interactions neuro-
hémo-tanycytaires au cours du cycle
œstral ont permis de définir la plas-
ticité des relations entre neurones
à GnRH et tanycytes comme un
événement clé du contrôle neuroen-
docrine de la sécrétion de GnRH
(pour revue [8]). Dans des condi-
tions basales de sécrétion de gonado-
tropines, la plupart des terminaisons
à GnRH sont séparées de l’espace
péricapillaire par des pieds tany-
cytaires, qui empêchent leur accès
direct à la vascularisation porte et
créent ainsi une barrière de diffusion
pour le passage de la GnRH entre
la terminaison neuroendocrine et le
sang porte hypothalamo-hypophy-
saire (figure 2B). Au moment du pic
préovulatoire de GnRH, un remanie-
ment morphologique conduisant à
la formation de contacts neurovas-
culaires directs pour les neurones à
GnRH survient dans la zone externe
de l’éminence médiane (17). Les
images de microscopie électronique
suggèrent, d’une part, que certaines
terminaisons nerveuses à GnRH
poussent vers l’espace péricapil-
laire (figure 4A) et, d’autre part, que
certains tanycytes, en se rétractant
libèrent les terminaisons nerveuses
de leur emprise et dégagent l’espace
péricapillaire pour la terminaison
nerveuse à GnRH (figure 4B).
La communication intercellulaire qui
permet cette plasticité neurogliale
semble mettre en jeu non seulement
des mécanismes autocrines ou para-
crines impliquant les voies de signa-
lisation des récepteurs erbB (famille
des récepteurs à l’EGF) tanycytaires
(18), mais aussi un dialogue entre
cellules endothéliales et tanycytes
(figure 5). En effet, la mise au point
d’une culture primaire de cellules
endothéliales par immunopurifica-
tion (19) nous a récemment permis
de démontrer que les cellules endo-
théliales de l’éminence médiane
étaient capables de promouvoir un
remaniement aigu du cytosquelette
des tanycytes via la sécrétion d’un
facteur labile et hautement diffusible
que nous avons identifié comme
étant le NO (10). Nous avons aussi
montré, par microscopie électro-
nique, que l’activation de la libéra-
tion de NO endogène induisait des
changements structuraux condui-
sant au retrait des pieds tanycytaires
et permettant l’établissement de
jonctions neurovasculaires pour les
terminaisons axoniques contenant la
 6
6
 7
7
1
/
7
100%