Problèmes nutritionnels dans la dystrophie musculaire

PROBLÈMES
NUTRITIONNELS
DANS LA
DYSTROPHIE
MUSCULAIRE
DE DUCHENNE
XIVÈME COLLOQUE
DE LA SFNEP
DU 30 NOVEMBRE AU
2 DÉCEMBRE 1994
COMPTE
RENDU
FLASH

Dystrophie musculaire
de Duchenne :
contrôler le poids
Il existe une corrélation entre l’évolution
clinique de la maladie de Duchenne et
la réduction progressive de la masse mus-
culaire fonctionnelle active, de l’ordre de
4% par an.
Par ailleurs, le suivi régulier d’une popula-
tion d’une vingtaine de garçons atteints de
dystrophie musculaire de Duchenne a per-
mis à Griffith et Edwards de proposer, en
1988, une notion de poids «idéal» pour la
maladie de Duchenne, de la naissance à 18
ans. Ils ont ainsi établi, de façon indicative,
une courbe de poids faisant abstraction
des phénomènes d’obésité et de dénutrition.
L’étude du poids «idéal» d’enfants atteints
de dystrophie musculaire de Duchenne a
permis d’observer une surcharge pondérale
Certains enfants atteints de dystrophie musculaire de
Duchenne présentent une amyotrophie franche et une dénutri-
tion. Chez d’autres, dans la même tranche d’âge, s’installe une
obésité préjudiciable au pronostic tant orthopédique que respi-
ratoire, de prise en charge délicate.
1
Une courbe de
poids adaptée
à la maladie
2
Dans la maladie de Duchenne, les pro-
blèmes nutritionnels sont constants : il
existe soit une obésité, soit une dénutrition.
L’une et l’autre sont difficiles à gérer quand
elles sont installées.
Une table ronde, consacrée à ces problèmes,
fut l’occasion de rapporter les résultats des
travaux de recherche sur les mécanismes de
survenue de l’obésité et/ou de la dénutrition
chez les garçons présentant cette maladie.
L’une des meilleures méthodes pour étudier
la composition corporelle de ces garçons à
l’heure actuelle est l’imagerie par résonance
magnétique (IRM). Cet outil est intéressant
pour suivre l’évolution de la dystrophie mus-
culaire de Duchenne ou pour évaluer des
effets thérapeutiques. De plus, l’IRM permet
de mieux comprendre les mécanismes méta-
boliques en cause dans cette maladie.
Après une longue période où s’est mise en
place l’individualisation nosologique des
maladies neuromusculaires, puis leur prise
en charge notamment orthopédique et respi-
ratoire, se développe maintenant une prise
en charge nutritionnelle grâce à la compré-
hension des phénomènes observés (compo-
sition corporelle, dépense énergétique d’une
part, prise alimentaire d’autre part). Cela
permettra une alimentation mieux adaptée et
la plus autonome possible pour le patient
atteint de maladie neuromusculaire, afin de
prévenir l’obésité et de lutter contre la dénu-
trition. Il reste indispensable de poursuivre
les recherches fondamentales et cliniques
concernant le métabolisme énergétique
pour améliorer la prise en charge de ces
patients.
Courbe de poids idéale en percentile pour les garçons
atteints de dystrophie musculaire de Duchenne. Basée sur
les données de Edwards et al., Edmonds et al., and Tanner and
witehouse.
Il existe une réduction de la masse musculaire de 4 % par an.
Tiré de : Archives of disease in Childhood, 1988 ; 63 :1256-1258
Poids des garçons
Poids normal
Percentile
Poids idéal
Percentile

Macroglossie
Déformation
mandibulaire
Jeûne
postopératoire
Stress
postopératoire
Fausses routes
Troubles de la
motricité digestive
Anorexie
Insuffisance
respiratoire
Carences vitaminiques
Force et endurance
diaphragmatique
Fatigue
Insuffisance
respiratoire aiguë Difficulté de sevrage de la
ventilation assistée
Hypophosphorémie
Hypomagnésémie
Hypercapnie
Hypoxémie
Dénutrition
Masse
diaphragmatique
Contractibilité
diaphragmatique
débutant vers l’âge de 7-8 ans, touchant
44% d’entre eux à l’âge de 13 ans. Une
dénutrition franche débutant vers l’âge de
12-13 ans, atteignait 44% des patients âgés
de 18 ans.
L’obésité ne semble pas tant liée à une
augmentation des apports alimentaires qu’à
l’absence de leur diminution lors de la baisse
de l’activité physique, notamment lors de la
perte de la marche.
La dénutrition, plus tardive, est probable-
ment multifactorielle. Les facteurs de dénu-
trition liés à la maladie associent aussi bien
la difficulté à porter l’aliment à la bouche
lorsque la force musculaire des membres
supérieurs diminue que les déformations
mandibulaires, la macroglossie, les fausses
routes, les douleurs abdominales. Les
fausses routes sont fréquentes dès l’âge de
14-15 ans. Elles sont aggravées par les
difficultés respiratoires, surtout si aucune
assistance ventilatoire n’est mise en place.
Les douleurs abdominales par atteinte des
muscles du tube digestif contribuent aussi à
une auto-réduction de l’alimentation. La
dénutrition s’aggrave souvent au moment
de la chirurgie du rachis, lourde, sanglante
et douloureuse, entraînant une situation
d’hypercatabolisme difficile à compenser
compte tenu des difficultés d’alimentation
en période péri-opératoire.
MIEUX CONNAÎTRE LA
COMPOSITION CORPORELLE
L’étude de la composition corporelle sert à
mettre en évidence une obésité ou une
dénutrition. Elle fait partie, avec l’évaluation
des apports alimentaires et de la dépense
énergétique, du bilan nutritionnel du
patient.
Les moyens utilisés pour établir ce bilan
nutritionnel sont peu nombreux chez
l’enfant dont la composition corporelle
évolue. Ils doivent rester simples, non
invasifs, peu coûteux. Peu d’études ayant
été faites dans ce domaine, il y a très peu
de références chez l’enfant et encore moins
chez l’enfant atteint de dystrophie
musculaire.
On a donc essayé d’approfondir les connais-
sances sur la composition corporelle des
enfants atteints de dystrophie musculaire de
Duchenne ou des formes apparentées (dys-
trophie musculaire de Becker, SCARMD), en
mesurant la diminution de la masse musculai-
re (principalement due à l’amyotrophie), l’aug-
mentation et la localisation du tissu graisseux
au sein de l’organisme.
A LA RECHERCHE DE LA
MÉTHODE IDÉALE
■
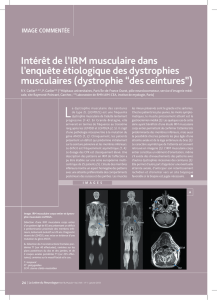
L’IRM est une méthode non invasive,
sans irradiation, qui permet d’étudier la
masse grasse.
Elle fournit des renseignements qualitatifs
sur l’infiltrat lipidique intra-musculaire : il est
hétérogène et varie d’un groupe musculaire
à un autre ; les coupes étagées permettent
d’évaluer la masse grasse dans les 3
dimensions et de distinguer graisse superfi-
cielle et graisse profonde. L’IRM apporte
aussi des renseignements quantitatifs
permettant de calculer le volume de tissu
adipeux et d’en déduire la masse grasse :
on peut ainsi quantifier le dépôt lipidique
intra-musculaire, qui n’est pas pris “en
compte“
2
Les muscles
sont infiltrés
de graisse
3
Cinq compartiments de base entrent dans la composition corporelle : l’eau
extra-cellulaire, l’eau intra-cellulaire, la masse protéique, la masse grasse, et les
minéraux.
En pratique, on mesure :
■
la masse maigre, dont une partie est représentée par les muscles. Elle est
constituée d’eau pour plus de 60%. Elle représente chez le sujet sain la masse
énergétiquement active, c’est-à-dire celle qui dépense l’énergie. Elle est liée à
l’état nutritionnel et détermine la résistance aux infections, les activités enzyma-
tiques, etc.
■
la masse grasse, qui constitue les réserves d’énergie de l’organisme par stocka-
ge sous-cutané et périviscéral des graisses.
Causes et conséquences possibles des situations de dénutrition dans les maladies
neuromusculaires (Journées Parisiennes de Pédiatrie 1994/Flammarion)

par la simple mesure des plis cutanés
(méthode anthropométrique).
Outre l’analyse topographique sous-cutanée,
intramusculaire, ou périviscérale, de l’infil-
tration graisseuse, l’IRM permet également
d’en faire une analyse segmentaire, muscle
par muscle. L’identification, en fonction de
leur type enzymatique, du type de fibres
musculaires plus particulièrement atteintes
permettrait ensuite d’évoquer des hypo-
thèses quant au mécanisme dystrophique
touchant préférentiellement certains
groupes musculaires et pas d’autres.
Cependant cette méthode est coûteuse et
longue à réaliser, et ne peut se faire en rou-
tine actuellement.
■
L’impédance bioélectrique ou impédan-
cemétrie corporelle est une méthode indi-
recte de mesure de l’eau corporelle, à
condition que l’osmolarité soit constante
(osmolarité et ionogramme sanguin
normaux). Elle consiste à enregistrer, par
l’intermédiaire d’électrodes placées au
niveau des mains et des pieds de l’enfant,
le passage d’un courant électrique entre
deux points du corps : si la fréquence est
basse, inférieure à 10 KHz, le courant
passe en extra-cellulaire et l’on mesure
l’eau extra-cellulaire. Au dessus de 1 MHz,
il peut traverser la cellule et l’on mesure
l’eau totale. L’eau intra-cellulaire corres-
pond à la différence. La seule difficulté est
d’obtenir l’immobilité de l’enfant.
Cette technique, lorsqu’elle est couplée à
l’IRM, permet une mesure indirecte de la
masse maigre, à partir de son pourcentage
d’hydratation. La masse grasse est calculée
dans un second temps par différence entre
le poids du corps et la masse maigre.
Cette méthode est rapide, non invasive,
indolore, légère et réalisable en ambulatoire
au lit du malade, voire au domicile du
patient. Elle est facilement reproductible.
Par contre, si elle est bien validée chez
l’adulte sain, elle l’est moins chez l’enfant,
et encore moins chez l’enfant atteint de
dystrophie musculaire où une calibration
spécifique des résultats doit être établie
dans les années à venir.
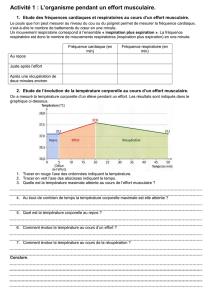
La mesure de la dépense énergétique de
repos est indispensable à l’étude de
l’équilibre entre apport et stockage d’énergie
d’une part, et dépense énergétique d’autre
part. Cela pourra aider à rechercher des
anomalies métaboliques spécifiques,
facteurs de risque d’obésité ou de
dénutrition.
Cette mesure peut s’effectuer de plusieurs
manières :
■
la calorimétrie indirecte est une méthode
de choix car non invasive et peu coûteuse.
Elle évalue la production de chaleur en
mesurant le rapport consommation d’O2
sur production de CO2 (en recueillant les
gaz expirés). Elle permet ainsi de calculer
la dépense énergétique de repos, à jeûn ou
post-prandiale, sur des périodes brèves ou
pendant 24 heures.
■
l’enregistrement de la fréquence
cardiaque sur 24 ou 48 heures est corrélé
à la dépense énergétique mesurée par
échanges gazeux respiratoires. Couplée à
la calorimétrie indirecte et à une épreuve
d’effort, cette méthode permet de déduire
les variations de dépense énergétique
d’après les variations de la fréquence car-
diaque en fonction d’un effort. Cette
méthode est classique chez l’enfant sain
mais difficile chez l’enfant atteint de
dystrophie musculaire qui présente sou-
vent une insuffisance cardiaque : sa fré-
quence cardiaque n’est pas forcément cor-
rélée à sa dépense énergétique et les
efforts lui sont difficiles.
L’examen par IRM met en évidence que les
enfants atteints de dystrophie musculaire
de Duchenne, même extrêmement dénu-
tris, présentent une surcharge lipidique
intra-musculaire masquant la fonte muscu-
laire majeure. On distingue :
■
la dépense énergétique de repos :
elle représente chez le sujet normal
60 à 70% de la dépense énergétique
totale de 24 heures. On l’exprime
par kg de masse maigre, qui est la
masse énergiquement active.
■
la dépense énergétique post-
prandiale : la dépense énergétique
de repos s’élève de 10 à 15% au
cours des 4 à 6 heures qui suivent
un repas. Elle est fonction de la
quantité de calories mais aussi du
type d’aliment absorbé. Elle sera
plus élevée après un repas riche en
protéines qu’en sucres ou en
lipides. Elle est donc rapportée aux
calories ingérées.
■
la dépense énergétique d’activité :
elle est variable et permet d’équili-
brer la balance énergétique lorsque
les apports alimentaires varient. Elle
représente 20 à 30% de la dépense
énergétique totale de 24 heures
chez le sujet sain.
3
L’obésité semble liée
à une diminution de la dépense
énergétique d’activité
4

■
l’utilisation d’eau marquée au deutérium (iso-
tope stable de l’hydrogène) et à l’oxygène 18 :
le patient boit quelques millilitres d’eau mar-
quée et on mesure la décroissance de la
concentration des isotopes stables. C’est de
loin la méthode la plus élégante : non dange-
reuse et non invasive, elle permet une évalua-
tion de la dépense énergétique sur 8 à 15 jours,
en ambulatoire. Son coût élevé et la difficulté
des dosages isotopiques réserve encore cette
technique à la recherche.
Les apports caloriques
alimentaires de l’enfant atteint
de dystrophie musculaire de
Duchenne sont égaux ou infé-
rieurs à ceux de l’enfant sain.
Chez l’enfant sain, les diffé-
rents composants de la
dépense énergétique sont
réguliers et s’équilibrent : si
l’enfant mange plus, il se
dépensera plus. Par contre
l’enfant atteint de dystrophie
musculaire va stocker cette
énergie sous forme de graisse
et ne pourra plus la mobiliser quand son activité
physique va diminuer. La progression de la
maladie provoque des difficultés alimentaires et
une fonte musculaire entraînant une dénutrition
prédominant sur la masse maigre, alors que le
pannicule adipeux reste longtemps conservé.
L’équilibration de la balance énergétique chez
ces enfants est très difficile du fait de l’absence
de normes, de l’évolutivité de la maladie, et de
l’ignorance des mécanismes physiopatholo-
giques qui la sous-tendent. L’évaluation de l’état
nutritionnel des patients devrait se faire indivi-
duellement aux différents stades évolutifs de la
maladie (perte de la marche, arthrodèse, ventila-
tion assistée), en situant la dépense énergétique
dans l’ensemble de l’équilibre énergétique
(mesures simultanées des apports, de la dépense
énergétique et de la composition corporelle).
Exprimer la dépense énergétique par rapport
à la masse maigre n’a plus beaucoup de
sens chez les patients dont la masse musculaire
est très diminuée. Il est néanmoins possible que
la dépense énergétique du muscle malade soit
plus élevée que celle du muscle sain, in vivo.
Des études plus précises utilisant notamment la
résonance magnétique au phosphore pourront
peut-être faire progresser les connaissances
dans ce domaine. Des anomalies métaboliques
spécifiques ont été mises en évidence in vitro :
des cellules dystrophiques en culture transfor-
ment plus facilement le sucre en graisse que les
cellules musculaires normales. De tels méca-
nismes restent à démontrer par des méthodes
simples et non invasives in vivo.
ANOMALIES
MÉTABOLIQUES :
LA CLÉ SERAIT DANS LA
MITOCHONDRIE
On a étudié la dépense énergétique dans le
modèle animal de la dystrophie musculaire de
Duchenne, la souris mdx. La souris mdx subit
une phase de nécrose musculaire très importan-
te à l’âge de 4-6 semaines, suivie par une phase
de régénération musculaire efficace lui permet-
tant d’atteindre l’âge adulte avec une masse
musculaire intacte. Malgré son anomalie géné-
tique identique à la dystrophie musculaire de
Duchenne chez l’homme, son phénotype est
différent. Cette souris présente une augmenta-
tion de la perméabilité membranaire au calcium,
avec une accumulation de calcium dans la fibre
musculaire. Sa dépense énergétique musculaire
basale est diminuée, ainsi que le coût énergé-
tique de l’homéostasie du calcium. Différentes
observations ont permis de penser que ces
anomalies résident au niveau de la mitochondrie
et du cycle de Krebs et qu’elles sont indépen-
dantes de la capture du glucose par la cellule
musculaire.
Il reste maintenant à savoir si, chez l’homme, il
existe aussi un défaut d’utilisation des substrats
énergétiques au niveau du muscle, et plus préci-
sément une anomalie du cycle de Krebs dans la
mitochondrie, jouant un rôle dans les processus
de dégénérescence musculaire. Dans ce cas,
quel est le mécanisme en cause ? Quel rôle joue
t-il entre le phénomène initial (absence de dys-
trophine) et le phénomène final (nécrose muscu-
laire) ?
Si ces anomalies du métabolisme glucidique
font partie des évènements dégénératifs, pourra-
t-on mettre en place des approches thérapeu-
tiques à ce niveau ?
4
Le métabolisme
du muscle
dystrophique
est-il modifié ?
5
Chez des enfants atteints de dystro-
phie musculaire de Duchenne, les
dépenses énergétiques de repos et
post-prandiale ne paraissent pas
très différentes de celles des
enfants témoins. Si la dépense
énergétique de 24 heures est dimi-
nuée, cela serait plutôt lié à une
diminution de la dépense énergé-
tique d’activité.
 6
6
1
/
6
100%