Extraction synergique de nickel (II) par l`acide caprique en présence

Mémoire présenté en vue de l’obtention
du diplôme de Master en : Génie des Procédés
Option : Génie Chimique
Présenté par :
Tannech Sohila
Devant le jury composé de :
Président : Mme A.Slimani
Encadreur
:
M
me
F.Adjel
Examinateur
:
M
me
A.Aidi
Promotion Juin 2016
ﺔﯿﺒﻌﺸﻟا ﺔﯿطاﺮﻘﻤﯾﺪﻟا ﺔﯾﺮﺋاﺰﺠﻟا ﺔﯾرﻮﮭﻤﺠﻟا
République Algérienne Démocratique et Populaire
ﻲﻤﻠﻌﻟا ﺚﺤﺒﻟا و ﻲﻟﺎﻌﻟا ﻢﯿﻠﻌﺘﻟا ةرازو
Ministère de l’Enseignement Supérieur et de la Recherche Scientifique
Université Mohamed Khider – Biskra
Faculté des Sciences et de la technologie
Département :Chimie Industrielle
ةﺮﻜﺴﺑ ﺮﻀﯿﺧ ﺪﻤﺤﻣ ﺔﻌﻣﺎﺟ
ﺎﯿﺟﻮﻟﻮﻨﻜﺘﻟا و مﻮﻠﻌﻟا ﺔﯿﻠﻛ
ﻢﺴﻗ : ﺔﯿﻋﺎﻨﺼﻟا ءﺎﯿﻤﯿﻜﻟا
Extraction synergique de nickel (II) par
l'acide caprique en présence de DMSO

Remerciements
Avant tout, je dois remercier Dieu le tout puissant qui m’a
donné la force pour mener à terme ce travail
I'aimerais tout d'abord exprimer ma profonde gratitude et mes
vifs remerciements à mon encadreur, Dr laajel Fatima, pour son
support scientifique, moral et matériel pendant toute la durée du travail.
J'adresse mes remerciements à Mme.A.Aidi qui ont accepté
de juger ce travail ainsi qu'à M me. A.Slimani de m'avoir fait
l'’honneur de présider le jury.
J’exprime mon remerciement aux enseignements du
département de chimie industrielle.
Que toutes les personnes et tous mes amis qui m’ont soutenu
moralement soient assurés de l’expression de ma reconnaissance.

Dédicace
Je dédie humblement comme preuve d'amour de reconnaissance ce
mémoire à tous ceux qui me sont chérs
A mes chérs parents M'hamed et Saadia pour leur amour ,
leur sacrifice , leur patience
A mes très chérs frères Hicham et Ziaid
A mes très chéres sœurs Amel , Nassima Kaltoum , Fatima ,
Linda Pour leurs présence , leurs amours , leurs soutiens ,
dans ma vie
A mes très chéres amies: Saida,, Saliha,,
Hadjira , Amina ,Chaima
Sohila

Resume
Page42
RESUME
Ce travail porte sur l'étude de l'extraction synergique de nickel(II) en milieu
sulfate par l'acide caprique en présence DMSO dans le chloroforme.
On absence du DMSO, le complexe nickel(II) extrait dans la phase organique
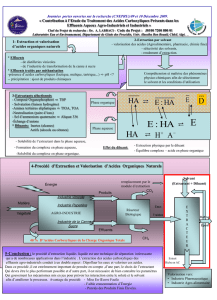
a pour stœchiométrie, NiL2 conformément au équilibres d'extraction suivant :
22
2( ) ( ) 2
org
Ni HL NiL H
+
L'étude de l'extraction du nickel(II) par le mélange synergique de l'acide
caprique et le diméthylsulfoxyde (DMSO) dans le chloroforme a montré un effet
antagoniste pour tout les concentration de DMSO dans la phase organique.
Mots clés: extraction liquide-liquide, synergique, antagoniste

Abstract
ABSTRACT
This work focuses on The study of the synergistic extraction of nickel (II) from
sulfate media with capric acid in absence and in the presence of DMSO into chloroform.
In the absence of synergistic agent, the extracted species for nickel(II) in the
organic phase have been found to be NiL2 and their extraction equilibrium can be
formulated as:
22
2( ) ( ) 2
org
Ni HL NiL H
The study of the extraction of nickel (II) by the synergistic mixture of capric acid
and dimethylsulfoxide (DMSO) in chloroform showed an antagonistic effect for all DMSO
concentration in the organic phase.
Key words: liquid-liquid extraction, synergistic, antagonistic
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
1
/
51
100%