Le syndrome de Cushing chez le cheval

Diagnostic
Update
Le syndrome de Cushing du cheval ou DPIH (dysfonctionnement de la pars intermedia
de l’hypophyse) est la dysendocrinie la plus importante et la plus fréquente des poneys
et des chevaux âgés de plus de 15 ans.
July 2016
Le syndrome de Cushing chez le cheval
Pathogénie
Bien que la pathogénie exacte ne soit pas encore totalement
élucidée, l’hypertrophie et l’hyperplasie de la pars intermedia de
l’hypophyse apparaissent comme des caractéristiques patholo-
giques au centre de cette affection.
L’hypophyse antérieure est constituée de 3 parties principales
: la pars distalis (cellules corticotropes), la pars intermedia (cel-
lules mélanotropes) et la pars tuberalis. La pars distalis et la pars
intermedia produisent toutes deux des peptides dérivés de la
pro-opiomélanocortine (POMC).
Chez les chevaux en bonne santé, la sécrétion de ces peptides
dérivés de la POMC est régulée. Les cellules corticotropes de la
pars distalis produisent principalement l’ACTH (hormone corti-
cotrope / adrénocorticotrophine) et la LPH (-lipotropine / -LPH).
En revanche, les cellules mélanotropes de la pars intermedia
sécrètent avant tout l’alpha-MSH (hormone mélanotrope alpha
ou hormone stimulant les mélanocytes alpha), le peptide CLIP
(corticotropine-like intermediate lobe peptide), la bêta-endorphine
et de faibles quantités d’ACTH. Physiologiquement, les cellules
mélanotropes de la pars intermedia sont sous le contrôle inhibiteur
de la dopamine. Celle-ci est produite par les neurones dopaminer-
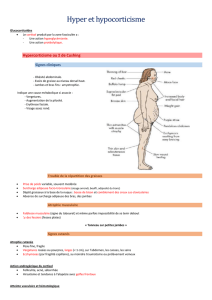
giques, qui relient l’hypothalamus à l’hypophyse (Figure 1a). Toute
lésion de ces neurones (neuro-dégénérescence), provoquée par
un stress oxydatif, peut conduire à une diminution de la sécrétion
de dopamine et ainsi à une perte de l’inhibition d’origine dopami-
nergique de la pars intermedia. Il peut s’ensuivre une hyperplasie
et une hypertrophie (adénome) de cette dernière aboutissant à
l’apparition de signes du syndrome de Cushing (Figure 1b).
En effet, les cellules mélanotropes modifiées de la pars interme-
dia vont sécréter une quantité anormalement élevée de peptides
dérivés de la POMC. L’augmentation de la sécrétion d’ACTH
stimule la fonction surrénalienne, ce qui augmente à son tour la
sécrétion de cortisol. La concentration sérique en cortisol n’est
toutefois pas nécessairement au-dessus des valeurs usuelles,
mais la courbe du cortisol plasmatique ne suit plus le rythme
circadien normal. Étonnamment, une hyperplasie des glandes
surrénales n’est observée que chez 20 % environ des chevaux
souffrant d’un syndrome de Cushing.
Cette augmentation de la sécrétion de cortisol est considérée
comme un facteur décisif dans le mécanisme pathogène du
syndrome de Cushing. Le cortisol qui favorise la néoglucoge-
nèse est aussi un antagoniste de l’insuline. En cas de syndrome
Cushing équin, la sécrétion de cortisol semble être la cause de la
résistance à l’insuline, de l’hyperglycémie, de l’hépatopathie, de
la lipolyse extra-hépatique et de l’orientation générale du métabo-
lisme vers le catabolisme. En outre, le cortisol peut être à l’origine
d’effets immunodépresseurs.
Les peptides dérivés de la POMC, tels que l’alpha-MSH alpha
et l’endorphine augmentent les propriétés stéroïdiennes de
l’ACTH. Ils jouent probablement aussi un rôle clé dans l’homéos-
tasie énergétique, la modulation des effets de l’insuline sur la
baisse de la glycémie et la régulation du système immunitaire.
L’alpha-MSH semble être impliquée dans les modifications du
pelage et l’immunodépression, tandis que l’endorphine contri-
bue à la léthargie. Le rôle du peptide CLIP dans le syndrome de
Cushing équin est en revanche encore flou.
Hypothalamus
Hypothalamus
Pars nervosa
Pars distalis
Neurones dopami-
nergiques endom-
magés (dopamine)
Pars nervosa
Pars distalis
Neurones dopaminer-
giques de l’hypotha-
lamus (dopamine)
Pars intermedia
Sécrétion physiologique de peptides dérivés de la
POMC : a-MSH, peptide CLIP, β-endorphine, ACTH
Hypophyse Hypophyse
Manifestations cliniques lors du syndrome
de Cushing équin
Aspect physiologique de l’hypothalamus et
de l’hypophyse
Figure 1a Figure 1b
Chiasma
optique Chiasma
optique
Hypertrophie et hyperplasie de la pars
intermedia augmentation de la sécrétion
de peptides dérivés de la POMC : a-MSH,
peptide CLIP, β-endorphine, ACTH

soient dus à l’altération de la production de prolactine et d’hor-
mone gonadotrope, consécutive à la compression de la pars
distalis par la pars intermedia.
Des signes nerveux sont également décrits : ataxie, crises
convulsives ou narcolepsie.
Les desmites et les ruptures des brides tendineuses sont des
lésions du système musculo-squelettique pouvant être obser-
vées chez les chevaux atteints du syndrome de Cushing.
Examens complémentaires
non spécifiques
Numération et formule sanguines : parmi les anomalies les
plus fréquentes figurent l’anémie, la lymphopénie, la neutro-
philie, l’éosinopénie et la monocytose. Elles ne sont toutefois
pas spécifiques de cette affection. Des modifications similaires
peuvent être constatées dans la formule leucocytaire de chevaux
en bonne santé soumis à un stress.
Biochimie sanguine : une hyperglycémie légère à modérée,
ainsi qu’une augmentation des enzymes hépatiques, des trigly-
cérides et du cholestérol sont en général observées.
Analyse urinaire : une glycosurie et une diminution de la densité
urinaire peuvent être notées.
Exploration thyroïdienne : les hormones thyroïdiennes peuvent
être normales ou diminuées. La diminution des hormones thy-
roïdiennes peut être secondaire à un syndrome de Cushing et
n’est pas toujours liée à une altération du fonctionnement de la
thyroïde. Chez les chevaux avec une insulinorésistance, le risque
de fourbure est plus élevé (indicateur pronostique négatif).
Attention :
La seule détermination du cortisol plasmatique de base n’a au-
cune valeur pour le diagnostic du syndrome de Cushing. C’est
l’évolution du cortisol au cours des tests hormonaux fonctionnels
qui constitue l’élément déterminant.
Tests hormonaux fonctionnels
spécifiques
Les principaux tests hormonaux permettant le diagnostic d’un
syndrome de Cushing sont décrits ci-après. Le test nocturne de
freinage à la dexaméthasone et la mesure de la concentration
en ACTH sont les examens les plus importants. D’autres exa-
mens complémentaires spécifiques semblent prometteurs pour
le diagnostic du syndrome de Cushing en pratique vétérinaire
équine quotidienne, mais ils doivent encore être développés et
validés ; ils représenteront certainement à l’avenir de nouveaux
outils diagnostiques fiables, à la disposition du praticien.
Merci de numéroter chacun des échantillons des tests
fonctionnels en suivant l’ordre chronologique (échantil-
lon 1, 2 et 3). Merci de penser également à noter sur les
échantillons s’il s’agit de plasma ou de sérum.
Test nocturne de freinage à la dexaméthasone
Il s’agit d’un des tests hormonaux fonctionnels ayant été le mieux
validé pour le diagnostic du syndrome de Cushing.
Symptômes cliniques
Les signes cliniques sont dus à l’augmentation de la sécrétion de
cortisol, à l’hypertrophie de la pars intermedia et à la production ac-
crue ou non régulée de peptides dérivés de la POMC. La pathogé-
nie exacte de ces symptômes reste toutefois encore inconnue.
L’hirsutisme (hypertrichose) est la manifestation clinique la plus
fréquente et la plus caractéristique. Visible chez près de 80 % des
chevaux atteints d’un syndrome de Cushing, il semble être dû à
une augmentation de la sécrétion d’α-MSH et/ou d’androgènes. Le
poil de jarre est long, épais et ondulé. La mue est lente ou incom-
plète, avec un pelage plus long au niveau de la ganache, des
jambes et de l’abdomen. Quelques chevaux présentent de légers
changements de couleur de robe. Il semblerait que l’hyperhidrose
(sudation excessive), observée chez certains chevaux souffrant de
syndrome de Cushing, soit un mécanisme de thermorégulation en
réponse à l’hirsutisme.
La fourbure chronique est une complication clinique majeure du
syndrome de Cushing et représente parfois le seul signe clinique
observé. Près de 50 % des chevaux atteints d’un syndrome de
Cushing peuvent présenter une fourbure, et celle-ci est très pro-
bablement la conséquence de l’insulinorésistance.
La fonte musculaire et la perte de poids sont également régu-
lièrement observées et sont provoquées par l’augmentation du
catabolisme protéique. Cette fonte musculaire et cette perte de
poids sont plus rapides que celles observées lors du vieillisse-
ment normal et concernent avant tout la musculature du dos et
du thorax. Certains chevaux présentent une distension abdomi-
nale (« abdomen penduleux »).
Des dépôts graisseux anormaux en arrière des yeux (gonflement
de la fosse supra-orbitaire ou salières), à la base de la queue,
autour du ligament nucal (chignon) et au niveau du fourreau sont
également souvent observés.
Les causes de la polyurie/polydipsie observée lors d’un syn-
drome de Cushing sont multiples, avec en particulier l’hyperglycé-
mie (diurèse osmotique), l’augmentation du taux de filtration glo-
mérulaire, et la baisse de la sécrétion de l’hormone antidiurétique
(ADH) suite à la pression de la pars intermedia sur la pars nervosa
de la neurohypophyse. La polyurie et la polydipsie peuvent passer
inaperçues chez les chevaux au pré.
Les maladies infectieuses sont plus fréquentes. En raison de
l’altération de leur système immunitaire, les chevaux atteints
de ce syndrome sont plus sensibles aux bronchopneumonies,
sinusites, abcès de pied, alvéolites dentaires, conjonctivites et
infections cutanées. Ils peuvent aussi présenter un retard de
cicatrisation des plaies.
Le cheval peut également apparaître léthargique et moins ré-
pondre aux stimuli douloureux, probablement du fait de l’hyper-
sécrétion de β-endorphine.
Des troubles visuels (cécité) peuvent éventuellement survenir
chez les chevaux affectés, suite à la compression du chiasma
optique par l’adénome hypophysaire.
De l’infertilité, une disparition des cycles sexuels et une lacta-
tion persistante peuvent être observées chez certains chevaux
atteints du syndrome de Cushing. Il est probable que ces signes

Réalisation du test :
1) Prise de sang et dosage du cortisol basal entre 16 et
18 heures.
2) Immédiatement après, injection de 40 µg/kg de poids vif (PV)
(4 mg/100 kg PV) de dexaméthasone par voie intramusculaire
(IM) ou intraveineuse (IV).
3) Le lendemain : 2ème prise de sang 19 à 24 heures après l’ad-
ministration de dexaméthasone et dosage du cortisol (réalisée
donc entre 12 – 17 heures le lendemain). Un prélèvement
supplémentaire peut éventuellement être réalisé 15 heures
après l’administration de dexaméthasone (soit à 8 heures du
matin le lendemain).
Échantillon : 1 ml de sérum pour chaque dosage.
Interprétation des résultats :
Chez les chevaux en bonne santé, l’administration de corticoïdes
provoque une baisse de la sécrétion du cortisol endogène en
raison d’un rétrocontrôle négatif, et les valeurs après freinage
sont comprises entre 0,5 et 1 µg/dl. Chez les chevaux atteints de
Cushing, la dexaméthasone n’induit aucun rétrocontrôle négatif
et ne conduit pas à une baisse significative du cortisol, après
son administration.
En début de maladie, la sensibilité du test est plus faible. Il
n’est pas encore clairement établi si l’injection de dexamétha-
sone risque d’entraîner une fourbure, mais ce risque semble
être faible. Il convient de prendre en compte que le risque de
fourbure peut être plus élevé chez les chevaux présentant une
insulinorésistance ou une obèsité.
Dosage de l’ACTH
Cet examen, sans risque, constitue une bonne alternative pour
le diagnostic d’un syndrome de Cushing, en particulier s’il est
impossible de prélever plusieurs échantillons.
Réalisation et conservation des prélèvements :
Le prélèvement est réalisé de préférence le matin, entre 8 et 10
heures (matériel : 1 ml de plasma, sang prélevé dans un tube
avec EDTA). Le cheval doit avoir passé une nuit calme avant le
prélèvement et rester calme pendant celui-ci. Comme l’ACTH
est instable, le sang doit être centrifugé immédiatement après le
prélèvement. Si ce n’est pas possible, l’échantillon de sang total
peut être conservé au maximum 8 heures à une température n’ex-
cédant pas 4°C. Le sang total sur EDTA ne doit pas être congelé
! Après la centrifugation, le plasma doit être transvasé dans un
tube sec en plastique puis congelé. Le plasma doit être expédié
congelé au laboratoire, dans un conteneur spécifique prévu pour
les transports réfrigérés. Les tubes spéciaux contenant des
inhibiteurs de protéases (par exemple aprotinine, N-phénylma-
leimide) n’ont pas d’effet prouvé sur la concentration en ACTH.
Interprétation des résultats :
Il faut suspecter un syndrome de Cushing si la concentration
en ACTH dépasse les valeurs de référence. Une concentration
en ACTH inférieure aux valeurs de référence n’exclut pas un
syndrome de Cushing. De faux négatifs peuvent survenir si les
échantillons n’ont pas été correctement traités.
Test de stimulation à la TRH
Le test de stimulation à la TRH est une alternative présentant peu
de risque, mais dont la sensibilité reste faible.
Réalisation du test :
1) Prise de sang et dosage du cortisol basal.
2) Administration de 1 mg de TRH par voie IV (0,5 mg pour les
poneys).
3) Prise de sang 30 minutes après l’administration de TRH
et dosage du cortisol.
Échantillon : 1 ml de sérum pour chaque dosage.
Interprétation des résultats :
Une augmentation du cortisol d’au moins 30 % par rapport au
taux basal entraîne une suspicion de Cushing.
Le test de stimulation à la TRH peut être réalisé en dosant l’ACTH
au lieu du cortisol. Il semble que cette variante du test soit plus
spécifique et plus sensible pour le diagnostic.
Pour plus d’informations concernant le déroulement du test et
son évaluation, veuillez-vous vous adresser à notre service de
consulence spécialisé.
Test combiné de freinage à la dexaméthasone et de
stimulation à la TRH
Ce test peut être utilisé chez les chevaux ayant présenté un
résultat douteux au test de freinage à la dexaméthasone.
Réalisation du test :
1) Prise de sang et dosage du cortisol basal.
2) Administration immédiate de 40 µg/kg PV (4 mg/100 kg PV)
de dexaméthasone IV.
3) Prise de sang 3 heures après l’administration de dexamétha-
sone, et dosage du cortisol. Puis injection de 1 mg de TRH
par voie IV.
4) Prise de sang 30 minutes après l’administration de TRH et
dosage du cortisol.
5) Le lendemain : prise de sang 24 heures après l’administra-
tion de dexaméthasone (point 2) pour le dernier dosage du
cortisol.
Échantillon : 1 ml de sérum pour chaque dosage.
Interprétation des résultats :
Le test repose sur l’hypothèse que la dexaméthasone freine la sé-
crétion normale d’ACTH au niveau de la pars distalis hypophysaire.
Par conséquent, toute augmentation du cortisol après l’adminis-
tration de TRH est attribuée à une sécrétion excessive d’ACTH par
les cellules mélanotropes de la pars intermedia. Une augmentation
du cortisol ≥ 66 %, 30 minutes après l’administration de TRH et/ou
un taux de cortisol > 1 µg/dl, 24 heures après l’administration de
dexaméthasone, indique un diagnostic positif de Cushing.
Quand faut-il réaliser ces tests ?
Quel que soit le test, le cheval doit être calme et ne doit pas res-
sentir de douleurs. Toute douleur (liée à une fourbure par exemple)
ou une situation de stress, avant ou pendant le prélèvement de
l’échantillon peut conduire à de faux positifs. Chez les chevaux en
bonne santé, la modification saisonnière automnale de l’activité
de l’axe hypophyso-surrénalien peut conduire à des résultats faux
positifs, quels que soient les tests utilisés (stimulation ou freinage).
En raison de ces fluctuations circannuelles, il existe toutefois des
valeurs de référence spécifiques des concentrations en ACTH pour
les chevaux en bonne santé, qui permettent l’interprétation des ré-
sultats au cours des différentes saisons. Tous les tests présentent
une sensibilité plus faible lors des premiers stades de la maladie.

Traitement
Le syndrome de Cushing est une maladie chronique incurable,
qui nécessite une prise en charge appropriée, pour assurer une
bonne qualité de vie des chevaux atteints. Des bilans réguliers
doivent être effectués chez les chevaux atteints avec des prélève-
ments sanguins permettant d’établir leur profil hématologique et
biochimique. Un certain nombre de mesures doivent être prises
systématiquement chez les chevaux atteints du syndrome de
Cushing, par exemple des soins orthopédiques réguliers en cas
de fourbure, des contrôles dentaires, un traitement antiparasi-
taire régulier, la tonte du pelage en été, la fourniture d’un abri et/
ou d’une couverture en hiver, ainsi qu’une alimentation de haute
qualité. Il est important de fournir une alimentation équilibrée
adaptée aux chevaux âgés, ainsi qu’un apport complémentaire
d’antioxydants (vitamines C et E) et de minéraux. Chez certains
chevaux, l’apport énergétique doit être augmenté. Le métabolisme
du glucose pouvant toutefois être altéré, il est contre-indiqué de
suralimenter les chevaux atteints de Cushing. Le traitement médi-
cal de cette maladie est uniquement palliatif, puisque la guérison
est impossible. Une synthèse rapide des médicaments actuelle-
ment recommandés dans le traitement du Cushing est présentée
ci-dessous. Il est à noter qu’en Suisse, seul le mésilate de pergo-
lide possède une AMM chez les chevaux et qu’il n’existe aucune
étude publiée sur son utilisation chez les juments gravides.
Agonistes de la dopamine et antagonistes de la sérotonine
La dopamine et la sérotonine sont deux neuromédiateurs qui
contrôlent le fonctionnement des cellules mélanotropes hypophy-
saires. La dopamine inhibe leur activité, tandis que la sérotonine
la stimule. Des agonistes de la dopamine et des antagonistes de
la sérotonine sont par conséquent utilisés pour le traitement du
syndrome de Cushing équin.
Agonistes de la dopamine
Le mésilate de pergolide est un médicament très utilisé dans
le traitement du syndrome de Cushing équin. Il est considéré
comme le plus efficace. Il peut entraîner des effets indésirables
comme une perte d’appétit, une hypersalivation, des coliques
Matériel Nombre de consul-
tations nécessaires
Avantages Inconvénients
Test de freinage à la
dexaméthasone
Sérum 2 ou 3 Un des tests les mieux validés Risque possible de fourbure
Plusieurs prélèvements nécessaires
Fluctuations saisonnières
Dosage de l'ACTH EDTA-
plasma
(congelé)
1 1 seul prélèvement nécessaire
Pas de risque pour le cheval
L’interprétation des résultats est pos-
sible au cours des différentes saisons
Préparation des échantillons plus contrai-
gnante
Nécessité de congeler les prélèvements de
plasma sur EDTA
Test de stimulation à
la TRH
Sérum 1 1 seul prélèvement nécessaire
(la variante du test dosant l’ACTH semble
être plus sensible et plus spécifique)
Sensibilité faible (faux positifs plus fréquents)
La TRH n’est pas disponible partout
Fluctuations saisonnières
Combinaison freinage
à la dexaméthasone/
stimulation à la TRH
Sérum 2 ou 3 Plus sensible que les
2 tests réalisés séparément Spécificité plus faible que le test de
stimulation à la TRH
Réalisation plus contraignante
Fluctuations saisonnières
Avantages et inconvénients des différents tests de laboratoire utilisés lors de Cushing
ou de la diarrhée qui rétrocèdent après la réduction de la dose
administrée ou l’arrêt du traitement. À ce jour, aucune valvulopa-
thie fibrosante cardiaque n’a été décrite chez le cheval après un
traitement de longue durée au pergolide, contrairement à ce qui
est observé chez l’homme.
La bromocriptine (sous forme de mésilate) a également été
proposée comme traitement du syndome de Cushing équin. Il
semblerait que sa biodisponibilité chez le cheval soit toutefois in-
suffisante, en raison d’une faible absorption. Son efficacité dans
le traitement du syndrome de Cushing équin est donc limitée.
Antagonistes de la sérotonine
La cyproheptadine a été utilisée comme traitement du syndrome
de Cushing chez le cheval. Mais aujourd’hui, l’efficacité de cette
substance est toutefois remise en question. La cyproheptadine
entraîne rarement des effets indésirables, mais elle peut conduire
à une légère sédation lorsqu’elle est administrée à fortes doses
en raison de ses effets antihistaminiques. Son administration
combinée à celle du pergolide est décrite chez les chevaux pré-
sentant une réponse insuffisante à la monothérapie.
Suivi du traitement
Des examens de contrôle réguliers (cliniques et de laboratoire)
permettent d’apprécier l’évolution de la maladie et d’évaluer
l’efficacité du traitement. Ils devraient être réalisés au moins tous
les six mois.
Test de freinage à la dexaméthasone ou dosage de l’ACTH
Ces examens complémentaires sont également très utiles pour
le suivi. Généralement, la concentration en ACTH baisse environ
4 à 6 semaines après l’initiation du traitement, le plus souvent en
conjonction avec une amélioration des signes cliniques.
Glycémie et insulinémie
La mesure de la glycémie et de l’insulinémie peut être utile dans
les cas démontrés d’insulinorésistance.
Dr. med. vet. Anastasios Moschos
Conseiller technique équin • IDEXX Vet•Med•Labor Ludwigsburg/Allemagne
1606027-0616-CH-FR
IDEXX Diavet AG
Schlyffistrasse 10
8806 Bäch SZ
Suisse
Tél. : 044 786 90 20
Fax : 044 786 90 30
www.idexx.ch/diavet
IDEXX Diavet
1
/
4
100%