devoir vacances de paques ex 3 correction

On réalise un chauffage à reflux avec 20mL de propanol, 35 mL d’acide butanoïque et quelques gouttes d’acide
sulfurique. Il se forme du butanoate de propyle et de l’eau, la réaction est limitée.
Après 20 minutes, on éteint le chauffage et on laisse refroidir le milieu réactionnel, on le transvase dans une ampoule
à décanter, puis on rajoute de l’eau froide salée. On agite l’ampoule à décanter et on laisse reposer, il se forme 2
phases : une phase aqueuse et une phase organique.
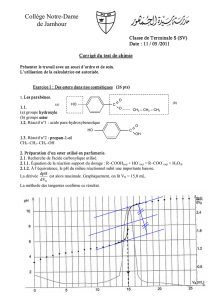
1. Comment nomme le montage ci-contre ? Compléter la légende .
2. Pourquoi chauffe-t-on ?
3. Quel est l’intérêt de l’acide sulfurique?
Exercice 3 :
Données:
Propanol : M=60g/mol peu soluble dans l’eau Teb=97°C d=0,803 n=1,381
Acide butanoïque : M=88 g/mol assez soluble dans l’eau Teb= 118°C d=0,961 n=1,402
Butanoate de propyle : M=130 g/mol pas soluble dans l’eau Teb=143°C d=0,87 n=1,390
L’alcool et l’acide carboxylique sont solubles dans l’ester.
L’acide sulfurique est très soluble dans l’eau.
Les ions butanoate H3C-CH3-CH3-COO-sont très solubles dans l’eau.
4. Écrire l’équation-bilan de la réaction (ne pas tenir compte de l’acide sulfurique) . La
réaction est limitée.
5. Dessiner l’ampoule à décanter avec les 2 phases, préciser le contenu de chacune
d’elles.
6. Donnée : couple acide/base CO2/HCO3-
On garde la phase organique, on ajoute une solution d’hydrogénocarbonate de sodium
(Na++HCO3-). Les 2 solutions sont placées dans l’ampoule à décanter, on agite
l’ampoule. La base HCO3-, introduite en excès, engendre une réaction totale. On
dégaze pour supprimer la surpression puis on laisse décanter.
Quel est l’intérêt de cette étape? Expliquer.
7. On sépare à nouveau la phase aqueuse de le phase organique.
Dans la phase organique, comment isoler l’ester des autres espèces ?
8. Comment vérifier la pureté de l’ester obtenu ?
9. Déterminer les quantités de réactifs introduits - propanol et acide butanoïque - au
début de la synthèse.
10. Après les étapes de séparation et purification, on obtient 0,12 mol d’ester.
Déterminer le rendement de la réaction, on pourra s’aider d’un tableau d’avancement.
11. Quel volume d’ester obtient-on finalement ?
1
2
3
4

+
CH
3
CH
2
CH
2
CO
OH
+
CH
3
CH
2
CH
2
CO
O
-
Exercice 3:
1. Dispositif de chauffage à reflux.
2. Quand on chauffe le milieu réactionnel , cela signifie que la réaction qui a lieu est lente, en chauffant, on accélère
la réaction.
3. L’acide sulfurique est ajoutée en très petite quantité, il s’agit d’un catalyseur, il est consommé puis régénéré. Il sert
à accélérer la réaction.
4.
OHCH
3
CH
2
CH
2
+
CH
3
CH
2
CH
2
CO
OH
CH
3
CH
2
CH
2
CO
O CH
2
CH
2
CH
3
+
OH
2
5.
Phase organique : densité < 1 d’après les données:
Phase aqueuse : densité ≈ 1
Eau salée, acide butanoïque (assez soluble dans l’eau), le catalyseur (très
soluble dans l’eau, (traces d’ester et d’alcool).
Ester, alcool (réaction limitée), acide butanoïque (réaction limitée),
traces d’eau.
6. La base HCO3-va réagir sur l’acide butanoïque :
HCO3-CO2+ H2O
La base HCO3-est -introduite en excès- consomme entièrement l’acide butanoïque, cette étape sert à éliminer cet
acide de la phase organique. Il se forme des ions butanoate très soluble dans l’eau. La phase organique ne contient
alors plus que l’ester, de l’alcool et des traces d’eau.
en excès
ion butanoate
7. On peut isoler l’ester en éliminant d’abord les traces d’eau en utilisant un desséchant (composé ionique qui
absorbe les traces d’eau). Puis en réalisant une distillation car les températures d’ébullition de l’ester et de l’alcool
ne sont pas voisines, on sépare ainsi l’ester de l’alcool.
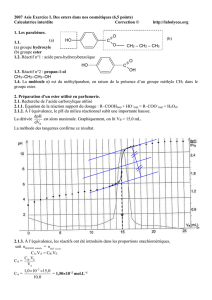
8. On peut vérifier la pureté de l’ester obtenu en mesurant son indice de réfraction, on doit mesurer: n= 1,390.
9.
n = ––– = –––– = ––––––––– = 0,27 mol
M
m
M
ρ.V
60
0,803x20
propanol:
en g/mL
n = –––– = ––––––––– = 0,38 mol
M
ρ.V
88
0,961x35
acide butanoïque :
10. acide + alcool → ester + eau
EI (mol) 0,38 0,27 0 0
Ne pas écrire «excès» car dans ce cas l’eau n’est pas
un solvant.
EF(mol) 0,38 -xm0,27-xm xmxmRq: en fait la réaction est limitée, mais on écrit xm
au lieu de xfcar on calcule un rendement.
0,11 0 0,27 0,27
rendement : ρ = ––––––––– = –––––– = 0,44 = 44%
n(ester)exp
n(ester)th
0,12
0,27
11. n = ––––
M
ρ.V V = –––– = –––––––– = 18 mL
ρ
n.M
0,87
0,12x130
(On rappelle que: d(x) = –––– = ––––––––––– )
ρ(x)
ρeau
ρ(x) en g/mL
1 g/mL
En cours de trans (mol) 0,38 - x 0,27 - x x x
1
/
2
100%