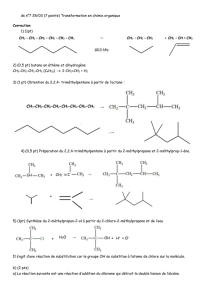
Q1. Quelle sont les groupes caractéristiques présents sur le réactif

Q1. Quelle sont les groupes caractéristiques présents sur le réactif et le produit de la réaction ? Quelles sont les
fonctions chimiques de ces deux composés ? Nommer le produit obtenu.
Pas de groupe caractéristique sur l’hex-1-ène (fonction alcène) et un groupe hydroxyle (fonction alcool) pour le
produit : l’hexan-2-ol.
Q2. Pourquoi est-il demandé, dans l’étape 1, de procéder très lentement au mélange des réactifs ?
La réaction entraîne une forte augmentation de température et peut être violente. Il convient de rester prudent
pour éviter les projections. (Attention : il ne se forme pas de gaz au cours de cette réaction contrairement à ce que
vous avez parfois indiqué. Néanmoins l’élévation de température pourrait faire passer les produits liquides de la
réaction à l’état gazeux)
Q3. Déterminer la quantité de matière initiale en hex-1-ène et en eau. En déduire le réactif en défaut.
L’eau est ici bien un réactif et sa quantité de matière doit intervenir dans le tableau d’avancement (qu’il n’est plus
utile de construire en TS sauf si c’est explicitement demandé)
On a introduit :
AN : nalcène =
= 1,6.10-1 mol
AN : neau =
3,3 mol
L’eau est en grand excès, l’alcène est limitant et devrait être entièrement consommé.
Q4. Dessiner et annoter le montage à reflux mentionné dans l’étape 3.
Voir ci-contre : attention pas besoin de chauffage ici contrairement à ce que vous avez tous fait !
Montage à reflux
Q5. Comment peut-on justifier la présence de deux phases en fin de réaction ?
L’hexan-2-ol produit n’est que très peu soluble avec l’eau (car constitué d’une longue chaine carbonée apolaire donc
hydrophobe): il forme donc une phase séparée de celle de l’eau et placée au-dessus en raison de sa faible densité.
(Attention, vous avez calculé en Q3 que l’alcène était limitant, il a donc complètement réagi !)
Q6. Avant de procéder à la décantation de l’étape 4, comment peut-on vérifier, par une manipulation très simple,
que la phase inférieure est aqueuse.
- Il suffit de soutirer un peu de phase inférieure dans un tube à essais et y rajouter qques mL d’eau distillée. Si
l’on n’observe qu’une phase, il s’agit de la phase aqueuse.
- Ou : rajouter un peu d’eau distillée dans l’ampoule à décanter : la phase dont le volume augmente est la
phase aqueuse
Réfrigérant à boules
Entrée d’eau
Mélange réactionnel
Agitateur magnétique chauffant
Support élévateur

- Ou : prélever une goutte de la phase présumée aqueuse. La déposer sur un peu de sulfate de cuivre anhydre
qui devient bleu s’il s’agit de la phase aqueuse. (en aucun cas vous avez le droit d’introduire de la poudre de
sulfate de cuivre anhydre dans la solution)
Q7. Quelle information apporte la température à partir de laquelle on a commencé à recueillir la fraction principale ?
La température de distillation correspond à celle du produit récupéré. La valeur lue est proche de la température
d’ébullition de l’hexan-2-ol.
Q8. Rechercher dans les tables les bandes caractéristiques de chacune des fonctions chimiques attendues.
Dans l’alcène, on doit observer :
- une bande caractéristique de la liaison C=C entre 1500 et 1800 cm-1 : on en voit une bien nette vers 1640
cm-1 sur le spectre de B
- une bande caractéristique de la liaison =C-H (différente des autres C-H) entre 2800 et 3200 cm-1 : on en voit
une vers 3080 cm-1 sur le spectre de B
Dans l’alcool, on doit observer :
- une bande caractéristique de la liaison O-H entre 3200 et 4000 cm-1 : on en voit une bien large à 3340 cm-1
sur le spectre de A
- Une bande caractéristique de la liaison C-O entre 900 et 1500 cm-1 : on en voit une qui se détache des
autres vers 100 cm-1 sur le spectre de A
Q9. Identifier les composés A et B.
A correspond donc à l’alcool hexan-2-ol et B à l’alcène hex-1-ène.
Q10. A l’aide de ces spectres IR, que peut-on conclure quant au produit obtenu ?
Les spectres IR permettent de confirmer la disparition de l’alcène au profit d’un alcool mais la structure de ce dernier
ne peut être connue de manière certaine.
Q11. Interpréter ce spectre. Permet-il de confirmer la structure attendue ?
Lorsque vous analysez un spectre RMN, 4 caractéristiques doivent être décrites :
- Nombre de massif correspondant au nombre de protons équivalents
- Multiplicité des massifs avec explication règle et voisins.
- Courbe d’intégration
- Déplacement chimique
Le spectre RMN montre 5 massifs donc 5 types de protons équivalents que l’on retrouve sur la molécule :
CH3-(CH2)3-CH(OH)-CH3
En réalité, les 6 protons des CH2 ne sont pas strictement équivalents
car ils n’ont pas le même environnement chimique. Mais l’environnement étant quasiment le même, on observe que
leurs massifs se superposent.
On distingue : - un triplet à 0,9 ppm dont la courbe d’intégration permet de dire qu’il correspond à trois protons
équivalents. Le triplet implique que ce CH3 est couplé à un CH2. Compte tenu du petit déplacement chimique, il se
trouve loin de tout élément électronégatif, il s’agit donc des protons (E)
- un doublet vers 1,2 ppm correspondant à 3H; couplé à un voisin CH dont le déplacement chimique
implique la présence d’un élément électronégatif voisin. (D)
- un multiplet vers 1,46 ppm pour une intégration de 6H ; il s’agit des 3 CH2 (CH2 couplé au CH et CH3)
(C)
- un singulet (intégration 1) à 1,71 ppm correspond au H de OH (B)
- un multiplet vers 3,79 ppm pour une intégration de 1 correspondant au CH couplé avec CH2, CH3, et
OH, d’où la multiplicité du signal et le fort déplacement chimique (A)
Ce spectre RMN permet de valider la structure du produit attendu.

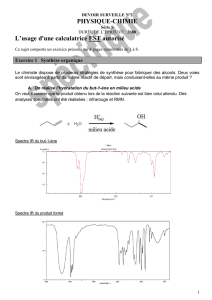
Q12. Quels renseignements nous donne le spectre infrarouge du produit formé donné ci-dessous ?
Le spectre infrarouge du produit formé montre une bande caractéristique vers 3350 cm-1, bande large
caractéristique de la fonction alcool.
Q13. S’agit-il du même produit que dans la réaction 1 ? Justifier.
La comparaison des deux spectres des deux produits obtenus montre que les bandes dans le domaine de nombre
d’onde 500-1300 cm-1, sont différentes. Or il s’agit du domaine qui caractérise un composé, c’est son empreinte
digitale. Il s’agit donc de deux alcools différents.
Q14. Les deux processus envisagés sont appelé hydratation d’un alcène : il s’agit de l’addition d’eau sur la double
liaison sous forme –H et –OH. Proposer une formule développée pour le composé obtenu ici et isomère du
précédent.
Il s’agit donc d’un alcool isomère du l’hexan-2-ol. La chaine carbonée n’étant pas
modifiée, deux possibilités demeurent : l’hexan-1-ol et l’hexan-3-ol. Mais l’ajout
de –OH ne pouvant se faire que sur la double liaison, il ne reste que l’hexan-1-ol.
Q15. Cette structure est-elle compatible avec le spectre RMN du composé obtenu ?
D’après les intégrations des différents signaux, on doit avoir CH3, 4 CH2 simples, un CH2 lié à –OH et un signal pour
1H de OH ; soit 4 massifs
On distingue :
- un triplet pour 2H à 3,62 ppm couplé à un CH2 (A)
- un singulet pour 1 H du OH à 1,79 ppm (B)
- un multiplet d’intégration 8 pour les 4 CH2 intermédiaires (C)
- un triplet d’intégration pour le CH3 terminal (E)
Q16. Conclure sur l’influence des conditions opératoires lors d’une synthèse ?
Suivant les conditions opératoires, et les réactifs utilisés à partir de l’hex-1-ène, on pourra obtenir soit un alcool
primaire (hexan-1-ol) soit un alcool secondaire (hexan-2-ol). Le chimiste aura donc la possibilité d’obtenir le produit
désiré en jouant sur ces paramètres. Il faudra donc réfléchir à une stratégie efficace pour obtenir le produit voulu.
1
/
3
100%