Lire l`article complet

6
Correspondances en pelvi-périnéologie - n° 1, vol. V - janvier/février/mars 2005
L
a notion d’andropause, apparue il y a une
quinzaine d’années, a entretenu une ambi-
guïté dans l’esprit de nos patients en raison du
parallèle fallacieux avec la ménopause.
En premier lieu, si le terme de ménopause
désigne une situation réelle, “l’arrêt des règles”
(menos : “règles”), celui d’andropause est inap-
proprié, puisqu’il signifie littéralement : “arrêt de
la masculinité” (andros : “homme”), ce qui ne
reflète nullement le tableau clinique en cause.
Ensuite, il n’y a aucun caractère inéluctable à
l’andropause, contrairement à la ménopause, qui
touche 100 % des femmes.
Enfin, les mécanismes présidant aux deux situa-
tions semblent assez différents, même si l’étape
finale est une diminution (voire un arrêt) de la pro-
duction d’hormones sexuelles par les gonades.
Actuellement, on tend à remplacer le mot “andro-
pause” par l’expression “déficit androgénique lié
à l’âge” (DALA) . Les auteurs anglo-saxons pous-
sent la prudence jusqu’à n’évoquer qu’un déficit
partiel : partial androgen deficiency of the aging
male (PADAM).
Cette nouvelle taxonomie fait apparaître claire-
ment le principal responsable de l’andropause :
le vieillissement. Celui-ci est aussi difficile à défi-
nir qu’à situer dans le temps. Quand commence-
t-on à vieillir ? Y a-t-il plusieurs formes de vieillis-
sement ? Chaque fonction, voire chaque organe,
connaît un processus de vieillissement différent.
Qu’est-ce qui rythme le vieillissement de notre
sexualité : nos gonades, nos commandes céré-
brales, la diminution des stimuli extérieurs, les
pathologies associées… ?
Mise au point
* Institut Alfred-Fournier, Paris.
E-mail : [email protected]
R
ÉSUMÉ
.
Le déficit androgénique lié à l’âge (DALA) atteint 7 % des hommes de 40 à 60 ans, 20 %
des hommes de 60 à 80 ans et 35 % des hommes de plus de 80 ans. Il est caractérisé par une
diminution du taux de testostérone totale ou biodisponible sous le seuil de normalité. Les
premiers symptômes du DALA sont sexuels, avec une diminution de la libido associée à des
troubles de l’érection et de l’éjaculation. Ces troubles étant la résultante de multiples facteurs, il
convient de rechercher d’autres pathologies associées (diabète, HTA, artériosclérose, etc.).
D’autres symptômes plus généraux (morosité, dépression, changement de la composition
corporelle, etc.) complètent le tableau clinique. La décision de traiter repose sur la seule preuve
objective du DALA, la baisse du taux sérique de la testostérone, et sur l’absence de contre-
indications.
Mots-clés : Andropause – Testostéronémie.
A
BSTRACT
.
Androgen Deficiency of the Aging Male (ADAM) or Partial Androgen Deficiency of the
Aging Male (PADAM) can be identified in 7% of male from 40 to 60 years old, 20% between 60 and
80, and 35% over 80 years old. ADAM is characterized by a decrease of total or bioavailable
testosterone levels under the threshold of normality. Sexual disorders are the first symptoms to
appear: decrease of libido, erectile dysfunction and/or ejaculatory abnormalities. Many other
pathologies such as diabetes mellitus, arterial hypertension, arteriosclerosis… are involved in the
occurrence of these sexual problems. This is the reason why a complete evaluation of the patient
must be performed before any androgenic supplementation. Other symptoms like sadness,
depression, changes in morphology complete the clinical picture. Decision for treatment depends
on the only objective proof of ADAM: the decrease of testosterone level, and the lack of
contraindications.
Keywords: ADAM – Testosterone deficiency.
Le déficit androgénique
lié à l’âge
Androgen Deficiency
of the Aging Male (ADAM)
■
■
J.M. Bohbot*

7
Correspondances en pelvi-périnéologie - n° 1, vol. V - janvier/février/mars 2005
Toutes ces interrogations montrent que le syn-
drome du DALA n’est pas aisé à définir. Un
ensemble de manifestations cliniques, la plupart
non pathognomoniques, constituent un faisceau
de présomptions qui vont orienter vers la
recherche de la seule preuve objective du DALA :
la baisse du taux sérique de la testostérone.
Mais, là encore, les opinions n’ont pas toujours
été consensuelles : quelle testostérone doser ?
Quand la doser ? Comment l’interpréter ?
Une fois le diagnostic établi se pose l’épineux
problème du traitement. Faut-il traiter ? Si oui,
qui traiter ? Comment et combien de temps ?
Reste enfin la question éthique. L’avancée des
recherches en matière de vieillissement et leur
retentissement médiatique dans la population
générale ne créent-ils pas un besoin ? Le DALA
doit-il être considéré comme un état patholo-
gique, ou comme une étape naturelle du vieillis-
sement ? En un mot, les médecins n’ont-ils pas
construit artificiellement une entité appelée
DALA ? À cela, on peut opposer que de nombreux
travaux montrent l’implication du déficit andro-
génique dans des situations pathologiques clai-
rement identifiées.
Dans ces méandres d’interrogations, la définition
la plus actuelle du DALA a été donnée par l’Inter-
national Society for the
Study of the Aging Male
(ISSAM) en 2002 (1) : “Le
DALA est un syndrome
biochimique associé au
vieillissement et carac-
térisé par un déficit
sérique en androgènes
avec ou sans diminution
génétique de la sensibi-
lité aux androgènes. Ce
tableau conduit à des
altérations de la qualité
de vie et agit de manière
délétère sur de multiples
fonctions organiques.”
R
APPEL
PHYSIOLOGIQUE
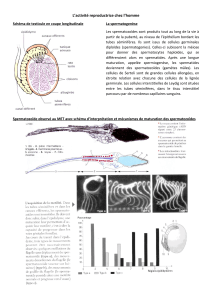
✓Au niveau testicu-
laire, c’est la cellule de
Leydig qui synthétise les
hormones sexuelles à
partir du cholestérol soit
produit in situ, soit capté
dans la circulation générale. La première trans-
formation conduit à la formation de prégnénolone.
Puis, selon deux voies, l’une directe, l’autre indi-
recte et passant par la formation de progestérone,
la testostérone est produite (figure). Un déficit en
17-stéroïde réductase est responsable d’un hypo-
gonadisme. En effet, cette enzyme permet la trans-
formation d’androstènedione, peu active, en tes-
tostérone active.
L’hormone lutéinisante (LH) hypophysaire inter-
vient en stimulant la transformation du choles-
térol en prégnénolone. La production de LH n’est
pas continue mais pulsatile, avec des pics toutes
les 60 à 90 minutes (2). La testostérone exerce
un rétrocontrôle de la sécrétion de LH.
Le testicule produit 7 mg de testostérone par
jour, en moyenne.
Dans le testicule, la testostérone peut être trans-
formée en 17ß-estradiol ou en dihydrotestosté-
rone (DHT). Cette transformation est quantitati-
vement faible au sein du tissu testiculaire et se
fait préférentiellement dans des tissus périphé-
riques. Ces deux produits de transformations
exercent également un rétrocontrôle de la LH.
✓La testostérone libérée dans la circulation san-
guine se lie en grande partie soit à une protéine
de transport appelée testosterone-estradiol
binding globulin (TeBG), pour 43 %, soit à des
protéines non spécifiques (albumine : 51 %, et
cortisol-binding globulin [CBG] : 4 %). En fait,
seuls 2 % de la testostérone sécrétée restent
libres. Le taux de TeBG est sujet à de fréquentes
variations, alors que l’albumine et la CBG fluc-
tuent peu.
La testostérone totale comprend donc :
– la testostérone liée à la TeBG ;
– la testostérone liée à la CBG ;
– la testostérone liée à l’albumine ;
– la testostérone libre.
La testostérone biodisponible est la somme de
la testostérone libre et de la testostérone liée à
l’albumine. Elle est un reflet très fidèle de l’im-
prégnation androgénique, puisqu’elle échappe
aux fluctuations de la TeBG.
La sécrétion de testostérone connaît un cycle cir-
cadien et un cycle circannuel : le taux de testo-
stérone plasmatique est maximal le matin et en
automne.
Les valeurs physiologiques des différentes frac-
tions de la testostérone figurent dans le tableau.
✓L’action périphérique de la testostérone est
différente selon les organes. La grande majorité
des récepteurs aux androgènes est située dans
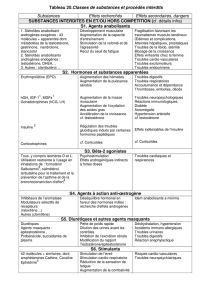
Taux plasmatiques Taux plasmatiques
(ng/ml) (nmol/l)
LH 1-7 UI/l
Testostérone totale 3-10 10,4-34,7
TeBG (SHBG) 1,5-3,0 17-34
Testostérone biodisponible 0,7-3,4 2,4-11,8
Testostérone libre 0,07-0,42 0,24-1,46
Tableau. Valeurs physiologiques de la LH, de la TeBG et des fractions
de la testostérone.
Prégnénolone
17α-hydroxylase
17-stéroïde réductase
Desmolase
17α-hydroxyprégnénolone
Déhydroépiandrostérone
5-androstènediol
Progestérone
17α-hydroxyprogestérone
Androstènedione
Testostérone
Cholestérol
Figure. Voies de la synthèse de la testostérone.

8
Correspondances en pelvi-périnéologie - n° 1, vol. V - janvier/février/mars 2005
les organes génitaux, mais il existe des récep-
teurs en nombre limité dans d’autres organes.
Dans les muscles, par exemple, c’est la testo-
stérone qui stimule directement la transcription
génique de certaines protéines au niveau
nucléaire.
Dans la majorité des tissus (prostate, foie, peau,
etc.), la testostérone joue le rôle de pro-hor-
mone, l’activité directe étant dévolue aux pro-
duits de transformation comme la DHTou le 17ß-
estradiol. Ces transformations se produisent à
l’intérieur des cellules. Sous l’action d’une 5α-
réductase, la testostérone se transforme en DHT
(prostate, vésicules séminales, foie). Liée à une
protéine cytoplasmique, la DHT pénètre dans le
noyau, se fixe sur un récepteur (le même que
celui de la testostérone, mais la DHT a une affi-
nité supérieure pour ce récepteur), puis module
la synthèse protéique.
Sous l’action d’une aromatase, la testostérone
se transforme en 17ß-estradiol. Ce processus,
principalement hépatique, est augmenté dans
certaines conditions pathologiques (hépatite,
cirrhose, etc.).
E
FFETS DES ANDROGÈNES
Effets sur les organes génitaux
✓Développement embryonnaire : sous l’in-
fluence de la testostérone et de la DHT ont lieu
un développement, à partir de la huitième
semaine, des canaux de Wolff pour donner l’épi-
didyme, le canal déférent et le canal éjaculateur,
et une régression des canaux de Muller.
✓Stimulation de la spermatogenèse : bien que
la production des spermatozoïdes soit sous la
dépendance de la FSH (Follicle-stimulating hor-
mone), elle ne peut se dérouler harmonieuse-
ment sans l’action des androgènes (action de la
testostérone sur la méiose et sur la transforma-
tion spermatide-spermatozoïde).
✓Développement des voies séminales : les
androgènes, et plus particulièrement la DHT,
jouent un rôle fondamental dans la croissance
prostatique postpubertaire. Notons également
une action sensible sur les tubes séminifères et
les vésicules séminales et, bien entendu, sur la
verge et les testicules.
✓Le tissu prostatique croît avec l’âge, essentiel-
lement sous l’influence de la DHT. Les estrogènes,
quant à eux, initient une hyperplasie fibromuscu-
laire. L’utilisation de médicaments inhibant la 5α-
réductase, enzyme de la conversion testostérone-
DHT, permet de stabiliser l’hypertrophie bénigne
de la prostate. Les androgènes sont également
impliqués dans la progression des cancers pros-
tatiques. En revanche, des études ont montré qu’il
n’y avait pas de corrélation entre le taux d’andro-
gènes circulants et le déclenchement des patho-
logies bénignes ou malignes de la prostate (3). De
même, la supplémentation hormonale des sujets
hypoandrogéniques n’accroît pas l’incidence de
ces pathologies (3). Cependant, l’existence d’une
lésion cancéreuse de la prostate contre-indique
formellement le traitement androgénique.
Effets sur les caractères sexuels
secondaires
Sont notés les effets suivants : développement
du larynx, pigmentation cutanée, stimulation de
l’unité pilo-sébacée au niveau du cuir chevelu,
du visage, du cou, de la partie supérieure du tho-
rax et du périnée, avec, comme conséquence
pubertaire, l’hyperséborrhée responsable de
l’acné.
Effet sur le sein
La stimulation de la croissance des canaux galac-
tophores aboutit chez certains adolescents à une
légère gynécomastie de la zone sous-aréolaire,
généralement spontanément résolutive après 1
à 3 ans.
Effet stimulant sur la libido
✓Les zones cérébrales impliquées dans le
déclenchement du désir sexuel, et plus particu-
lièrement l’hypothalamus et la zone préoptique,
possèdent des récepteurs pour les androgènes
(testostérone, DHT) mais aussi pour les estro-
gènes (on sait que la testostérone peut être aro-
matisée en 17ß-estradiol au niveau du cerveau).
Les androgènes stimulent ces centres, entraînant
une excitation sexuelle. Cette excitation andro-
géno-dépendante est à l’origine des érections
nocturnes automatiques, alors que les érections
d’origine psychogène (stimulations sensorielles
ou affectives) sont moins tributaires de l’impré-
gnation androgénique. La disparition ou la
moindre fréquence des érections automatiques
est un indice orientant vers une hypoandrogénie.
✓Les centres médullaires de l’érection et de
l’éjaculation sont également andro-sensibles. La
testostérone stimule les neurones moteurs du
système nerveux autonome.
✓ Enfin, les androgènes ont une action directe
sur les corps érectiles péniens (4).
Mise au point

9
Correspondances en pelvi-périnéologie - n° 1, vol. V - janvier/février/mars 2005
Effets métaboliques
✓Action anabolisante : rétention d’azote, de
sodium, de calcium, de phosphore, d’eau.
✓Action sur les lipides : les androgènes ont
longtemps eu la réputation d’avoir une action
très défavorable sur le métabolisme lipidique. En
réalité, plusieurs études concordantes incrimi-
nent l’hypoandrogénie dans l’athérogenèse
(5, 6). Un taux bas de testostérone se traduit par
une élévation du LDL-cholestérol et des triglycé-
rides. A contrario, l’administration de testosté-
rone à des sujets hypoandrogéniques a permis
de diminuer le taux de cholestérol total et de
réduire la proportion de LDL-cholestérol.
✓ Action sur la composition corporelle : les
androgènes (essentiellement la testostérone)
augmentent la masse musculaire par stimulation
de l’anabolisme protéique (7). Concomitamment,
ils réduisent la masse graisseuse. L’hypoandro-
génie liée à l’âge s’accompagne d’une fonte mus-
culaire squelettique associée à une augmenta-
tion de l’adiposité abdominale et viscérale.
L’adiposité viscérale est un facteur de risque
cardiovasculaire connu (8) et de diabète non
insulinodépendant. À cet égard, on sait qu’un
taux bas de testostérone peut induire une résis-
tance à l’insuline (7).
✓Effet sur les composants sanguins :
• En ce qui concerne les facteurs de la coagula-
tion, il semble que les androgènes n’aient pas d’in-
fluence délétère, ce qui est confirmé par la rareté
des accidents vasculaires rapportés sous andro-
génothérapie comparée à l’estrogénothérapie.
• Il convient d’insister sur le fait que les andro-
gènes favorisent la production d’érythropoïétine,
stimulent l’érythropoïèse et élèvent l’hémato-
crite. Il s’agit d’un facteur de surveillance biolo-
gique important au cours des traitements andro-
géniques.
✓Action sur la minéralisation osseuse : un défi-
cit androgénique réduit la minéralisation
osseuse, pouvant aboutir à l’ostéoporose.
Cependant, il semble que ce soit par l’intermé-
diaire des estrogènes que les androgènes favo-
risent cette minéralisation osseuse. Il est donc
nécessaire, en cas de traitement substitutif,
d’utiliser des androgènes aromatisables. Au
moment de la puberté, ce sont bien les andro-
gènes qui sont responsables de la croissance par
développement des os longs. Cette action est
régulée vers l’âge de 18 ans par la fusion des car-
tilages de conjugaison, elle aussi sous la dépen-
dance des androgènes.
L
EDÉFICIT ANDROGÉNIQUE LIÉ À L
’
ÂGE
Baisse de la testostéronémie
Naturellement, et en dehors de tout contexte
pathologique, la sécrétion d’androgènes dimi-
nue avec l’âge. Cette diminution, pour constante
qu’elle soit, est très variable d’un homme à
l’autre. La testostéronémie est maximale entre
20 et 30 ans et décroît ensuite régulièrement. La
testostérone totale commence à baisser de
manière significative entre 60 et 70 ans. Cepen-
dant, la fraction biologiquement active (testo-
stérone libre) diminue plus précocement (dès
50 ans), et de façon plus marquée. À 80 ans, la
valeur moyenne de la testostérone plasmatique
totale a diminué de 25 % par rapport à celle de
l’adulte jeune, alors que celle de la testostérone
libre a diminué de 50 %. Cette diminution élec-
tive de la testostérone libre est due à l’augmen-
tation avec l’âge de la TeBG (protéine de liaison
des androgènes). La décroissance de la testo-
stérone biodisponible suit celle de la testosté-
rone libre. Son dosage (aisé) est donc un fidèle
reflet des variations de l’imprégnation androgé-
nique du sujet.
Épidémiologie du DALA
Cette diminution sérique n’aboutit pas toujours
à un syndrome de DALA. Tout dépend du niveau
d’imprégnation “basique” de l’individu consi-
déré. D’après A. Vermeulen (9), il atteint 7 % des
hommes de 40 à 60 ans, 20 % des hommes de
60 à 80 ans et 35 % des hommes de plus de
80 ans.
Comme nous l’avons vu, les androgènes exercent
des actions multifocales au sein de l’organisme.
Il est donc logique que l’hypoandrogénie s’ac-
compagne de symptômes variés, pas toujours
pathognomoniques. Nous insisterons essentiel-
lement sur le retentissement psychosexuel du
DALA.
Symptômes sexuels
Ce sont les plus fréquemment retrouvés et les
plus précoces.
✓La baisse de la libido est le principal motif de
consultation. Elle se concrétise par un désinté-
rêt pour la sexualité, une raréfaction des rapports
sexuels, une diminution des réactions aux sti-
muli sexuels fantasmatiques (films ou écrits éro-
tiques, etc.). C’est souvent le patient lui-même
qui, spontanément, place ce tableau au premier
plan. Parfois, le manque de libido n’apparaît

10
Correspondances en pelvi-périnéologie - n° 1, vol. V - janvier/février/mars 2005
qu’au cours d’un interrogatoire pour troubles de
l’érection. Enfin, certains hommes s’accommo-
dent très bien de cette situation, mais ce sont les
partenaires qui les incitent à consulter.
✓La dysfonction érectile (DE) se manifeste soit
par une difficulté à obtenir une érection, soit par
une difficulté à la maintenir. Dans d’autres cas,
c’est la qualité même de l’érection qui est en cause
(défaut de fermeté). La DE est très souvent multi-
factorielle et se situe au carrefour de pathologies
diverses : troubles vasculaires (artériosclérose,
HTA), métaboliques (diabète), neurologiques
(neuropathies périphériques), hormonaux, iatro-
gènes (rôle des antihypertenseurs, des hypolipé-
miants, des antidépresseurs, des neuroleptiques,
etc.) et psychologiques. Le DALA ne représente
qu’une cause parmi d’autres. L’interrogatoire
recherchera les signes d’une baisse de la libido.
L’un des signes orientant vers une hypoandrogé-
nie est la disparition ou la raréfaction des érec-
tions nocturnes automatiques.
✓Le retard à l’éjaculation est également un
signe fréquent de DALA. Au maximum, certains
patients rapportent une absence d’éjaculation.
L’éjaculation est perturbée qualitativement et
quantitativement : diminution des sensations
contractiles rythmiques participant à l’obtention
de l’orgasme, et diminution du volume éjacula-
toire avec modification de la consistance du
sperme.
Modifications du comportement
Le sujet hypogonadique exprime souvent une
asthénie physique et psychique, un manque
d’entrain, une difficulté à se concentrer, un désin-
térêt pour le monde qui l’entoure pouvant
conduire à un état dépressif vrai. Sont également
rapportés des troubles de la mémoire, une
insomnie, une irritabilité, etc.
Modifications physiques
Le schéma corporel de l’homme hypogonadique
change. On observe une diminution de la masse
musculaire, une augmentation de la masse grais-
seuse avec localisation abdominale, une gyné-
comastie, une diminution de la pilosité. Le patient
se plaint également de bouffées de chaleur, de
palpitations. Enfin, une déminéralisation osseuse
peut être objectivée par l’ostéodensitométrie.
Tous ces symptômes ne sont pas pathognomo-
niques du DALA. Le diagnostic ne peut être porté
que sur l’objectivation biologique du DALA,
c’est-à-dire sur une testostéronémie basse. Le
dosage doit être pratiqué le matin. On dosera la
testostérone totale. En l’absence d’anomalies
de ce taux chez un sujet symptomatique, on
dosera la testostérone biodisponible et la LH.
Certains laboratoires expriment leurs résultats
en fonction de l’âge. Cela n’a aucun sens, puis-
qu’on considère qu’il y a hypoandrogénie en
dessous des seuils suivants, quel que soit l’âge
du sujet :
– testostérone totale inférieure à 3 ng/ml ou à
10,4 nmol/l ;
– testostérone biodisponible inférieure à 0,7 ng/ml
ou à 2,45 nmol/l ;
– un taux de LH supérieure à 10 UI/l est consi-
déré comme élevé.
Une fois le diagnostic de DALA confirmé, et bien
que les bénéfices des traitements hormonaux
substitutifs aient fait l’objet de nombreuses
publications, il convient avant de les prescrire de
s’assurer de deux points essentiels :
– que le patient ne présente pas de contre-indi-
cation à ces traitements (cancer de la prostate
évolutif ou antécédents, cancer du sein, poly-
globulie, insuffisance cardiaque sévère, etc.) ;
– que le patient désire que l’on améliore son état.
La question importante à poser à son patient est :
“Avez-vous envie d’avoir envie ?” Certains
hommes porteurs de symptômes évocateurs de
DALA consultent “pour savoir”. Ils assument par-
faitement leur état, de même que leur partenaire,
et ne sont désireux ni l’un, ni l’autre de traiter le
DALA. L’abstention thérapeutique s’impose
alors. De même, il faut être très circonspect sur
l’intérêt d’une prescription hormonale unique-
ment motivée par le souhait de la partenaire
sexuelle. L’avis préalable du sexologue ou du
psychologue peut nous éclairer.
Finalement, le DALA est fréquent mais pas uni-
versel. Par ailleurs, il est perçu très différemment
d’un sujet à l’autre. Sa gestion nécessite un bilan
biologique sérieux et une évaluation des risques
du traitement substitutif. Cependant, les traite-
ments disponibles, par leur efficacité, leur bonne
tolérance et la rareté de leurs complications
(sous réserve d’une surveillance précise et régu-
lière) permettent d’obtenir une amélioration sen-
sible de la qualité de vie des sujets hypoandro-
géniques. ■
Mise au point
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Morales A, Lunenfeld B, Internatio-
nal Society for the study of the Aging
Male. Investigation, treatment and
monitiring of late-onset hypogona-
dism in males. Aging Male 2002;5(2):
74-86.
2. Veldhuis JD, Evans WS, Johnson
ML, Rogol AD. Physiological proper-
ties of the luteinizing hormone pulse
signal: impact of intensive and exten-
ded venous sampling paradigms on
their characterization in healthy men
and women. J Clin Endocrinol Metab
1986;62:881-91.
3. Gooren L. Androgen deficiency in
the aging male: benefits and risks of
androgen supplementation. Steroid
Biochem Mol Biol 2003;85(2-5):349-55.
4. Morelli A, Filippi S, Mancina R,
Luconi M et al. Androgens regulate
phosphodiesterase type 5 expression
and functional activity in corpora
cavernosa. Endocrinology 2004;145(5):
2253-63.
5. Khaw KT, Barrett-Connor E. Lower
Endogenous androgens predict central
adiposity in men. Ann Epidemiol
1992;2:675-82.
6. Phillips GB, Pinkernell BH, Jing TY.
The association of hypotestosterone-
mia with coronary artery disease in
men. Arterioscler Thromb 1994;14(5):
701-6.
7. Tenover JL. Testosterone for all. In:
The 80th Endocrine Society Meeting
New Orleans. Louisiane: Endocrine
Society 1998:S1-S8.
8. Marin P, Arver S. Androgens and
abdominal obesity. Baillieres Clin
Endocrinol Metab 1998;12(3):441-51.
9. Vermeulen A, Kaufman JM. Ageing
of the hypothalamo-pituitary-testicu-
lar axis in men. Horm Res 1995;43(1-
3):25-8.
1
/
5
100%