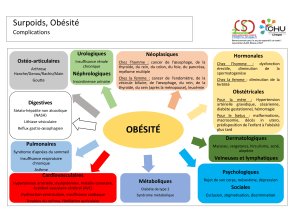
La cardiopathie de l`obèse

Mini-revue
La cardiopathie de l’obèse
Atul Pathak
1,2,3
, Michel Galinier
1,2
, Jean-Michel Senard
2,3
1
Pôle Cardiovasculaire et Métabolique, Service de Cardiologie, CHU de Rangueil, 31403 Toulouse cedex 09
2
Unité de Recherche sur les Obésités - Inserm 586, Institut Louis Bugnard, Université Paul Sabatier,
31062 Toulouse Cedex 9
3
Service de Pharmacologie Clinique, Faculté de Médecine, 37 allée Jules Guesde, 31073 Toulouse
L’obésité joue un rôle important dans la genèse de l’insuffisance
cardiaque. Au cours de l’étude de Framingham, après ajuste-
ment pour les autres facteurs de risque, chaque augmentation
d’un point de l’index de masse corporelle entraîne une majora-
tion du risque de développer une insuffisance cardiaque de 5 %
chez l’homme et de 7 % chez la femme. Trois mécanismes
physiopathologiques sont à l’origine des effets délétères de
l’obésité sur la fonction ventriculaire gauche : l’augmentation
de la précharge ventriculaire secondaire à la majoration du
volume plasmatique induite par l’élévation de la masse grasse ;
l’augmentation de la post-charge ventriculaire gauche due à
l’association fréquente d’une hypertension artérielle à l’obésité,
générée par l’activation du système nerveux sympathique in-
duite par l’hyperinsulinisme ; l’altération des fonctions systoli-
ques et diastoliques, secondaire aux modifications de la géno-
mique myocardique et à la maladie coronarienne induite par
les facteurs de risque d’athérosclérose aggravés par l’obésité.
L’adipocyte sécrète de plus de nombreuses hormones pouvant
agir directement ou indirectement au niveau du myocarde :
angiotensine II, leptine, résistine, adrénoméduline, cytokines.
Ces modifications hémodynamiques et hormonales vont pro-
fondément modifier l’expression génique myocardique au cours
de l’obésité, favorisant l’apparition d’une hypertrophie myocy-
taire et d’une fibrose interstitielle. Qu’elle soit le plus souvent
excentrique, en l’absence d’HTA associée, ou concentrique en
présence d’une HTA, l’hypertrophie ventriculaire gauche au
cours de l’obésité, si elle normalise les contraintes pariétales, a
des conséquences délétères en entraînant une diminution de la
relaxation et de la compliance ventriculaire gauche. Chez
l’obèse, deux types d’insuffisance cardiaque sont ainsi possi-
bles. Le plus souvent, il s’agit d’une insuffisance cardiaque
diastolique, l’obésité étant une des principales causes d’insuffi-
sance cardiaque à fonction systolique d’éjection conservée.
Plus rarement, il s’agit d’une insuffisance cardiaque systolique
qui peut apparaître dans deux circonstances, soit en cas d’hy-
pertrophie ventriculaire gauche inadaptée ne permettant pas
de normaliser les contraintes pariétales, à l’origine de la car-
diomyopathie de l’obèse, soit en cas de maladie coronarienne
Tirés à part :
A. Pathak
Sang Thrombose Vaisseaux 2007 ;
19, n° 2 : 93-104
STV, vol. 19, n° 2, février 2007 93
doi: 10.1684/stv.2007.0063
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

associée. Quel qu’en soit le mécanisme, le diagnostic d’insuffi-
sance cardiaque est rendu difficile par l’obésité. Au plan
pronostique, au sein de la population des patients insuffisants
cardiaques, l’existence d’une obésité est associée à une amélio-
ration de la survie du fait du caractère délétère de la cachexie
mais majore cependant le risque de mort subite. En effet,
l’obésité est associée à une altération de la dynamique du QT.
En cas d’insuffisance cardiaque secondaire à une cardiomyo-
pathie de l’obèse, la réduction pondérale entraîne une amélio-
ration de la symptomatologie fonctionnelle et une diminution du
remodelage ventriculaire avec une majoration de la fraction
d’éjection.
Mots clés :obésité, HTA, hypertrophie ventriculaire gauche, insuffisance
cardiaque, mort subite
L’obésité constitue un facteur de risque car-
diovasculaire à part entière. Sa présence
augmente le risque de développer une in-
suffisance cardiaque. Ce risque est le plus
souvent attribué à l’existence de comorbidités ou de fac-
teurs de risque cardiovasculaire associés mais l’existence
d’une cardiopathie spécifique de l’obésité seule apparaît
comme une évidence clinique des plus probables. L’obésité
seule est capable précocement d’entraîner un remodelage
ventriculaire silencieux. Ces modifications asymptomati-
ques donneront au cours du temps des tableaux d’insuffi-
sance cardiaque diastolique, systolique ou mixte sympto-
matiques. Ces complications cardiovasculaires au cours de
l’obésité représentent la principale cause de mortalité des
obèses. La fréquence de l’obésité ne cessant de croître dans
notre pays, 11 % de nos concitoyens étant obèses et 41 %
étant obèses ou en surpoids, l’obésité deviendra dans les
prochaines années une des principales étiologies des patho-
logies cardiovasculaires.
Épidémiologie
L’obésité est un facteur de risque indépendant de la maladie
coronarienne, y compris les surcharges pondérales modé-
rées. Entre un sujet avec un index de masse corporelle
(IMC) normal et un patient dont l’obésité est morbide, la
prévalence de la maladie coronarienne double chez
l’homme et triple chez la femme. Une corrélation positive
existe entre le surpoids et l’incidence des accidents corona-
riens ainsi que la mortalité cardiovasculaire, même lorsque
l’on tient compte de la pression artérielle, de la cholestéro-
lémie, de l’intolérance aux hydrates de carbone et du taba-
gisme. De plus, l’obésité augmente le risque cardiovascu-
laire par son association aux autres facteurs de risques
reconnus : hypertension artérielle (HTA), insulinorésis-
tance, dyslipidémie et diabète. Le profil de répartition du
tissu adipeux, et plus spécifiquement la quantité de graisse
viscérale à l’origine de l’obésité androïde, majore les ano-
malies métaboliques associées à l’obésité et donc le risque
coronarien. Ainsi, un tour de taille supérieur à 100 chez
l’homme et à 94 chez la femme est associé à une augmenta-
tion du risque vasculaire.
L’obésité joue également un rôle important dans la genèse
de l’insuffisance cardiaque [1, 2]. L’obésité morbide, défi-
nie par un index de masse corporelle (IMC) supérieur à
40 kg/m
2
, est en effet reconnue comme un facteur de risque
cardiaque de longue date. Trois études de communauté ont
souligné le rôle joué par une élévation plus modérée de
l’IMC dans l’augmentation du risque d’insuffisance cardia-
que [3-5]. Mais c’est là encore l’étude de Framingham qui a
démontré que l’existence d’une surcharge pondérable supé-
rieure à 30 % du poids idéal double le risque d’apparition
d’une insuffisance cardiaque dans les deux sexes. Récem-
ment, une nouvelle analyse de ces données a révélé l’effet
délétère des surcharges pondérales moins marquées. Après
ajustement sur les facteurs de risque traditionnels, chaque
augmentation d’un point de l’IMC majore le risque de
développer une insuffisance cardiaque de 5 % chez les
hommes et de 7 % chez les femmes [1]. Par rapport aux
sujets à IMC normal (< 25 kg/m
2
), les patients obèses
(IMC > 30 kg/m
2
) ont 2 fois plus de risque de développer
une insuffisance cardiaque. Le risque d’apparition d’une
insuffisance cardiaque s’élève proportionnellement avec la
catégorie de l’IMC, normal, surcharge pondérale (IMC
compris entre 25 et 30 kg/m
2
), obésité, le risque relatif se
majorant significativement de 1,37 chez l’homme et de
STV, vol. 19, n° 2, février 2007
94
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

1,46 chez la femme pour chaque augmentation de catégorie
et cela indépendamment des autres facteurs de risque
d’athérosclérose. Seule l’existence d’une hypertension ar-
térielle diminue la force de cette relation unissant catégorie
d’IMC et risque d’insuffisance cardiaque. Ainsi, l’obésité
seule apparaît à l’origine de 11 % des cas d’insuffisance
cardiaque chez l’homme et de 14 % chez la femme aux
États-Unis.
Physiopathologie
Conséquences vasculaires de l’obésité
Le tissu adipeux, notamment viscéral, agit comme un tissu
actif doté de propriétés endocrines, capable de synthétiser
des facteurs athérogènes, pro-inflammatoires dont les taux
circulants sont influencés par l’état nutritionnel du patient,
la quantité et la localisation de la masse grasse. Les sécré-
tions adipocytaires faisant le lien entre obésité et maladies
vasculaires sont : l’adiponectine, l’endothéline, l’angioten-
sinogène et l’angiotensine 2, le tumor necrosis-factor
(TNF-a), l’interleukine-6 (IL-6) et le plaminogen activator
inhibitor type 1 [6]. Certains de ces peptides, comme l’an-
giotensine ou l’endothéline, possèdent un effet vasocons-
tricteur. Les peptides pro-inflammatoires, comme le TNF-a
ou les interleukines, provoquent des lésions vasculaires
diffuses capables d’entraîner à terme une dysfonction endo-
théliale et des lésions d’athérosclérose. L’IL-6, qui partage
les propriétés pro-inflammatoires du TNF-a, potentialise
ces dernières en stimulant la synthèse du fibrinogène par le
foie et en agissant directement sur les plaquettes pour
stimuler leur adhésion. Paradoxalement, l’adipocyte sé-
crète également des médiateurs dont les effets vasodilata-
teurs semblent bénéfiques (insuline, adrénomédulline). Les
complications associées à l’obésité surviennent dès lors
que le taux de ces peptides protecteurs diminue. Le méca-
nisme à l’origine de cette baisse reste inconnu. Récemment,
un taux bas d’adiponectine a été associé à un risque accru
de développer une HTA chez les patients obèses. Enfin, ces
peptides sont aussi capables d’altérer les voies métaboli-
ques glucidiques, avec développement d’une insulinorésis-
tance, notamment le TNF-a, ou les voies lipidiques (dysli-
pidémie mixte) qui contribuent à leur tour à aggraver les
lésions vasculaires.
La coactivation au cours des obésités, surtout viscérales,
d’autres systèmes dont les effets délétères sur les vaisseaux
sont bien connus, comme le système rénine-angiotensine-
aldostérone et le système sympathique, joue un rôle clé
dans la rétention hydrosodée, le décalage vers la droite de la
courbe pression sanguine artérielle-natriurèse et donc dans
l’élévation des chiffres tensionnels au cours de l’obésité.
De plus, les peptides sécrétés par les adipocytes, à côté de
leurs actions propres, possèdent des effets indirects sur ces
systèmes. Ainsi, la leptine vasodilatatrice, par l’intermé-
diaire d’une leptinorésistance, entraîne une vasoconstric-
tion périphérique avec dysfonction endothéliale et potentia-
lise l’effet vasoconstricteur de l’angiotensine 2, à côté de
ses effets sympatho-excitateurs et pro-inflammatoires par
majoration du stress oxydatif.
Hypertension artérielle et obésité
Les effets vasculaires des sécrétions adipocytaires, associés
à l’activation des systèmes sympathique et de la rénine-
angiotensine au cours de l’obésité, notamment androïde,
rendent compte de la fréquence de l’HTA au cours de
l’obésité, 30 % des obèses étant hypertendus. La relation
poids-pression artérielle, qui est du même ordre d’intensité
chez l’homme et la femme et qui diminue avec l’âge,
démontrée dans les études épidémiologiques transversales
et prospectives, est plus élevée en cas d’obésité androïde.
De plus, 30 % des hypertendus deviennent obèses, souli-
gnant le lien étroit qui existe entre ces deux maladies.
L’association à l’obésité androïde d’une HTA et d’anoma-
lies métaboliques (intolérance au glucose et dyslipidémie)
constitue le syndrome métabolique (autrefois syndrome X)
et contribue aux lésions vasculaires associées à l’obésité,
l’hyperinsulinisme secondaire à l’insulinorésistance étant
associé à une activation du système nerveux sympathique.
À côté de l’hyperactivité sympathique, on observe égale-
ment une diminution du tonus vagal. Cette anomalie se
retrouve dans un grand nombre d’affections cardiovasculai-
res (post-infarctus du myocarde, insuffisance cardiaque) et
s’associe à une augmentation de la morbimortalité cardio-
vasculaire. Nous avons montré sur un modèle de cardio-
myocytes auriculaires de rat que l’insuline, augmentée au
cours de l’obésité, est aussi capable directement de dimi-
nuer la réceptivité muscarinique, la transduction AMPc
dépendante de cette voie parasympathique cardiaque et ce,
de manière dose dépendante, par modulation de la voie des
MAP kinases [7].
Obésité, insuffisance cardiaque
et apnées du sommeil
L’obésité est la principale cause des apnées du sommeil,
70 % des apnées obstructives survenant chez des obèses.
Chez les sujets obèses et hypertendus, la prévalence des
apnées du sommeil peut atteindre 40 %. Les nombreuses
conséquences cardiovasculaires des apnées du sommeil
aggravent le pronostic des patients obèses, en favorisant
notamment l’apparition d’une hypertension artérielle. Il
existe en effet une relation linéaire entre la gravité du
syndrome apnéique et l’hypertension, chaque épisode ap-
STV, vol. 19, n° 2, février 2007 95
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

néique par heure augmentant les risques d’hypertension
d’un pour cent [8].
L’obstruction partielle du pharynx pendant les apnées obs-
tructives a des conséquences mécaniques, hémodynami-
ques et biologiques défavorables sur le système cardiovas-
culaire. Les efforts inspiratoires de lutte contre l’obstacle
pharyngé provoquent des chutes brutales de la pression
intrathoracique, une augmentation du retour veineux, un
déplacement du septum interventriculaire vers la gauche et
une élévation de la pression ventriculaire gauche transmu-
rale. L’hypoxie et les variations de la capnie majorent la
stimulation sympathique et réduisent le tonus vagal, en
stimulant les chémorécepteurs périphériques, provoquant
une vasoconstriction, l’augmentation des résistances péri-
phériques et de la post-charge ventriculaire, l’accélération
de la fréquence cardiaque. Le réveil majore les décharges
sympathiques et s’accompagne de fortes accélérations car-
diaques et de poussées tensionnelles. L’endormissement
entraîne un nouveau collapsus du pharynx et le cycle apnée-
réveil se reproduit plusieurs centaines de fois par nuit
soumettant l’ensemble du système cardiovasculaire à de
brutales décharges sympathiques, confirmées par les dosa-
ges des concentrations urinaires des catécholamines [9].
L’élévation de la pression artérielle et de la fréquence
cardiaque ne se limite pas à la période de sommeil et les
contrôles par enregistrements ambulatoires confirment des
élévations diurnes, délétères de ces paramètres. De plus,
des anomalies biologiques telles une augmentation du fibri-
nogène et de la viscosité sanguine, de la C réactive protéine,
de l’interleukine 6, ont été rapportées, proportionnelles à la
fréquence des apnées, ainsi que l’induction d’un stress
oxydatif, de l’expression des molécules d’adhésion CD15
et CD11c au sein des monocytes. La dysfonction endothé-
liale dans un contexte inflammatoire augmente les concen-
trations d’endothéline, favorisant l’hypertension artérielle
et l’athérogenèse. La succession d’épisodes d’hypoxie et de
réoxygénation a des conséquences endothéliales similaires
à celles des lésions de reperfusion avec l’expression de
radicaux libres, de molécules d’adhésion leucocytaires.
L’augmentation de la réactivité endothéliale peut faciliter
et accélérer les processus athérogènes [10]. Sur le plan
hémodynamique, l’élévation de la pression veineuse cen-
trale provoque un œdème péripharyngé augmentant la résis-
tance à l’influx aérien et créant un obstacle inspiratoire. De
même, les élévations réitérées de la post-charge et de la
contrainte pariétale, la tachycardie induite par la stimula-
tion sympathique, conjuguées à l’hypoxie et à l’augmenta-
tion de la consommation en oxygène myocardique aboutis-
sent à l’hypertrophie myocardique et au remodelage
ventriculaire gauche. L’augmentation du travail ventricu-
laire et des besoins métaboliques du myocarde alors que
l’apport en oxygène est diminué entraîne l’ischémie et la
dysfonction ventriculaire. La perte de poids peut en partie
normaliser ces anomalies dont le traitement standard reste
la pression positive expiratoire.
Conséquences hémodynamiques de l’obésité
L’obésité entraîne une élévation du débit cardiaque et une
expansion du secteur intravasculaire pour répondre à une
demande métabolique accrue liée à l’augmentation de la
masse grasse. La majoration du volume sanguin total est en
rapport avec une augmentation du lit vasculaire, essentiel-
lement au niveau du tissu adipeux. Le volume plasmatique
est ainsi élevé chez l’obèse. La fréquence cardiaque n’étant
pas modifiée, la majoration du débit cardiaque est essentiel-
lement secondaire à une augmentation du volume d’éjec-
tion systolique. L’élévation du débit cardiaque est en fait
proportionnelle à l’augmentation de la surface corporelle,
ainsi l’index cardiaque reste normal ou s’élève peu chez
l’obèse. Les résistances vasculaires systémiques sont dimi-
nuées chez l’obèse normotendu, ainsi que l’activité rénine
plasmatique.
L’association d’une hypertension artérielle à l’obésité mo-
difie le profil hémodynamique. En effet, les résistances
vasculaires systémiques, qui sont diminuées chez l’obèse
normotendu, sont normales ou discrètement élevées chez
l’obèse hypertendu. Le profil hémodynamique est cepen-
dant différent des patients hypertendus non obèses, où
existe une augmentation importance des résistances vascu-
laires systémiques. Ainsi, pour un même niveau tensionnel,
les résistances vasculaires systémiques sont plus basses
chez les sujets obèses que chez les sujets maigres.
Les perturbations neurohormonales induites par l’obésité
pourraient être à l’origine de ces altérations hémodynami-
ques [11]. Chez les patients obèses, la résistance à l’insu-
line et à la leptine, hormone sécrétée par les adipocytes,
associée à une suppression de l’activité biologique des
peptides natriurétiques et à l’activation du système rénine-
angiotensine tissulaire au sein du tissu adipeux, favorise la
rétention sodée qui entraîne une majoration du volume
plasmatique et donc du débit cardiaque [12]. Au cours de
l’obésité androïde, l’insulinorésistance, liée à l’augmenta-
tion de la graisse viscérale, en induisant un hyperinsuli-
nisme est à l’origine d’une activation du système nerveux
sympathique qui favorise l’apparition de l’hypertension
artérielle, en entraînant une vasoconstriction et une aug-
mentation de la rétention sodée [13]. Les effets de la leptine
et d’autres facteurs cardiaques comme l’ANP sur le sys-
tème nerveux sympathique pourraient également intervenir
sur le contrôle tensionnel [14].
Une découverte récente dans les dernières années permet de
faire le lien entre l’adipocyte et la cardiopathie de l’obèse.
STV, vol. 19, n° 2, février 2007
96
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.

C’est la découverte des propriétés lipolytiques de l’ANP
(atrial natriuretic peptide). Ce peptide vasodilatateur, diu-
rétique, bien connu des cardiologues (ancien facteur atrial
natriurétique), produit entre autres par le tissu auriculaire
est l’agent lipolytique le plus puissant, supplantant large-
ment l’effet lipolytique des catécholamines. Cet effet passe
par un récepteur membranaire couplé à la guanylyl cyclase
présent dans les adipocytes. On sait depuis que le BNP et le
CNP sont également capables d’agir sur ce récepteur et
d’entraîner une lipolyse. La pertinence physiopathologique
de cette observation est sujette à controverse. Pour certains
l’augmentation des taux de peptide natriurétique circulant
au cours de l’insuffisant cardiaque expliquerait les tableaux
de cachexie. Mais, au cours de l’obésité, les taux de BNP
sont paradoxalement bas, ceci se justifie par une augmenta-
tion de leur clairance. Cet effet pourrait en partie éclaircir la
propension plus marquée des sujets à développer une hyper-
tension artérielle ou une insuffisance cardiaque par défaut
de peptide vasodilatateur natriurétique. Il s’agit là d’une
piste à suivre [15].
Conséquences myocardiques de l’obésité
Modifications génomiques
Les modifications hémodynamiques et hormonales liées à
l’obésité vont profondément modifier l’expression du gé-
nome myocardique. À partir de banque d’ADNc ordonnés,
nous avons pu étudier les effets de l’obésité sur le profil de
l’expression génique cardiaque. Chez des animaux obèses
et hypertendus, très précocement avant que n’apparaisse
une hypertrophie ventriculaire gauche, nous avons pu mon-
trer que les voies de signalisations affectées convergeaient
vers l’augmentation du métabolisme énergétique mito-
chondrial, le remodelage de la matrice extra-cellulaire, les
marqueurs de prolifération, les flux ioniques, calciques et
sodiques, la voie du TGF bet TNF a[16]. Ce remodelage
varie au cours du temps et il existe une véritable cinétique
de remodelage moléculaire au cours de l’engraissement qui
explique en partie pourquoi l’exposition prolongée à une
obésité aggrave le pronostic cardiovasculaire [17]. Le re-
modelage matriciel et la prolifération préfigurent l’hyper-
trophie compensatrice future. La diminution de l’expres-
sion concomitante de SERCA et de phospholamban,
conjuguée à la diminution des pompes Na
+
/K
+
ATPase,
pourrait entraîner une surcharge calcique et sodique favori-
sant l’apparition d’une dysfonction diastolique. Au niveau
ventriculaire, ces modifications du transcriptome évoluent
profondément sur de courtes périodes, notamment la voie
TGF b[17]. Chez l’homme, l’étude comparative du profil
transcriptionnel cardiaque de patients obèses hypertendus
ou non, nous a permis de confirmer que l’obésité était
associée à un profil transcriptionnel propre (figure 1).
L’obésité et l’hypertension paraissent avoir des effets oppo-
sés sur la voie Wnt (figure 2) qui est impliquée dans le
développement cardiaque, ce qui pourrait être à l’origine
des réponses structurales différentes aux surcharges volu-
métriques et barométriques [18]. Une des hypothèses reste
le rôle d’une potentielle lipotoxicité qui expliquerait la
cardiopathie de l’obèse. Nous avons récemment démontré
que le cœur de l’obèse diabétique surexprime une nouvelle
lipoprotéine (Apo O), qui est responsable de l’épuration
tissulaire en favorisant l’efflux de cholestérol [19]. Cette
observation souligne l’existence d’une cardiopathie spéci-
fique qui nécessiterait une approche pharmacologique da-
vantage ciblée.
Modifications structurales
L’augmentation du volume sanguin total réalise une sur-
charge volumétrique qui, en entraînant une augmentation
du volume et des pressions télédiastoliques ventriculaires
gauches, conduit à une élévation de la précharge. Face à
cette augmentation chronique de la précharge, le cœur
s’adapte progressivement par une hypertrophie ventricu-
laire gauche de type excentrique. Celle-ci est caractérisée
par un épaississement modéré des parois, retrouvé tant au
niveau du septum que de la paroi postérieure, associé à une
augmentation du diamètre interne du ventricule gauche.
Bien que l’hypertrophie ventriculaire gauche soit particu-
lièrement fréquente chez les patients ayant une obésité
massive, cette hypertrophie semble dépendre davantage de
l’ancienneté et de la répartition de l’obésité que du degré de
surcharge pondérale. Au cours de l’étude de Framingham,
l’augmentation de l’IMC, après ajustement pour l’âge et la
pression sanguine artérielle, est apparue un facteur prédic-
teur indépendant d’hypertrophie ventriculaire gauche. La
prévalence de l’hypertrophie ventriculaire gauche détectée
par échocardiographie a été évaluée à 10 % parmi les sujets
présentant un surpoids et à 30 % chez les obèses.
L’association d’une hypertension artérielle à l’obésité en-
traîne une élévation de la post-charge. Face à cette augmen-
tation chronique de la post-charge, le cœur s’adapte par une
hypertrophie de type concentrique. Celle-ci est caractérisée
par un épaississement pariétal le plus souvent homogène
concernant le ventricule gauche de façon symétrique, le
septum comme le mur postérieur, associé à une diminution
du diamètre interne du ventricule gauche. Ainsi, chez
l’obèse le type d’hypertrophie ventriculaire gauche dépen-
dra à la fois de la surcharge pondérale et de l’hypertension
artérielle, de leurs sévérités et de leurs anciennetés. De
multiples autres facteurs déterminent le degré de l’hyper-
trophie comme l’âge, les facteurs génétiques et environne-
mentaux, la sensibilité du système sympathique, les pro-
STV, vol. 19, n° 2, février 2007 97
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 25/05/2017.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%