ecole nationale veterinaire d`alfort - Thèses

ECOLE NATIONALE VETERINAIRE D’ALFORT
Année 2002
RECOLTE DE LA SEMENCE DE CHAT (Felis catus) PAR
ELECTROEJACULATION ET PAR DISSECTION DE
L’EPIDIDYME.
Comparaison des méthodes
Essai de cryoconservation avec un dilueur canin
THESE
pour le
DOCTORAT VETERINAIRE
Présentée et soutenue publiquement
Devant
LA FACULTE DE MEDECINE DE CRETEIL
le
par
Stéphanie, Cyriane, Gisèle, Julienne Posière
Née le 08 janvier 1977 à Saint-Saulve (59)
JURY
Président : M.
Professeur à la Faculté de Médecine de CRETEIL
Membres
Directeur : M. Fontbonne
Maître de conférences à l’E.N.V.A.
Assesseur : M. Mouthon
Professeur à l’E.N.V.A.

A Monsieur de la faculté de médecine de Créteil qui nous a fait l’honneur d’accepter
la présidence de notre jury de thèse. Hommage respectueux.
A Monsieur Fontbonne, Maître de Conférences à l’Ecole Nationale Vétérinaire
d’Alfort qui a bien voulu accepter la responsabilité de notre travail, pour sa confiance, ses
conseils et sa sympathie. Hommage respectueux.
A Monsieur Mouthon, Professeur à l’Ecole Nationale Vétérinaire d’Alfort, qui a bien
voulu accepter la correction de notre travail et pour sa participation à notre jury de thèse.
Hommage respectueux.
A Sylvie Chastant, Maître de Conférences à l’Ecole Nationale Vétérinaire d’Alfort,
Elise Malandain, Docteur Vétérinaire, et Christian Dumon, Docteur Vétérinaire, pour leur
aide précieuse dans la réalisation de notre travail. Sincères remerciements.

A mes parents qui m’ont toujours soutenue, merci pour la vie que vous m’avez permis
de construire.
A Yann, avec tout mon amour.
A ma famille et ma belle-famille.
A mes amis.
A toute l’équipe de l’UMES et du CERCA pour leur sympathie et la passion pour
l’élevage des carnivores domestiques qu’ils ont su me communiquer.

TABLE DES MATIERES
FIGURES..................................................................................................................................5
PHOTOS...................................................................................................................................6
TABLEAUX..............................................................................................................................7
INTRODUCTION....................................................................................................................9
PREMIERE PARTIE : ETUDE BIBLIOGRAPHIQUE...................................................11
.1 RAPPELS D’ANATOMIE ET DE PHYSIOLOGIE.....................................................................13
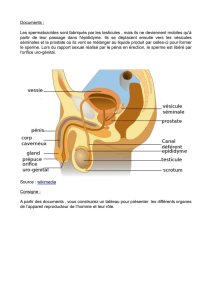
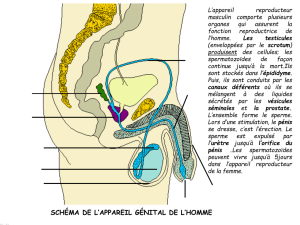
.1.1 Anatomie..................................................................................................................13
.1.1.1 Pénis..................................................................................................................13
.1.1.2 Testicules et épididyme.....................................................................................14
.1.1.3 Urètre ................................................................................................................14
.1.1.4 Les glandes annexes..........................................................................................14
.1.1.5 Innervation........................................................................................................17
.1.2 Physiologie .............................................................................................................. 17
.1.2.1 Puberté et saison sexuelle ................................................................................. 17
.1.2.2 La spermatogénèse............................................................................................19
.1.2.3 Erection.............................................................................................................21
.1.2.4 Ejaculation ........................................................................................................23
.1.2.5 Accouplement................................................................................................... 25
.2 TECHNIQUES DE PRELEVEMENT DU MALE........................................................................27
.2.1 Vagin artificiel.........................................................................................................27
.2.1.1 Environnement requis.......................................................................................27
.2.1.2 Technique..........................................................................................................27
.2.2 Electroéjaculation ...................................................................................................28
.2.2.1 La contention ....................................................................................................28
.2.2.2 Techniques décrites dans la littérature..............................................................29
.2.2.3 Ejaculation rétrograde.......................................................................................31
.2.3 Dissection de l’épididyme........................................................................................31
.2.3.1 L’épididyme est le lieu de maturation et de stockage des spermatozoïdes.......31
.2.3.2 Technique..........................................................................................................32
1

.3 SPERMOGRAMME ............................................................................................................ 32
.3.1 Etude macroscopique ..............................................................................................33
.3.1.1 Volume..............................................................................................................33
.3.1.2 Concentration....................................................................................................33
.3.1.3 Caractères physico-chimiques ..........................................................................33
.3.1.4 Plasma séminal..................................................................................................34
.3.2 Etude microscopique ............................................................................................... 34
.3.2.1 Morphologie des spermatozoïdes .....................................................................34
.3.2.2 Mobilité.............................................................................................................36
.3.2.3 Numération .......................................................................................................37
.3.2.4 Pourcentage de spermatozoïdes vivants............................................................38
.3.2.5 Anomalies : le spermocytogramme ..................................................................38
.3.2.6 Intégrité de l’acrosome .....................................................................................40
.3.2.7 Intégrité plasmatique : test hypo-osmotique.....................................................42
.3.2.8 Condensation de la chromatine.........................................................................42
.3.2.9 La transmigration membranaire........................................................................43
.3.3 Anomalies de la semence.........................................................................................43
.3.3.1 Anomalies primaires.........................................................................................44
.3.3.1.1 Anomalies liée à une cause anatomique........................................................44
.3.3.1.2 Anomalies liées à des troubles hormonaux...................................................44
.3.3.1.3 Anomalies liées au patrimoine génétique...................................................... 44
.3.3.1.4 Anomalies liées à l’âge..................................................................................45
.3.3.2 Anomalies secondaires......................................................................................45
.3.3.2.1 Anomalies liées aux glandes annexes ...........................................................45
.3.3.2.2 Anomalies liées à une pathologie urinaire ....................................................45
.3.3.2.3 Anomalies liées à un agent infectieux...........................................................45
.3.3.2.4 Anomalies liées à des affections de l’organisme...........................................45
.3.3.2.5 Anomalies iatrogènes....................................................................................46
.3.3.2.6 Anomalies idiopathiques...............................................................................46
.3.4 Caractéristiques de la semence obtenue dans la littérature selon la technique de
récolte utilisée....................................................................................................................46
.3.4.1 Caractéristiques moyennes de la semence obtenue par vagin artificiel dans la
littérature ........................................................................................................................46
.3.4.2 Caractéristiques moyennes de la semence obtenue par électroéjaculation dans la
littérature ........................................................................................................................47
2
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
1
/
100
100%