Partie A : Identification des molécules A et B 1. Propriétés des

Partie A : Identification des molécules A et B
1. Propriétés des molécules A et B.
1.1. Donner le nom de la fonction chimique présente dans les deux molécules A et B.
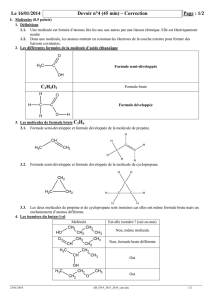
La fonction chimique présente dans les molécules A et B est la fonction ester.
1.2. Parmi les molécules A et B, l’une se nomme éthanoate de 3-méthylbutyle. Laquelle ? Justifier.
La molécule A se nomme éthanoate de 3-méthymbutyle : on reconnait la racine éthanoate, ainsi que le
groupe alkyle (butyle, 4 carbones sur la chaine principale du groupe) possédant une ramification
méthyle en position 3.
(NB : la molécule B s’appelle 2-méthylbutanoate d’éthyle)
1.3. Quel lien y a-t-il entre les deux molécules A et B ? Justifier.
Ces deux molécules sont isomères, de formule brute C6H14O2. Ce sont des isomères de constitution
(position de la fonction ester qui change)
1.4. La molécule A présente-t-elle un (ou des) carbones asymétriques ? Si oui, le (ou les) matérialiser sur
votre copie à l'aide d'un astérisque (*).
La molécule A ne possède pas de carbone asymétrique.
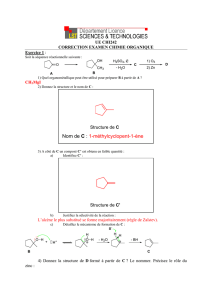
1.5. Donner le nom du type de stéréoisomérie de configuration qui lie les composés B1 et B2. Justifier.
Ces molécules B1 et B2 sont liées par une relation d’énantiomérie : en effet, ces deux molécules
possèdent le même enchainement d’atomes, dont un carbone asymétrique. Pour la molécule B1, le
groupe méthyle du carbone asymétrique est vers l’avant (et l’hydrogène vers l’arrière) alors que pour
la molécule B2, ce même méthyle est vers l’arrière (et l’hydrogène vers l’avant), elles sont images l’une
de l’autre dans un miroir.
B1
B2
CH3
CCC
O
OCH2CH3
HH
CH3H
CH3
CCC
O
OCH2CH3
HH
HCH3
*
*
CH3
CH2CC
O
OCH2
HCH3
CH3CH3
CH2
C
C
O
O
CH2
CH3
CH3
H
CH3
CH2CC
O
OCH2CH3
CH3H
B1
B2

Partie B : Synthèse de la molécule A
2. Donner le nom et la formule du produit manquant dans l'équation :
Globalement, de quel type de réaction s’agit-il ?
Globalement cette réaction est une substitution.
3. Pour que la réaction se déroule en un temps relativement court, la présence de l'acide sulfurique est
impérative. Sachant que l'acide sulfurique n'intervient pas dans le bilan réactionnel, déduire son rôle.
L’acide sulfurique est un catalyseur de la réaction : il accélère la vitesse de la réaction.
4. Étude du mécanisme de la réaction d'estérification.
4.1. Indiquer dans le tableau donné en ANNEXE À RENDRE AVEC LA COPIE le type de réactions
correspondant aux étapes 2 et 4 du mécanisme.
substitution élimination addition
Étape 2 X
Étape 4 X
4.2. Dessiner les flèches courbes schématisant les transferts électroniques pour chacune des cinq étapes.
CH3
C
O
OCH2CH2
CH CH3
CH3
CH3
C
O
OH +OH CH2
CH2CH CH3
CH3
+
H2O
1
/
2
100%