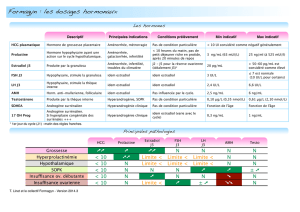
Mise en place et évaluation des dosages sériques de l`estradiol, de

Mise en place et ´evaluation des dosages s´eriques de
l’estradiol, de la progest´erone et de l’hormone
lut´einisante sur l’analyseur Dimension Vista (Siemens) :
application aux dosages urinaires de l’estradiol et de
l’hormone lut´einisante chez la femme au cours de l’aide
m´edicale pour la procr´eation
Hadrien Maguet
To cite this version:
Hadrien Maguet. Mise en place et ´evaluation des dosages s´eriques de l’estradiol, de la pro-
gest´erone et de l’hormone lut´einisante sur l’analyseur Dimension Vista (Siemens) : application
aux dosages urinaires de l’estradiol et de l’hormone lut´einisante chez la femme au cours de
l’aide m´edicale pour la procr´eation. Sciences pharmaceutiques. 2015. <dumas-01216528>
HAL Id: dumas-01216528
https://dumas.ccsd.cnrs.fr/dumas-01216528
Submitted on 16 Oct 2015
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-
entific research documents, whether they are pub-
lished or not. The documents may come from
teaching and research institutions in France or
abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est
destin´ee au d´epˆot et `a la diffusion de documents
scientifiques de niveau recherche, publi´es ou non,
´emanant des ´etablissements d’enseignement et de
recherche fran¸cais ou ´etrangers, des laboratoires
publics ou priv´es.


AVERTISSEMENT
Ce document est le fruit d'un long travail approuvé par le
jury de soutenance et mis à disposition de l'ensemble de la
communauté universitaire élargie.
Il n’a pas été réévalué depuis la date de soutenance.
Il est soumis à la propriété intellectuelle de l'auteur. Ceci
implique une obligation de citation et de référencement
lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite
encourt une poursuite pénale.
Contact au SICD1 de Grenoble : thesebum@ujf-grenoble.fr
LIENS
LIENS
Code de la Propriété Intellectuelle. articles L 122. 4
Code de la Propriété Intellectuelle. articles L 335.2- L 335.10
http://www.cfcopies.com/juridique/droit-auteur
http://www.culture.gouv.fr/culture/infos-pratiques/droits/protection.htm

1
UNIVERSITE JOSEPH FOURIER
FACULTE DE PHARMACIE DE GRENOBLE
Année : 2015 N°
Mise en place et Evaluation des dosages sériques de l’estradiol, de la progestérone et de l’hormone
lutéinisante sur l’analyseur Dimension Vista (Siemens).
Application aux dosages urinaires de l’estradiol et de l’hormone lutéinisante chez la femme au cours
de l’aide médicale pour la procréation
MEMOIRE
DU DIPLOME D’ETUDES SPECIALISEES DE :
Conformément aux dispositions du décret N° 90-810 du 10 septembre 1990, tient lieu de
THESE
Présentée à la Faculté de Pharmacie de GRENOBLE
Et soutenue publiquement le : 9 Octobre 2015
Pour obtenir le grade de DOCTEUR EN PHARMACIE
Par : Hadrien MAGUET
Né (e) le : 3 Mars 1986
A Montpellier
JURY
MEMBRES :
Président : Monsieur le Professeur P.FAURE
Madame le Professeur P.HOFFMANN
Monsieur le Docteur F.LAPORTE (directeur de thèse)
Madame le Docteur D.GUERGOUR.
La faculté de Pharmacie de Grenoble n’entend donner aucune approbation ni improbation aux
opinions émises dans les thèses ; ces opinions sont considérées comme propres à leurs auteurs.

2
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
1
/
89
100%