Vigilances - IFSI PSL 11 2014bis

Hôpitaux universitaires PSL-CFX– Direction qualité – Gestion des risques - Relations usagers
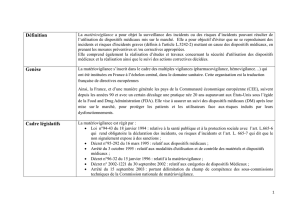
Les vigilances
IFSI novembre 2014

2
Quelques définitions (1)
Définition du Petit Robert : « surveillance attentive et sans
défaillance »
Vigilances sanitaires = système de surveillance de santé
publique
Définitions différentes en fonction de la vigilance
Outils et méthodologies différents en fonction des particularités (critères
d’évaluation, fiche de recueil,…)
Signalements des évènements indésirables et des incidents
Liés à l’utilisation de produits de santé
Dans le but de prévenir les risques

3
Quelques définitions (2)
Bonnes pratiques
Ensemble des exigences ou recommandations de la fabrication à l’utilisation finale
Objectif :
apporter un maximum de garanties au niveau de la sécurité
Évaluer les risques liés aux pratiques et aux produits de santé
Effet indésirable
Réaction nocive et non recherchée survenant chez l’Homme
Définition adaptée pour chaque vigilance
Recommandations
Résolution émise par une autorité de santé ou une institution internationale
Objectifs :
Guide d’utilisation des produits de santé
Interprétation ou explicitation de textes législatifs ou réglementaires

4
Le champs des vigilances
Sous contrôle de l’ANSM
(agence nationale de sécurité du médicament et des
produits de santé)
Les médicaments : pharmacovigilance
Les produits sanguins labiles : hémovigilance
Les dispositifs médicaux : matériovigilance
Les dispositifs médicaux diagnostics in vitro : réactovigilance
Les greffes : biovigilance
Les produits cosmétiques : cosmétovigilance
Les produits de tatouage : vigilance des produits de tatouages
Autres
Risque liés aux produits / matériels ionisants : La radioprotection IRSN/ASN
Les infections nosocomiales : infectiovigilance
Les produits alimentaires – l’alimentation nutrition : nutrivigilance
L’identité des patients : identitovigilance
L’aide à la procréation assistée : AMP vigilance

5
Les vigilances – Contexte législatif et règlementaire
Loi du 1er juillet 1998 relative au renforcement de la veille sanitaire et de la
sécurité sanitaire des produits de santé destinés à l’homme :
InVs : institut nationale de veille sanitaire
LOI n°2011-2012 du 29 décembre 2011 relative au renforcement de la
sécurité sanitaire du médicament et des produits de santé
Refonder le système de sécurité sanitaire des produits de santé pour concilier sécurité des
patients et accès au progrès thérapeutique
Renforcement de la transparence des liens entre les industriels et les experts restaurer la
confiance du public
Création de l’ANSM à la place de l’AFSSPS :
évaluer les bénéfices et les risques des produits, surveiller le risque tout au long de leur cycle de vie et
réaliser régulièrement des réévaluations des bénéfices et des risques
Pouvoir de prononcer des sanctions financières
Renforcement de la pharmacovigilance
Création de recommandations temporaires d’utilisation élaborées par l’ANSM
Ordonnance n°2013-1183 du 19 décembre 2013
relative à l'harmonisation des
sanctions pénales et financières relatives aux produits de santé et à l'adaptation des prérogatives des
autorités et des agents chargés de constater les manquements
Décret du 31/01/2013 : (…) « Le texte crée une amende de cinquième classe (1.500 euros)
pour défaut de signalement de pharmacovigilance, de matériovigilance et de réactovigilance
par un professionnel de santé » (…).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
1
/
35
100%