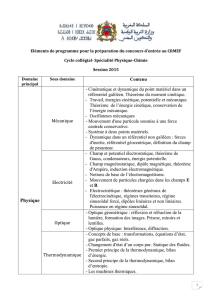
Premier principe

INTRODUCTION au PREMIER PRINCIPE de la THERMODYNAMIQUE
Le premier principe de la thermodynamique rend compte des échanges énergétiques entre un système et son
milieu extérieur. Il s’adresse plus généralement à des systèmes fluides. Il s’agit bien d’un principe et non d’une
démonstration ; il permet de comprendre le fonctionnement des machines thermiques comme le moteur à explosion ou le
réfrigérateur, ou plus généralement de comprendre l’évolution en température d’un système qui échange soit du travail soit
de la chaleur.
Travail, chaleur et énergie interne sont les termes utilisés dans le premier principe ; il faut les comprendre dans
le sens très précis que leur donne la thermodynamique.
Travail : le sens est le même qu’en mécanique ; le travail est lié au déplacement macroscopique d’une force.
Chaleur : en thermodynamique, la chaleur désigne exclusivement une quantité d’énergie sans aucun déplacement
macroscopique. C’est un travail de forces microscopiques dont le déplacement n’est pas visible. Attention à ne pas
confondre chaleur et température ; on ne parle pas de chaleur de la salle mais de température de la salle. Par contre, on
peut dire que la chaleur passe spontanément d’un corps chaud à un corps froid : il s’agit de transfert thermique. Il
faut d’ailleurs une différence de température entre le système et le milieu extérieur pour avoir transfert de chaleur (ç-
à-d transfert thermique).
Le transfert thermique de fait de 3 façons :
• par convection lorsqu’à l’intérieur du système le fluide peut circuler, se réchauffant au contact d’une paroi
chaude et transporte l’énergie vers un autre endroit du système plus froid. C’est le cas de l’air d’une pièce
contenant des radiateurs.
• par rayonnement ; la matière émet en permanence un rayonnement électromagnétique dont l’intensité et la
longueur d’onde dépendent de la température de surface. C’est ainsi que notre joue sent la chaleur du
rayonnement du soleil. De même notre corps rayonne de l’infrarouge et un ensemble de personnes réchauffe
l’air d’une pièce fermée .
• par conduction : sans déplacement de matière, l’énergie se transmet par contact, de proche en proche et se
propage. On sait bien par expérience qu’il est préférable pour ne pas se brûler de faire les confitures avec une
cuiller en bois plutôt qu ‘avec une cuiller en métal.
Energie :L’énergie est présente dans les systèmes mais on ne peut pas la voir ni la toucher. On peut seulement
observer les effets que provoque son transfert d’un système à un autre. En mécanique on connaît déjà l’énergie
cinétique et l’énergie potentielle. L’énergie interne est spécifique au premier principe et sera précisée plus loin.
Pour comprendre l’énoncé du premier principe, partons du théorème de l’énergie cinétique : dEC = δWtotal
Ce théorème nous apprend que l’énergie cinétique varie grâce au travail de toutes les forces agissant sur tout le système.
Si parmi ces forces on sépare celles qui sont conservatives, alors on peut écrire dEm = δWnon pot . Il est commode
d’introduire l’énergie mécanique, somme de l’énergie cinétique et de l’énergie potentielle car sa variation est due au
travail des forces non conservatives, par exemple de type frottement. On sait bien que l’énergie mécanique diminue à
cause des frottements.
Appliquer ce théorème de l’énergie cinétique suppose qu’on choisit un point de vue mécanique du système. Cela sous-
entend :
• un nombre limité de particules à considérer dans le système
• position et vitesse mesurables pour ces particules, donc pas d’agitation désordonnée , donc pas de notion de
température
• pas de transfert thermique
Cette vision est possible pour des systèmes solides pour lesquels on s’intéresse uniquement au mouvement d’ensemble ;
cas d’une voiture, de la masse accrochée à un ressort…
Ce point de vue ne convient plus pour les systèmes fluides et le point de vue thermodynamique devient indispensable.
Pourquoi ? Parce que le système fluide signifie :
• un nombre illimité de particules dans le système; ce sont les molécules d’un gaz par exemple
• position et vitesse de chaque molécule ne sont plus mesurables
• les molécules sont agitées en permanence ; on parle d’énergie d’agitation thermique liée à la température
• des transferts thermiques peuvent exister
La vie quotidienne nous montre que l’énergie d’un système fluide peut varier sans qu’il reçoive de travail du milieu
extérieur. Il suffit de chauffer suffisamment l’eau d’une casserole pour voir celle-ci se mettre en ébullition et provoquer
parfois quelques soubresauts du couvercle. La chaleur se nomme aussi transfert thermique.
Le premier principe de la thermodynamique s’écrit : dEC macro + dU = δWext + δQext
Précisons tout de suite la notation qu’il faudra à tout prix respecter : d signifie petite variation
δ signifie petite quantité

Comme tout principe il ne se démontre pas mais on peut en comprendre le sens à partir du théorème de l’énergie
cinétique. Quelle en est la différence ?
D’abord le terme de transfert thermique (ou chaleur) δQext est rajouté ; il n’existe pas dans une vision mécanique des
échanges énergétiques.
On retrouve la variation d’énergie cinétique dans dE C macro . L’indice macro veut rappeler qu’il s’agit de mouvement
d’ensemble (dû à un transport visible ou macroscopique du système).
δWtotal a été séparé en 2 termes : le travail de toutes les forces intérieures et celui des forces extérieures. Ce dernier est
entièrement décrit par le terme δWext. (δWint n’apparaît pas explicitement car il est en fait contenu dans dU).
Il reste le terme dU : il contient toutes les formes d’énergie intérieures au système : en font donc partie le travail des
forces intérieures précédemment cité et surtout toute l’énergie cinétique microscopique des molécules due à
l’agitation thermique. C’est la raison pour laquelle U s’appelle énergie interne du système. .
Dans la vision mécanique on ne parle pas d’énergie cinétique microscopique car on suppose qu’elle ne varie pas, la
température étant supposée constante. C’est pourquoi le terme U n’a pas de raison d’être en mécanique et n’apparaît
pas dans le théorème de l’énergie cinétique.
Précision sur la variation d’énergie interne dU :
• comme dU contient le travail des forces intérieures, on peut se questionner sur la façon dont ce travail peut
être introduit dans une fonction différentiable comme dU ; la raison est que les forces intérieures pour un
système fluide sont de nature électrostatiques et la thermodynamique postule que le travail de ces forces
microscopiques d’interaction dérive d’une énergie potentielle. Cela veut donc dire que ce travail peut se
mettre sous la forme d’une différentielle (rappel : δW = - dEp).
• on en déduit que pour le gaz parfait l’énergie interne se réduit à l’énergie cinétique microscopique
puisque par définition ce modèle néglige toute interaction entre molécules.
• dans le cas très particulier d’un ressort comme système, le travail des forces intérieures est l’opposé de la
variation d’énergie potentielle d’élasticité. L’énergie U d’un ressort est donc la somme de l’énergie
potentielle d’élasticité et des énergies cinétiques microscopiques des atomes du ressort (négligées dans le cas
du ressort ; puiqu’il est solide, les atomes bougent peu).
Précision sur l’énergie cinétique microscopique : ne pas la confondre avec l’énergie cinétique d’ensemble.
• Par exemple une bouteille remplie de gaz et posée sur la table n’a pas d’énergie cinétique d’ensemble mais
possède une énergie cinétique microscopique puisqu’ à l’intérieur de la bouteille les molécules sont en
perpétuelle agitation. Cette énergie est donc toujours présente et on devine qu’elle augmente avec la
température.
En résumé, le premier principe de la thermodynamique s’écrit : dEC macro + dU = δWext + δQext
- dU et δQext sont donc les termes nouveaux et essentiels du bilan énergétique de thermodynamique. Ils
désignent pour dU la variation d’énergie interne du système et pour δQext le transfert de chaleur avec
l’extérieur.
- L’énergie interne U contient toute forme d’énergie intérieure au système dont le terme nouveau d’énergie
cinétique microscopique ( ou d’agitation thermique) .
- dEC macro décrit la variation d’énergie cinétique d’ensemble.
- δWext est le travail mécanique échangé entre le système et le milieu extérieur.
- On respectera la notation d pour décrire une petite variation et δ pour désigner une petite quantité.
- Ne jamais dire variation de travail ou variation de chaleur. Chaleur et travail sont des quantités échangées.
- Lors d’une transformation globale ( non petite) on écrira le premier principe en respectant la notation Δ pour
une variation globale et pas de notation supplémentaire pour une quantité globale échangée. Ainsi le premier
principe s’écrit pour un bilan global ΔEC macro + ΔU = Wext + Qext
- Enfin les cas sont très fréquents où le mouvement d’ensemble est nul ou négligeable ; on retiendra alors le
premier principe
simplifié
dU = δWext + δQext
En dernier point la question délicate des frottements : en mécanique la force de frottement est un concept qui permet
de décrire l’évolution du système. On remarque que l’énergie mécanique diminue à cause des frottements ; c’est pour
cela qu’on introduit une force dite de frottement dont le travail est négatif.
En thermodynamique il n’y a plus lieu d’écrire ce terme de travail de force de frottement car les frottements sont dus
en réalité à un déplacement microscopique des forces d’interaction entre les atomes ou molécules dont l’assemblage
se déforme à cause de ces frottements. Comme il s’agit de forces intérieures , ce travail est dans la vision
thermodynamique pris en compte dans la variation de l’énergie interne U. On ne parlera donc pas de force de
frottement en thermodynamique.

1
/
3
100%