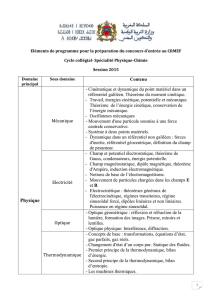
lp n°13 : modele du gaz parfait : interpretation

LP N°13 : MODELE DU GAZ PARFAIT : INTERPRETATION MICROSCOPIQUE
DE LA PRESSION ET DE LA TEMPERATURE. LIMITATIONS DU MODELE.
(MPSI, PCSI)
Rapport de jury :
Cette leçon nécessite d’avoir bien réfléchi à la logique de la démarche adoptée. On ne doit pas se limiter
au seul cas du Gaz parfait monoatomique. L’interprétation cinétique de la notion de Température est
souvent confuse en particulier dans le cas des gaz parfait polyatomiques. Les conditions d’utilisation ou
d’applications du théorème d’équipartition de l’énergie et la définition légale de la température doivent
être connues.
INTRODUCTION
I Le modèle du gaz parfait :
1. Définition
2. Hypothèses statistiques :
Définition du libre parcours moyen
Chaos moléculaire
Homogénéité de la densité particulaire
Définition de la vitesse quadratique moyenne
II La théorie cinétique :
1. Interprétation cinétique de la pression
2. Equation d’état, Température cinétique
3. Energie interne :
Energie cinétique des molécules du gaz
Energie potentielle d’interaction
Energie interne
4. Cas des gaz polyatomiques
5. Loi générale aux gaz parfaits
III Limites du modèle :
1. Modèle de Van Der Waals
2. Développement du Viriel
CONCLUSION
Bibliographie :
Hprépa : thermodynamique : 1er année.
Pérez : thermodynamique.
Faroux-Renault : thermodynamique
1
/
1
100%