Classification périodique des éléments

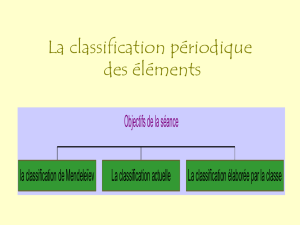
La classification périodique des éléments
I) Introduction : la classification historique de Mendeleiev :
La chimie est une science très récente, au regard d'autres domaines scientifiques comme les
mathématiques et la physique, déjà très développées dans l'antiquité. La chimie, elle, s'est
réduite à l'alchimie jusqu'au début du 18
ème
siècle ; ce n’est qu’à partir de ce moment qu’elle a
acquis une rigueur scientifique, grâce notamment aux travaux de Lavoisier.
La découverte de nouveaux éléments chimiques a suivi cette évolution, et s'est faite de façon
très irrégulière dans l'histoire de la chimie. Les premiers éléments connus le sont depuis très
longtemps ; dans l'antiquité, 10 éléments l'étaient déjà : des métaux principalement : fer,
plomb, or, argent, cuivre, étain, antimoine, mercure et deux autres éléments : le carbone
et le soufre.
Pendant plusieurs siècles ensuite, rien ou presque n'a changé : au moyen-âge, seuls 2 éléments
supplémentaires avaient été découverts : le zinc et l’arsenic. En 1750, le nombre des éléments
connus s'élevait à 15 (+ Co, P et Pt). A ce moment là, la découverte s'accélère : 16 nouveaux
éléments découverts entre 1751 et 1800 (H, N, O, Cl, Ti, Cr, Mn, Ni, Y, Zr, Mo, Te, Ba, W,
Bi, U), 54 entre 1800 et 1900. Depuis, la découverte de nouveaux éléments ne s'est jamais
interrompue.
Depuis le 18
ème
siècle, le nombre d’éléments découverts augmentant, la volonté de classer ces
éléments est apparue. Les travaux les plus marquants ont été ceux de Mendeleiev en 1869 qui
a été le premier a fournir un système de classement fonctionnel.
Principe de classement de Mendeleiev :
H
Li Be B C N O F
Na Mg
Al Si P S Cl
K Ca As Se Br
Te I
Version (simplifiée !) proposée par Mendeleiev
Preuves du génie de Mendeleiev :

II) La classification actuelle :
1. Principe de construction :
Principes de classement :
Construction :
1
ère
étape : dénombrement
n= 1
n= 2
n = 3
n = 4
2
ème
étape : ajustement des configurations électroniques
n= 1
n= 2
n = 3
n = 4

3
ème
étape :
s
1
s2
d
1
d
2
d
3
d
4
d
5
d
6
d
7
d
8
d
9
d
10
p
1
p
2
p
3
p
4
p
5
p
6
n= 1
n= 2
n = 3
n = 4
n = 5 Ag I
n = 6
n = 7
Exceptions :
Les exceptions à la règle de Klechkowski n’apparaissent pas dans le tableau. Ainsi, dans la
colonne d
9
, la configuration réelle du cuivre est [Ar] 3d
10
4s
1
Comparaison classification actuelle/ classification historique :

2. Utilisation :
Détermination d’une configuration électronique sans connaître le numéro atomique :
Cas de l’iode I
Trouver un élément connaissant sa configuration électronique :
Cas de 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
10
4p
2
Trouver le numéro atomique d’un élément connaissant sa place dans le tableau
Cas de l’argent Ag
3. Structure en blocs :
La classification périodique peut être divisée en blocs. Chaque bloc correspond au
remplissage d’un type de sous-couche.
Elément de transition :
Métaux et non métaux :

Position dans la classification :
4. Quelques familles particulières :
Les gaz nobles ou gaz rares :
règle de l’octet :
Les alcalins
Les alcalino-terreux :
Les halogènes :
III) Evolution de quelques propriétés atomiques dans la classification :
1. Energie d’ionisation :
 6
6
 7
7
 8
8
 9
9
1
/
9
100%