le cycle de krebs (1)

1/9 www.mediprepa.com
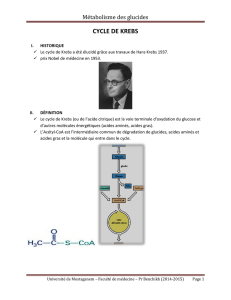
LE CYCLE DE KREBS (1)
Le cycle de Krebs, encore appelé cycle de l’acide citrique ou cycle de l’acide tricarboxilique
constitue la dernière étape commune au catabolisme des glucides, des acides gras et des acides aminés
(Figure 1).
Figure 1 : Le cycle de Krebs est la dernière étape de la dégradation des aliments.
Le cycle de Krebs représente la principale source d’énergie de la cellule. En effet, au cours de ce cycle
sont produits des transporteurs d’hydrogène (NADH et FADH2) qui par réoxydation au niveau des
chaînes d’oxydations cellulaires vont permettre la production d’ATP qui est la forme de réserve de
l’énergie cellulaire. Le cycle se déroule dans la matrice mitochondriale en huit étapes dont le point
d’entrée est l’acétyl coenzyme A. Nous verrons en détail chaque étape du cycle ainsi que ses différents
points de régulation avant d’en faire le bilan énergétique.
I. L’ACETYL COENZYME A : POINT D’ENTREE DU CYCLE DE KREBS.
L’Acétyl coenzyme A (Acétyl CoA) est formé à partir du pyruvate qui est le produit final de la glycolyse
et de coenzyme A (CoASH). La réaction peut s’écrire de manière simplifiée :
Pyruvate + CoASH + NAD+ Acétyl CoA + CO2 + NADH + H+.
Dans la réalité, cette réaction se déroule en plusieurs étapes et fait intervenir un complexe
multienzymatique : Le complexe de la pyruvate déshydrogénase.
glucose lipides
glycolyse
acides aminés
catabolisme
des acides aminés
Acétyl Coenzyme A
Chaînes
d’Oxydations
Cellulaires ATP
β-oxydations
Cycle
De
Krebs
glucose lipides
glycolyse
acides aminés
catabolisme
des acides aminés
Acétyl Coenzyme A
Chaînes
d’Oxydations
Cellulaires ATP
β-oxydations
Cycle
De
Krebs
Cycle
De
Krebs
Cycle
De
Krebs

2/9 www.mediprepa.com
A. Le complexe de la pyruvate déshydrogénase.
Ce complexe se compose de trois enzymes et de leurs cofacteurs :
E1 : La pyruvate déshydrogénase + thiamine pyrophosphate (TPP).
E2 : La dihydrolipoyl transacétylase + lipoamide.
E3 : La dihydrolipoyl déshydrogénase. + FAD.
La première étape est la décarboxylation du pyruvate par E1 après qu’il se soit combiné au TPP
pour former l’hydroxyéthyl thiamine pyrophosphate selon la réaction suivante :
Pyruvate + TPP hydroxyéthyl –TPP + CO2
O O R O O R R
C N – C - CH3 C N - C - CH3 N+ – C – CH3
O = C + H - C HO – C – C HO – C- – C
CH3 S - C CH3 S – C CO2 CH3 S – C
R’ R’ R’
Pyruvate TPP Hydroxyéthyl –TPP
Le groupement hydroxyéthyle est ensuite oxydé en groupe acétyle et transféré sur le lipoamide de
E2 pour former l’acétyllipoamide :
OH CH3
CH3 - C- C = O
TPP + S S TPP + HS S
CH2 CH – R CH2 CH – R
CH2 CH2
Hydroxyéthyl –TPP Lipoamide Acétyllipoamide
Le groupement acétyle est alors transféré par la dihydrolipoyl transacétylase de l’acétyllipoamide
vers le coenzyme A pour former l’acétyl coenzyme A :
CH3
C = O
HS S HS SH CH3
CH2 CH – R + HS – CoA CH2 CH – R + C = O
CH2 CH2 S- CoA
Acétyllipoamide Coenzyme A Dihydrolipoamide Acetyl CoA

3/9 www.mediprepa.com
La dernière étape est la régénération de la forme oxydée du lipoamide par la dihydrolipoyl
déshydrogénase avec formation d’un transporteur d’hydrogène réduit (NADH) :
HS SH S S
CH2 CH – R + NAD+ CH2 CH – R + NADH + H+
CH2 CH2
Dihydrolipoamide Lipoamide
La figure 2 schématise le mode d’action du complexe de la pyruvate déshydrogénase.
Figure 2 : Mode d’action du complexe de la pyruvate déshydrogénase.
CH3 –C - COOH
O
CO2
CH3 – C - TPP
OH
TPP
Pyruvate
Deshydrogénase
(E1)
LS– C - CH3
SH
O
LS
S
LSH
SH
Dihydrolipoyl
transacétylase
(E2)
CoA - SH
CH3 – C -S -CoA
O
Acétyl CoA
FAD
FADH2 Dihydrolipoyl
déshydrogénase
(E3)
NADH+ H
+
NAD+
pyruvate
Hydroxyéthyl - TPP
lipoamide
acétyllipoamide
dihydrolipoamide Coenzyme A
3 Enzymes
3 Cofacteurs
2 Cosubstrats
CH3 –C - COOH
O
CH3 –C - COOH
O
CO2
CH3 – C - TPP
OH
CH3 – C - TPP
OH
TPP
Pyruvate
Deshydrogénase
(E1)
LS– C - CH3
SH
O
LS– C - CH3
SH
O
LS
S
LS
S
LSH
SH
Dihydrolipoyl
transacétylase
(E2)
CoA - SH
CH3 – C -S -CoA
O
CH3 – C -S -CoA
O
Acétyl CoA
FAD
FADH2 Dihydrolipoyl
déshydrogénase
(E3)
NADH+ H
+
NAD+
pyruvate
Hydroxyéthyl - TPP
lipoamide
acétyllipoamide
dihydrolipoamide Coenzyme A
3 Enzymes
3 Cofacteurs
2 Cosubstrats

4/9 www.mediprepa.com
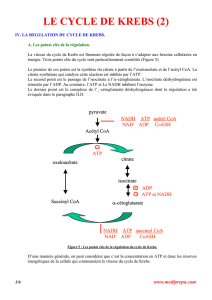
B. La régulation du complexe de la pyruvate déshydrogénase.
La production de l’acétyl CoA à partir du pyruvate étant un processus irréversible chez les
animaux, c’est une étape qui nécessite un contrôle strict afin de ne pas gaspiller de l’énergie en
puisant dans les réserves de glucose (précurseur du pyruvate) alors que l’organisme n’en éprouve
pas le besoin. Le complexe de la pyruvate déshydrogénase est régulé à différents niveaux.
Tout d’abord il est régulé par les produits de la réaction. Ainsi, des rapports acétyl CoA/CoASH
ou NADH/NAD+ élevés inhibent le complexe. L’acétyl CoA inhibe la dihydrolipoyl transacétylase
tandis que le NADH inhibe la dihydrolipoyl déshydrogénase.
L’activité du complexe est également réduite lorsque la cellule dispose d’énergie en quantité
suffisante. Le GTP inhibe la pyruvate déshydrogénase alors que l’AMP l’active.
Enfin, la pyruvate déshydrogénase existe sous deux formes : Une forme inactive lorsqu’elle est
phoshorylée par une kinase au niveau d’une sérine et une forme active déphosphorylée. La
phosphorylation est augmentée par des rapports ATP/ADP, acétyl CoA/CoASH et NADH/NAD+
élevés, elle est inhibée par le pyruvate. La déphosphorylation nécessite l’action d’une phosphatase
en présence de Ca2+. L’insuline stimule également la déphoshorylation.
II. LES DIFFERENTES ETAPES DU CYCLE DE KREBS.
Une fois l’acétyl CoA produit, il va pouvoir alimenter le cycle de Krebs et ses huit étapes que nous allons
détailler maintenant. Tout au long du cycle nous pourrons suivre le devenir des atomes de carbone issus
de l’acétyl CoA et donc du pyruvate en signalant ces derniers par une couleur rouge.
A. Condensation de l’acétyl CoA et de l’oxaloacétate.
La condensation de l’acétyl CoA et de l’oxaloacétate est catalysée par la citrate synthétase. Cette
réaction est irréversible. L’oxaloacétate se fixe d’abord à l’enzyme qui en changeant de
conformation permet la fixation de l’acétyl CoA et la formation d’un intermédiaire : le citroyl
CoA qui sera ensuite hydrolysé en citrate et en coenzyme A.
O
O CH2 – C – S – CoA
O = C - COO- + CH3 – C – S – CoA HO – C - COO-
Citrate synthétase
CH2 - COO- CH2 - COO-
Oxaloacétate Acétyl CoA Citroyl CoA
O
CH2 – C – S – CoA H20 CoASH CH2 - COO-
HO – C - COO- HO – C - COO-
Citrate synthétase
CH2 - COO- CH2 - COO-
Citroyl CoA Citrate

5/9 www.mediprepa.com
B. Conversion du citrate en isocitrate.
La réaction se fait en deux étapes avec le cis-aconitate pour intermédiaire. Les deux étapes sont
catalysées par l’aconitase.
COO- COO- COO-
CH2 H20 CH2 H20 CH2
-OOC - C – OH -OOC - C -OOC – C - H
Aconitase Aconitase
H – C - H H - C H – C -OH
COO- COO- COO-
Citrate Cis -aconitate Isocitrate
Remarque : La molécule de citrate qui paraît symétrique à première vue, en réalité ne l’est pas. En
effet, l’aconitase est capable de faire la différence entre les deux CH2 – COO- du citrate. On parle
de molécule prochirale.
C. Oxydation et décarboxylation de l’isocitrate en αα
αα -cétoglutarate.
L’isocitrate est oxydé par l’isocitrate déshydrogénase pour former l’oxalosuccinate et générer une
molécule de NADH. L’oxalosuccinate reste lié à l’enzyme et perd une molécule de CO2 pour
aboutir à l’ α -cétoglutarate (α -KG).
COO- COO- COO-
CH2 Isocitrate CH2 Isocitrate CH2
déshydrogénase déshydrogénase
H – C - COO- H – C - COO- H – C - H
HO – C- H NAD+ NADH + H+ C = O H+ CO2 C = O
COO- COO- COO-
Isocitrate Oxalosuccinate α -cétoglutarate
D. Décarboxylation de l’αα
αα -cétoglutarate en succinyl Coenzyme A.
Cette réaction est catalysée par le complexe de l’ α -cétoglutarate déshydrogénase dont la structure
et le mécanisme d’action sont très proches de celui de la pyruvate déshydrogénase qui permet le
passage du pyruvate à l’acétyl CoA (Voir I.A.). La réaction peut s’écrire de façon simplifiée :
α -cétoglutarate + CoASH + NAD+ succinyl CoA + CO2 + NADH + H+
On retrouve au sein du complexe trois enzymes et leurs cofacteurs :
E’1 : L’α-cétoglutarate déshydrogénase + thiamine pyrophosphate (TPP).
E’2 : La dihydrolipoyl transsuccinylase + lipoamide.
E’3 : La dihydrolipoyl déshydrogénase. + FAD. (identique à E3)
 6
6
 7
7
 8
8
 9
9
1
/
9
100%