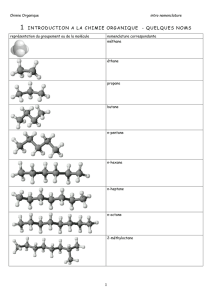
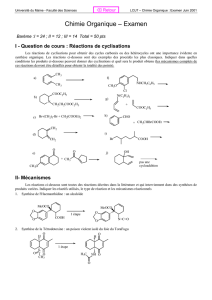
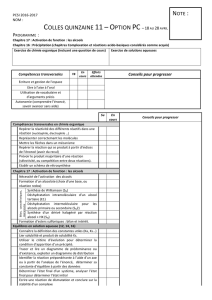
Fiches de séquences de leçons - Site Maintenance in progress
publicité

MINISTÈRE DE LA COMMUNAUTÉ FRANCAISE ADMINISTRATION GÉNÉRALE DE L'ENSEIGNEMENT ET DE LA RECHERCHE SCIENTIFIQUE Service général des Affaires pédagogiques, de la Recherche en Pédagogie et du Pilotage de l'Enseignement organisé par la Communauté française Inspection de l’enseignement secondaire Centre d’Autoformation (CAF) de Tihange TROISIÈME DEGRÉ (5e et 6e) Fiches de séquences de leçons Travail collectif réalisé par des professeurs de chimie sous la direction des Inspecteurs Philippe ARNOULD et Jacques FURNÉMONT et de Pierre COLLETTE, Formateur au CAF 2002 Plan général du document CHIMIE ORGANIQUE ( I ) 1. Du pétrole à l'essence …………………….…….…. page 3 2. Des dérivés du pétrole aux matières plastiques …. page 25 CHIMIE ORGANIQUE ( II ) 1. Les molécules du vivant …………………………….. page 51 2. Les alcools ……..…………………………………….. page 53 3. Les aldéhydes et les cétones ………………………. Page 78 4. Les acides carboxyliques …………………………… page 93 CAF 2002 - CHIMIE ORGANIQUE - page 1 CHIMIE ORGANIQUE ( I ) SOMMAIRE 1. Du pétrole à l'essence………………………………………………………page 3 Fiche n°1 : Comment fabrique-t-on de l'essence automobile ? Fiche n°2 : Comment obtient-on de l'essence automobile à partir du pétrole raffiné ? Fiche n°3 : Classons les modèles moléculaires éclatés des substances obtenues après les divers traitements du pétrole. Fiche n°4 : Représentons toutes les formules développées correspondant à une formule moléculaire donnée. Fiche n°5 : Comment nomme-t-on les alcanes ? Fiche n°6 : Quelles sont les propriétés des alcanes ? 2. Des dérivés du pétrole aux matières plastiques ……………… page 25 Fiche n°7 : Que contient la fraction liquide obtenue lors du craquage des paraffines (alcanes complexes) ? Fiche n°8 : Quels sont les autres types d'hydrocarbures formés lors du craquage des paraffines ? Fiche n°9 : Comment peut-on interpréter la décoloration du brome par les alcènes ? Fiche n°10 : La règle empirique de MARKOWNIKOV affirme que lors d'une addition d'un composé hydrogéné sur un alcène dissymétrique, l'hydrogène se fixe sur le carbone le moins substitué (le plus hydrogéné). Comment peut-on justifier cette règle ? Fiche n°11 : Les alcènes sont des matières premières à partir desquelles on produit certaines matières plastiques. Comment se produisent ces réactions chimiques de polymérisation ? Fiche n°12 : Comment se nomment les alcènes ? Fiches n°13 : Représentons toutes les formules développées correspondant à la formule moléculaire du butène C4H8. Fiches n°14 : Etendons les règles de nomenclature et les propriétés des alcènes aux alcynes CAF 2002 - CHIMIE ORGANIQUE - page 2 1. Du pétrole à l'essence . Au cours de cette séquence, nous vous proposons de répondre aux questions suivantes : • Fiche n°1 : Comment fabrique-t-on de l'essence automobile ? • Fiche n°2 : Comment obtient-on de l'essence automobile à partir du pétrole raffiné ? • Fiche n°3 : Classons les modèles moléculaires éclatés des substances obtenues après les divers traitements du pétrole. • Fiche n°4 : Représentons toutes les formules développées correspondant à une formule moléculaire donnée. • Fiche n°5 : Comment nomme-t-on les alcanes ? • Fiche n°6 : Quelles sont les propriétés des alcanes ? CAF 2002 - CHIMIE ORGANIQUE - page 3 Organique ( I ) - Fiche n°1 Idée : Comment fabrique-t-on de l'essence automobile ? Action (Si possible projection d'un film sur la distillation du pétrole) On donne • une information : les pétroles(*) sont des mélanges complexes d'hydrocarbures (combinaisons d'hydrogène et de carbone, [C1 à C40]). Pour séparer les constituants du pétrole brut, on le distille. • un schéma figuratif d'une colonne de distillation fractionnée à la pression atmosphérique, et son schéma de fonctionnement. , ZOOM gaz, éther de pétrole calotte de barbotage t°< 60°C trop-plein essence 60°C< t° eb.<175°C kérosène pétrole brut à 375°C vapeurs de pétrole condensat 175°C< t°eb. <275°C gazole 275°C< t°eb. <350°C fraction lourde : fioul, huiles, paraffines, bitume t° eb. > 350°C On demande 1. Explique le fonctionnement de la colonne à distiller industrielle. ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... (*) étymologie latine "petra" (pierre) et "oleum" (huile). CAF 2002 - CHIMIE ORGANIQUE - page 4 INFORMATION Les essences recueillies lors de la distillation fractionnée supportent mal les taux de compression élevés des moteurs à explosion modernes. Il faut donc leur faire subir un traitement supplémentaire : c'est le réformage. Voici par exemple trois modèles d'hydrocarbures obtenus par distillation dans la fraction C7-C8 (molécules comportant 7 et 8 carbones) : n-heptane : Légende : méthylheptane : : atome d'hydrogène : atome de carbone n-octane : Un meilleur carburant obtenu par réformage des octanes aurait les caractéristiques suivantes : formule moléculaire (brute) : C8H18 nom : 2,2,4-triméthylpentane modèle moléculaire : formule développée : H | H H-C-H H H H | | | | | H—C— C — C — C — C—H | | | | | H H-C-H H H-C-H H | | H H CAF 2002 - CHIMIE ORGANIQUE - page 5 A l'époque où le 2,2,4-triméthylpentane était le meilleur carburant connu, on lui avait attribué arbitrairement un indice de qualité 100 (indice d'octane) tandis que le heptane normal (n-heptane), carburant médiocre, avait reçu l'indice 0. Actuellement, il existe des carburants supérieurs au 2,2,4-triméthylpentane. Dès lors leur indice d’octane dépasse 100. Carburant Indice d'octane n-heptane 0 2,4-diméthylpentane 83 Euro 95 95 Euro 98 98 2,2,4-triméthylpentane 100 Super + 110 benzène 117 toluène 119 CAF 2002 - CHIMIE ORGANIQUE - page 6 Organique ( I ) - Fiche n°2 Idée : Comment obtient-on de l'essence automobile à partir du pétrole raffiné ? Action : gaz et éthers de pétrole DÉSULFURATION DISTILLATION A PRESSION ATMOSPHÉRIQUE On donne le schéma de la distillation du pétrole à la pression atmosphérique essences réformage carburants kérosène gazole craquage catalytique fioul, huiles de graissage , paraffines, bitume. On demande de préciser le rôle des processus suivants : craquage catalytique : .................................................................................................................................... .................................................................................................................................... .................................................................................................................................... .................................................................................................................................... .................................................................................................................................... Pour confirmer le rôle du craquage catalytique, on peut réaliser le craquage des paraffines(*). réformage : .................................................................................................................................... .................................................................................................................................... .................................................................................................................................... .................................................................................................................................... .................................................................................................................................... (*) Voir page 104 de "Chimie organique" M.E.R.F. - C.T.P. Frameries, J-L Bouxin et R.Vanwuytswinkel Réédition de 1996 CAF 2002 - CHIMIE ORGANIQUE - page 7 Conclusion Le craquage catalytique : La distillation du pétrole fournit des fractions en quantités variables selon l'origine du pétrole. Malheureusement, les fractions lourdes sont généralement abondantes alors que le marché exige de grandes quantités d'essences. Le craquage permet de répondre à cette exigence : sous l'action de la chaleur et de catalyseurs, les molécules des fractions lourdes (gazole) sont transformées en molécules plus légères (essences). Le réformage : Les moteurs à explosion modernes exigent des carburants de haute qualité supportant la compression, les essences obtenues au cours de la distillation ne répondent pas à ces spécifications. Le processus de réformage a pour objet d'améliorer la qualité des essences en augmentant leur indice d’octane : sous l'action de la chaleur et de catalyseurs, les chaînes carbonées linéaires sont réorganisées en chaînes carbonées ramifiées. Information complémentaire La distillation sous vide : Les hydrocarbures lourds supportent mal les températures élevées car celles-ci provoquent la dégradation des chaînes carbonées. Pour séparer les différents constituants de la fraction lourde, on est amené à la distiller sous une pression réduite. Cette faible pression présente l'avantage d'abaisser les températures d'ébullition et permet la séparation des différents constituants. On obtient ainsi du fioul lourd, des huiles de graissage, des vaselines et des paraffines. La dernière partie non distillable constitue le bitume. CAF 2002 - CHIMIE ORGANIQUE - page 8 1. Lecture d'un texte sur la pollution atmosphérique Par l'utilisation de carburants et de combustibles fossiles tels que le pétrole et le charbon, nos sociétés modernes rejettent dans l'atmosphère des substances nuisibles appelées « polluants ». Les polluants classiques, sont les oxydes de soufre, SO2 et SO3 (représentés par SOx), les oxydes d'azote, NO et NO2 (représentés par NOx), les oxydes de carbone, CO et CO2, et enfin les hydrocarbures imbrûlés (représentés par HC). Nous passerons en revue tous ces polluants et quelques mesures qui permettent d'en limiter la production. La pollution aux oxydes de soufre est très préoccupante. Dans l'air, ces oxydes se transforment rapidement en acides sulfureux et sulfurique qui jouent un rôle non négligeable dans la formation des « smogs » des villes de nos régions tempérées. Ils sont également responsables des pluies acides qui non seulement dévastent les forêts de conifères mais encore rongent les pierres calcaires des plus beaux édifices du patrimoine mondial. Les animaux et les hommes ne sont pas épargnés car les SOx diminuent l'élasticité pulmonaire et favorisent des maladies comme la bronchite chronique et l'emphysème pulmonaire. Diverses méthodes peuvent être envisagées pour Gargouilles de Notre Dame de Paris contrôler la quantité du SO2 rejeté dans l'atmosphère. Photo P. Collette (1991) La première consiste à désulfurer les carburants et combustibles sortant des raffineries et à brûler des charbons pauvres en soufre. Une alternative serait de débarrasser les produits d'oxydation des combustibles fossiles des oxydes de soufre en les faisant passer au travers d'un épurateur contenant, par exemple, une suspension aqueuse d’hydroxyde de calcium. Les oxydes d'azote, produits par la circulation urbaine sans cesse croissante, sont coresponsables des pluies acides. En outre, ils constituent une catégorie importante de polluants à effet indirect : ils sont impliqués dans l'apparition de smogs photochimiques conduisant notamment à la formation d'ozone. Les hydrocarbures imbrûlés engendrent parfois des hydrocarbures polycycliques carcinogènes, comme le benzopyrène et le benzanthracène, abondants notamment dans les fumées et suies s'échappant des moteurs diesels. Le monoxyde de carbone, résultat des combustions incomplètes, représente un des principaux polluants de l'air dans les zones urbaines. Il s'agit d'un toxique respiratoire qui empêche irréversiblement la fixation de dioxygène sur l'hémoglobine. L'utilisation des pots catalytiques a heureusement permis d'éliminer la majeure partie des oxydes d'azote (NOx), des hydrocarbures imbrûlés (HC) et du monoxyde de carbone présents dans les gaz d'échappement des véhicules roulant à l'essence. Par ailleurs, les catalyseurs ont exigé la production d'essences sans plomb car celui-ci « empoisonne » le catalyseur et le rend inopérant. Quant aux fumées et suies des moteurs diesels, de grands progrès ont été accomplis avec la découverte de carburants "verts" résultant de la réaction de l'huile de colza et du méthanol (diester) ou avec la mise au point d'une émulsion stable de gazole dans l'eau (aquazole). Enfin, le dioxyde de carbone, bien qu'il soit un constituant naturel de l'atmosphère, y est rejeté en quantités phénoménales. Il serait responsable d'un effet de serre provoquant un réchauffement général de l’atmosphère et des modifications climatiques qui, si l'on n'y prend garde, risquent de provoquer des catastrophes écologiques à plus ou moins long terme. Le premier remède consiste à éviter l'utilisation intempestive des combustibles et carburants fossiles ... (document de professeurs de chimie - décembre 1998) CAF 2002 - CHIMIE ORGANIQUE - page 9 Organique ( I ) - Fiche n°3 Idée : Classons les modèles moléculaires éclatés des substances obtenues après les divers traitements du pétrole. Action : On donne les modèles moléculaires suivants : méthane, éthane, éth(yl)ène, éthyne, propane, prop(yl)ène, n-butane, 2-méthylbutane, diméthylpropane. On demande 1. Observer pour classer sur la base d’un critère choisi librement : Critère choisi : ..................…….......................................................................................... Classification : ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... 2. Représenter la formule développée de chaque modèle (1) (2) (3) (4) (5) (6) (7) (8) (9) CAF 2002 - CHIMIE ORGANIQUE - page 10 3. Classer les modèles dans l’organigramme suivant : Formules 1,2,3,4,5,6,7,8,9 Toutes les liaisons sont-elles simples ? OUI ................................ NON ................................ Quelle est le type de la liaison multiple ? Liaison double ................................ CAF 2002 - CHIMIE ORGANIQUE - page 11 Liaison triple ................................ Conclusion Classification des hydrocarbures à chaîne ouverte 1. Alcanes : toutes les liaisons "carbone-carbone" sont simples. 2. Alcènes : une des liaisons "carbone-carbone" est double. 3. Alcynes : une des liaisons "carbone-carbone" est triple. Remarque : Dans un souci de simplification de l'écriture, on peut également adopter des formules semi-développées (*). Exemple : H H | | H—C— C —H | | H H formule développée H H | | H H-C-H H H-C-H H | | | | | H—C— C — C — C — C—H | | | | | H H-C-H H H H | H (*) CH3-CH3 ou formule semi-développée CH3 ou CH3 CH3-C-CH2 -CH-CH 3 CH3 En principe, il faudrait donner une représentation stéréochimique (dans l’espace) de la molécule ; cependant afin de simplifier, nous adopterons le plus souvent une représentation plane. CAF 2002 - CHIMIE ORGANIQUE - page 12 Organique ( I ) - Fiche n°4 Idée : Représentons toutes les formules développées correspondant à une formule moléculaire donnée Action : On donne le modèle du pentane non ramifié On demande 1. Construis tous les modèles de la molécule du pentane en réarrangeant les atomes. 2. Représente les formules développées et semi-développées des molécules obtenues. N° du modèle Formule développée Formule semi-développée (1) (2) (3) Conclusion • Des molécules de formules moléculaires identiques mais de formules (semi-)développées différentes sont appelées des ISOMERES. • Les trois pentanes susmentionnés ne diffèrent que par le type de chaîne carbonée, linéaire ou ramifiée, ce sont des ISOMERES DE CHAINE. Remarque : Il existe d'autres isoméries. Citons : l'isomérie de position, l'isomérie de constitution, l'isomérie géométrique et l'isomérie optique. Nous en parlerons dans les chapitres concernés. CAF 2002 - CHIMIE ORGANIQUE - page 13 Organique ( I ) - Fiche n°5 Idée : Comment nomme-t-on les alcanes ? Action : On donne le tableau suivant Formule semi-développée Nom CH4 méthane CH3-CH3 éthane CH3-CH2-CH3 propane CH3-CH2-CH2-CH3 n-butane CH3-CH2-CH2-CH2-CH3 n-pentane CH3-CH2-CH2-CH2-CH2-CH3 n-hexane CH3-CH-CH3 CH3 CH3-CH2-CH-CH3 CH3 méthylpropane méthylbutane CH3 CH3-C-CH3 diméthylpropane CH3 CH3-CH2-CH2-CH-CH3 CH3 CH3-CH2-CH-CH2-CH3 CH3 2-méthylpentane 3-méthylpentane CH3 CH3-CH-CH-CH2-CH3 2,3-diméthylpentane CH3 CH3-CH2-CH-CH2-CH3 CH2 éthylpentane CH3 On demande 1. Peux-tu prévoir le nom des hydrocarbures dont le nombre de carbones excède 6 ? Formule moléculaire C7H16 C8H18 C9H20 C10H22 CAF 2002 - CHIMIE ORGANIQUE - page 14 Nom 2. A l'aide des critères suivants, dégage les règles de nomenclature. • choix de la chaîne principale ; ramification • nom de la chaîne principale ; • nom du (des) groupe(s) substituant(s) ; • nombre de substituants identiques ; • position des substituants sur la chaîne principale ; • nécessité d'une numérotation des carbones de la chaîne principale ; • sens de la numérotation. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. 3. Quelle est la formule générale des alcanes ? Cn H....... CAF 2002 - CHIMIE ORGANIQUE - page 15 Conclusion Règles de nomenclature des alcanes (CnH2n+2) 1. les hydrocarbures "linéaires" (non ramifiés) 1.1. 1.1. Le nom des alcanes dépend du nombre de carbones de la chaîne carbonée : préfixe + "ane" Préfixe nombre de carbone méth- 1 éth- 2 prop- 3 but- 4 pent- 5 hex- 6 hept- 7 oct- 8 non- 9 déc- 10 Un alcane linéaire est qualifié de "normal". Son nom sera précédé de "n-" si plusieurs isomères non linéaires de cet alcane existent. 2. Les hydrocarbures ramifiés 2.1. La chaîne carbonée principale correspond à la chaîne carbonée "linéaire" la plus longue : préfixe + suffixe "-ane" 2.2. Nom des ramifications : préfixe + suffixe "-yl" (groupe alkyle, la lettre e s ‘élide dans les noms composés) 2.3. Le nom de la chaîne principale sera précédé des noms des substituants par ordre alphabétique ("éthyl" précède "méthyl"). Quand il y a ambiguïté sur la position du substituant, il est précédé du n° du carbone de la chaîne principale sur lequel il est fixé. Le sens de la numérotation sera imposé par des indices de position les plus petits (la somme des indices doit être minimale). 2.4. Pour deux substituants identiques, on fera précéder le nom du substituant du préfixe "di-", pour trois, "tri"... Ce préfixe n'est pas pris en compte dans le classement alphabétique des groupes alkyles. CAF 2002 - CHIMIE ORGANIQUE - page 16 Organique ( I ) - Fiche n°6 Idée : Quelles sont les propriétés des alcanes ? Action : On donne : des expériences à réaliser 1. Le gaz alimentant les becs Bunsen est soit du méthane (gaz naturel), du propane ou du butane (gaz en bonbonne). On ouvre le robinet de gaz du bec bunsen et on enflamme le gaz, virole ouverte puis virole fermée (*). Combustion virole ouverte (observations et équation) : ........................................ ................................................................................................................................. ................................................................................................................................. ................................................................................................................................. ................................................................................................................................. Combustion virole fermée (observations et équations) : ......................................... ................................................................................................................................. ................................................................................................................................. ................................................................................................................................. ................................................................................................................................. 2. Dans un tube à essais contenant un ou deux mL d'heptane (**), on verse une petite quantité de solution de brome dans CCl4. Cette expérience sera réalisée … a) sous un éclairage intense b) en l’absence de lumière. Observations : Sol . Br2 dans CCl4 papier tournesol humecté a) ............................................................ ................................................................ ................................................................ b) ............................................................ ................................................................ heptane ................................................................ 1) Complète l'équation représentant une des réactions possibles ? C7H16 + Br2 → ......................................................................................................... (*) Voir page 105 de "Chimie organique" M.E.R.F. - C.T.P. Frameries, J-L Bouxin et R.Vanwuytswinkel Réédition de 1996 (**) Voir page 102 de "Chimie organique" ... CAF 2002 - CHIMIE ORGANIQUE - page 17 Conclusion Propriétés chimiques des alcanes : ♦ Les alcanes sont des substances relativement peu réactionnelles. ♦ Ils ne comportent que des liaisons simples. Ils sont dits saturés. Ils ne peuvent donner lieu qu'à des réactions de substitutions, des réactions de combustion et des réactions de dégradation du squelette carboné. a) substitutions : RH + X2 (Cl2 ou Br2) → RX + HX Mécanisme de la réaction CH4 (g) + Cl2 (g) E. lum. i) phase d'initiation : Cl2 → 2Cl• (radical : atome ou groupe d'atomes ayant un électron non apparié) ii) phase de propagation : Cl• + CH4 →CH3• + HCl CH3• + Cl2 → CH3Cl + Cl• ... iii) phase de terminaison : réarrangement au hasard des derniers radicaux. La réaction est une réaction radicalaire en chaîne avec rupture homolytique des liaisons (rupture symétrique : chaque atome conserve un électron de liaison non apparié). b) combustions : i) incomplète : alcane +O2 → C (ou CO) + H2O ii) complète : alcane +O2 → CO2 + H2O c) dégradations : t° i) craquage : C22H46 → CH4 + C21H42 ... ii) réaction avec le fluor : CnH2n+2 + n+1 F2 → 2n+2 HF + n C CAF 2002 - CHIMIE ORGANIQUE - page 18 Information Les alcanes dans la vie courante • les carburants et combustibles : − gaz de ville (naturel) : méthane ; − gaz en bonbonne : propane et butane ; − LPG : propane et butane ; − kérosène : carburant pour l'aviation ; − gazole : mazout de chauffage et carburant diesel ; − fioul lourd : combustible de fours industriels et carburant de moteurs de navire. • les huiles de graissage : − lubrifiants pour l'industrie ; • les paraffines et vaselines : alcanes à chaînes complexes (ex.: C22H46) − fabrication de bougies, encaustiques ; − imperméabilisation du papier, du carton ... • le bitume : − fabrication du Roofing ; − protection des tuyaux et des câbles d'acier ; − revêtement des routes… CAF 2002 - CHIMIE ORGANIQUE - page 19 Application 1. Établis l'équation de combustion complète des hydrocarbures suivants : CH4 (g) + O2 (g) →..................................................................................................... C4H8 (g) + O2 (g) →.................................................................................................... C8H18 (g) + O2 (g) →.................................................................................................. 2. Calcule la masse de dioxyde de carbone rejeté dans l'atmosphère par la combustion complète d'un litre d'essence liquide (octane, C8H18) dont la masse volumique vaut 0,9 kg.dm-3. ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... 3. Sachant que la combustion complète de 2,28 g d'une essence liquide donne 7,04 g de dioxyde de carbone et 3,24 g d'eau, déterminer la formule moléculaire de cette essence (CxHy) sachant que sa masse molaire moléculaire vaut 114 g.mol-1. ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... CAF 2002 - CHIMIE ORGANIQUE - page 20 CONNAISSANCE CONSTRUITE (fiches 1 à 6) PREMIERE SEQUENCE : DU PETROLE A L’ESSENCE 1. Comment fabrique-t-on de l'essence automobile ? Distillation du pétrole brut ZOOM gaz, éther de pétrole calotte de barbotage t°< 60°C trop-plein essence 60°C< t° eb.<175°C kérosène pétrole brut à 375°C vapeurs de pétrole condensat 175°C< t°eb. <275°C gazole 275°C< t°eb. <350°C fraction lourde : fioul, huiles, paraffines, bitume t° eb. > 350°C La distillation du pétrole à la pression atmosphérique vise à séparer les constituants du pétrole brut en diverses fractions. les fractions légères (chaînes carbonées courtes) sont récupérées en tête de colonne, les fractions lourdes (chaînes carbonées longues) se retrouvent en bas de colonne. Les hydrocarbures lourds supportent mal les températures élevées sans se dégrader. Pour séparer les différents constituants de la fraction lourde, on est amené à la distiller sous une pression réduite. Cette faible pression présente l'avantage d'abaisser les températures d'ébullition et permet la séparation des différents constituants. On obtient ainsi du fioul lourd, des huiles de graissage, des vaselines et des paraffines. La dernière partie non distillable constitue le bitume. CAF 2002 - CHIMIE ORGANIQUE - page 21 gaz et éthers de pétrole DÉSULFURATION DISTILLATION A PRESSION ATMOSPHÉRIQUE 2. Comment obtient-on de l'essence automobile à partir du pétrole raffiné ? essences réformage carburants kérosène gazole craquage catalytique fioul, huiles de graissage , paraffines, bitume. Traitements subis par le pétrole après distillation • Craquage catalytique : La distillation du pétrole fournit des fractions en quantités variables selon l'origine du pétrole. Malheureusement, les fractions lourdes sont généralement abondantes alors que le marché exige de grandes quantités d'essences. Le craquage permet de répondre à cette exigence : sous l'action de la chaleur et de catalyseurs, les molécules des fractions lourdes (gazole) sont transformées en molécules plus légères (essences). • Réformage : Les moteurs à explosion modernes exigent des carburants de haute qualité supportant la compression, les essences obtenues au cours de la distillation ne répondent pas à ces spécifications. Le processus de réformage a pour objet d'améliorer la qualité des essences : sous l'action de la chaleur et de catalyseurs, les chaînes carbonées linéaires sont réorganisées en chaînes carbonées ramifiées. Informations complémentaires : A l'époque où le 2,2,4-triméthylpentane était le meilleur carburant connu, on lui avait attribué arbitrairement l'indice de qualité 100 (indice d'octane) tandis que le n heptane, carburant médiocre, avait reçu l'indice d'octane 0. Actuellement, il existe des carburants supérieurs au 2,2,4-triméthylpentane. Dès lors leur indice d’octane dépasse 100. Carburant Indice d'octane n-heptane 0 2,4-diméthylpentane 83 euro '95 95 euro '98 98 2,2,4-triméthylpentane 100 super + 110 benzène 117 Toluène 119 CAF 2002 - CHIMIE ORGANIQUE - page 22 3. Classons les modèles moléculaires éclatés des substances obtenues après les divers traitements du pétrole. • Alcanes : toutes les liaisons "carbone-carbone" sont simples. • Alcènes : une des liaisons "carbone-carbone" est double. • Alcynes : une des liaisons "carbone-carbone" est triple. 4. Représentons toutes les formules développées correspondant à une formule moléculaire donnée. • Des molécules de formules moléculaires identiques mais de formules (semi-)développées différentes sont appelées des ISOMERES. • Si les molécules ne diffèrent que par le type de chaîne carbonée, linéaire ou ramifiée, ce sont des ISOMERES DE CHAINE. • Il existe d'autres isoméries. Citons : l'isomérie de position, l'isomérie de constitution, l'isomérie géométrique et l'isomérie optique. Nous en parlerons dans les chapitres concernés. 5. Comment nomme-t-on les alcanes ? 1) les hydrocarbures "linéaires" (non ramifiés) a) Le nom des alcanes dépend du nombre de carbones de la chaîne carbonée : préfixe + suffixe "ane" Préfixe nombre de carbone méth- 1 éth- 2 prop- 3 but- 4 pent- 5 hex- 6 hept- 7 oct- 8 non- 9 déc- 10 b) Un alcane linéaire est qualifié de "normal", son nom sera précédé de "n" si plusieurs isomères non linéaires de cet alcane existent. 2) Les hydrocarbures ramifiés (la chaîne principale portant des substituants) a) La chaîne carbonée principale est la chaîne carbonée "linéaire" la plus longue : préfixe + suffixe "ane" b) Nom des ramifications : préfixe + suffixe "yl" (groupe alkyle) c) Le nom de la chaîne principale sera précédé des noms des substituants par ordre alphabétique ("éthyl" précède "méthyl"). Quand il y a ambiguïté sur la position du substituant, il est précédé du n° du carbone de la chaîne principale sur lequel il est fixé. Le sens de la numérotation sera imposé par des indices de position les plus petits. CAF 2002 - CHIMIE ORGANIQUE - page 23 d) Pour deux substituants identiques, on fera précéder le nom du substituant du préfixe "di-", pour trois, "tri"... Ce préfixe n'est pas pris en compte dans le classement alphabétique des groupes alkyles. 6. Quelles sont les propriétés des alcanes ? • Les alcanes sont peu réactionnels. • Ils ne comportent que des liaisons simples, ils sont dits saturés, ils ne peuvent donner lieu qu'à des réactions de substitutions, des réactions de combustion et des réactions de dégradation du squelette carboné. a) substitutions : RH + X2 (Cl2 ou Br2) → RX + HX Mécanisme de la réaction CH4 (g) + Cl2 (g) E. lum. i) phase d'initiation : Cl2 → 2Cl• (radical = atome ou groupe d'atomes ayant un électron non apparié) ii) phase de propagation : Cl• + CH4 →CH3• + HCl CH3• + Cl2 → CH3Cl + Cl• ... iii) phase de terminaison : réarrangement au hasard des derniers radicaux La réaction est une réaction radicalaire en chaîne avec rupture homolytique des liaisons (rupture symétrique : chaque atome conserve un électron de liaison non apparié). b) combustions : i) incomplète : alcane +O2 → C (ou CO) + H2O ii) complète : alcane +O2 → CO2 + H2O c) dégradations : t° i) craquage : C22H46 → CH4 + C21H42 ... ii) réaction avec le fluor : CnH2n+2 + n+1 F2 → 2n+2 HF + n C CAF 2002 - CHIMIE ORGANIQUE - page 24 2. Des dérivés du pétrole aux matières plastiques . Au cours de cette séquence, nous vous proposons de répondre aux questions suivantes : • Fiche n°7 : Que contient la fraction liquide obtenue lors du craquage des paraffines (alcanes complexes) ? • Fiche n°8 : Quels sont les autres types d'hydrocarbures formés lors du craquage des paraffines ? • Fiche n°9 : Comment peut-on interpréter la décoloration du brome par les alcènes ? • Fiche n°10 : La règle empirique de MARKOWNIKOV affirme que lors d'une addition d'un composé hydrogéné sur un alcène dissymétrique, l'hydrogène se fixe sur le carbone le moins substitué (le plus hydrogéné). Comment peut-on justifier cette règle ? • Fiche n°11: Les alcènes sont des matières premières à partir desquelles on produit certaines matières plastiques. Comment se produisent ces réactions chimiques de polymérisation ? • Fiche n°12 : Comment se nomment les alcènes ? • Fiche n°13 : Représentons toutes les formules développées correspondant à la formule moléculaire du butène C4H8. • Fiche n°14 : Etendons les règles de nomenclature et les propriétés des alcènes aux alcynes. CAF 2002 - CHIMIE ORGANIQUE - page 25 Organique ( I ) - Fiche n°7 Idée : Que contient la fraction liquide obtenue lors du craquage des paraffines (alcanes complexes) ? Action On donne : Nous avons vu dans la fiche n°6 que les alcanes ne décolorent le brome qu’en présence de lumière. On demande 1. Répéter l'expérience avec la fraction liquide obtenue lors du craquage catalytique des paraffines (alcanes complexes). solution de Br2 dans CCl4 1 mL de fraction liquide de craquage 2. Observations : ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... 3. Répéter l'expérience en l'absence totale de lumière : ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... 4. Conclusion : ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... CAF 2002 - CHIMIE ORGANIQUE - page 26 Organique ( I ) - Fiche n°8 Idée : Quels sont les autres types d'hydrocarbures formés lors du craquage des paraffines ? Action On donne : des équations chimiques représentant le craquage d'une paraffine t° C22H46 → C20H42 + C2H4 cat. C18H38 + C4H8 C17H36 + C5H10 ... CH4 + C21H42 On demande 1. Ecris les formules générales des produits obtenus Formule du produit Formule générale Formule du produit C20H42 C2H4 C18H38 C4H8 C17H36 C5H10 CH4 C21H42 Formule générale 2. Ecris les formules développées des substances suivantes Formule moléculaire Formule(s) développée(s) C2H4 C4H8 3. Quel type d'hydrocarbures correspond à ces formules ? ................................................................................................................................. ................................................................................................................................. t° 4. Complète l'équation générale suivante : paraffinecat →. alcane + .............................. CAF 2002 - CHIMIE ORGANIQUE - page 27 Organique ( I ) - Fiche n°9 Idée : Comment peut-on interpréter la décoloration du brome par les alcènes ? Action On donne les informations suivantes : • le brome n'est pas capable de dégrader (rompre) les chaînes carbonées saturées, • le brome se substitue à l’hydrogène d’un carbone saturé en présence de lumière. On demande 1) Formule deux hypothèses quant à l’équation de la réaction entre le cyclohexène et le dibrome : a) b) + Br2 → ........................................................................................ + Br2 → ........................................................................................ 2) Réalise l’expérience suivante dans la pénombre pour confirmer ou infirmer les hypothèses proposées : On verse un peu de brome dissous dans CCl4 dans un tube à essais contenant 1 mL de cyclohexène (C6H10). Sol. De Br2 Observations : dans CCl4 ................................................................ papier tournesol humecté ................................................................ ................................................................ ................................................................ ................................................................ ................................................................ cyclohexène ................................................................ ................................................................ 3) Quelle équation est en accord avec l’expérience ? Justifier. ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... CAF 2002 - CHIMIE ORGANIQUE - page 28 Conclusion ♦ Si les alcènes sont produits par craquage, ils sont surtout fabriqués par vapocraquage des fractions légères du pétrole. ♦ Les alcènes donnent lieu à des réactions d'addition car ils possèdent une double liaison sur laquelle peuvent s'additionner des réactifs avides d'électrons (électrophiles). Les alcènes sont des hydrocarbures insaturés. Comme le brome est capable de rompre une des liaisons de la double liaison, celle-ci doit être formée de deux liaisons non équivalentes. La plus faible des deux sera nommée π, la plus forte sera nommée σ. Représentation : C π = σC ♦ La mésomérie ou la résonance Pour expliquer la réactivité des alcènes à partir de sa structure, nous devons faire appel à un nouveau concept : la mésomérie. Si nous représentons l'ion carbonate CO32- par une formule de Lewis, nous obtenons : O O=C O Cette formule nous suggère que les liaisons entre C et O ne sont pas équivalentes (une double liaison et deux simples liaisons); de même les deux charges négatives seraient réparties sur deux des trois oxygènes. Or, les mesures de longueur de liaison indique que les trois liaisons sont équivalentes. Liaison Longueur moyenne en pm C-O (de CH3-O-CH3) 141 C=O (de CH3-CO-CH3) 122 CO (dans 2CO3 ) 131 De plus leur longueur suggère qu’elles sont intermédiaires entre une simple et une double liaison. Comme il n'est plus possible de représenter ce type de liaison intermédiaire dans une formule de Lewis, ce modèle a atteint sa limite de validité. On doit le faire évoluer. Pour rendre compte des observations, il faut faire appel à la mésomérie. Ce modèle permet d'utiliser les formules de Lewis en délocalisant les électrons les plus "mobiles" (π π et des doublets libres) afin de rechercher toutes les structures plausibles de la molécule. Pour décrire l'ion carbonate, nous obtenons ainsi 3 formes limites appelées aussi formes mésomères ou encore formes de résonance(*) : OO OO=C O-C O-C O OO (*) Les formes de résonance n'ont aucune existence physique, elles ne sont qu'une vue de l'esprit et les charges qui y apparaissent sont purement formelles (résultent d'un bilan théorique). CAF 2002 - CHIMIE ORGANIQUE - page 29 On dit que l'ion carbonate résonne entre ces trois structures limites. L'ion réel est intermédiaire entre ces trois formes limites : c'est un hybride de résonance. O 22O C Modèle de l'ion CO3 : O ♦ Mécanisme de l'addition électrophile (*) Réaction entre CH2=CH2 (éthène) et Br2 : La molécule d'alcène résonne entre trois formes limites : CH2 - CH2+ - CH2 =CH2 CH2 - CH2- + L'expérience nous permet de justifier les étapes suivantes : 1. Dissociation hétérolytique de Br2 : Br2 → Br - + Br + 2. Addition électrophile de Br+ sur le site négatif : CH2 - CH2- + Br + → +CH2 - CH2Br (carbocation intermédiaire) Br + ⊕ en réalité CH2 – CH2 3. Addition nucléophile de Br - sur le site positif : CH2 - CH2Br + Br - → CH2Br - CH2Br + Application 1) Compléter les équations suivantes : − CH2=CH2 + HBr → ............... ................................................................................... H + − CH2=CH2 + H2O →................................................................................................... − CH3-CH=CH2 + Cl2 → ............................................................................................. 2) Evaluation formative : Propose un mécanisme de réaction expliquant l'effet catalytique de H+ dans la réaction d'addition d'eau sur un alcène ? ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... Electrophile : qui aime les électrons → qui présente une affinité pour les charges négatives ; nucléophile : qui aime les noyaux → qui présente une affinité pour les charges positives. (*) CAF 2002 - CHIMIE ORGANIQUE - page 30 Organique ( I ) - Fiche n°10 Idée : La règle empirique de MARKOWNIKOV affirme que lors d'une addition d'un composé hydrogéné sur un alcène dissymétrique, l'hydrogène se fixe sur le carbone le moins substitué (le plus hydrogéné). Comment peut-on justifier cette règle ? Action 1 On donne l'équation incomplète de la réaction d'addition du chlorure d'hydrogène sur le propène : CH3-CH=CH2 + HCl → … On demande 1. Complète l'équation en respectant la règle de Markownikov. CH3-CH=CH2 + HCl → .................................................................................................. 2. Explicite deux variantes plausibles du mécanisme de réaction 1ère possibilité ère 1 forme mésomère de CH3-CH=CH2 : CH3 – CH = CH2 ↔ ………………. 2e possibilité ème 2 forme mésomère de CH3-CH=CH2 : CH3 – CH = CH2 ↔ ………………. Équation de l’addition électrophile : Équation de l’addition électrophile : Équation de l’addition nucléophile : Équation de l’addition nucléophile : • Quel est le carbocation formé à l'issue de l'addition électrophile compte tenu du résultat de la réaction ? ................................................................................................................................. Conclusion : Si ce carbocation est formé, il est donc plus stable. Cette stabilité est justifiée par l'action suivante ... CAF 2002 - CHIMIE ORGANIQUE - page 31 Action 2 On donne des expériences pour comparer la polarisation de la liaison C-Cl dans trois chlorobutanes différents : On demande de compléter le tableau suivant. Rappel : Mise en évidence des ions Cl- : Ag+ + Cl- → AgCl (s). le précipité blanc obtenu noircit à la lumière (cf. photographie) Expérience Observations (5 minutes maximum) ..................................................................................... 0,2 mL de CH3-CH2-CH2-CH2Cl ..................................................................................... ..................................................................................... ..................................................................................... 2 mL de AgNO3 (1% dans l'éthanol absolu) ..................................................................................... ..................................................................................... 0,2 mL de CH3-CH2-CHCl-CH3 ..................................................................................... ..................................................................................... ..................................................................................... 2 mL de AgNO3 (1% dans l'éthanol absolu) ..................................................................................... 0,2 mL de CH3 ..................................................................................... | ..................................................................................... CH3 - CCl | ..................................................................................... CH3 ..................................................................................... 2 mL de AgNO3 (1% dans l'éthanol absolu) ..................................................................................... 1. Si on remplace les groupes alkyles (méthyle, éthyle, propyle, butyle ...) par le symbole R, comment représentes-tu les 3 chlorobutanes précités? CH3-CH2-CH2-CH2Cl : -C-Cl CH3-CH2-CHCl-CH3 : -C-Cl CH3 | CH3 - CCl : | CH3 -C-Cl 2. A quoi peux-tu attribuer la différence de polarisation de la liaison C-Cl des trois chlorobutanes ? ...................................................................................................................................... ...................................................................................................................................... CAF 2002 - CHIMIE ORGANIQUE - page 32 ...................................................................................................................................... Conclusion • Les groupes alkyles induisent une polarisation plus forte de la liaison C-Cl. Plus on substitue les hydrogènes du carbone par des groupes alkyles, plus la liaison se polarise et tend à devenir ionique. • Conséquence : plus le carbocation est substitué, plus il est stable. Définitions : Un carbone lié à un seul autre carbone sera dit PRIMAIRE Un carbone lié à deux autres carbones sera dit SECONDAIRE Un carbone lié à trois autres carbones sera dit TERTAIRE Un carbone lié à quatre autres carbones sera dit QUATERNAIRE Ainsi les carbocations tertiaires sont les plus stables (puisqu'il ne peut exister de carbocation quaternaire). Ex. : CH3 | CH3 - C + | CH3 • Cet effet de polarisation induit le long de la chaîne carbonée s'appelle EFFET INDUCTIF. • Si les (groupes d') atomes repoussent les doublets de liaison, on parlera + d'EFFET INDUCTIF REPULSIF ou EFFET INDUCTIF DONNEUR, noté I . Ex. : groupes alkyles, éléments très peu électronégatifs (Na, K ...) • Si les (groupes d') atomes attirent les doublets de liaison, on parlera d'EFFET INDUCTIF ATTRACTIF ou EFFET INDUCTIF CAPTEUR, noté I .. Ex. : éléments très électronégatifs, OH ... • La règle de Markownikov s'explique par la stabilité relative du carbocation intermédiaire formé au cours de l'addition électrophile. Réaction d'addition : alcène + hydracide halogéné → dérivé halogéné R-CH=CH2 + HX → R-CHX-CH3 addition électrophile : R-CH+-CH2- + H+ → R-CH+-CH3 (carbocation) addition nucléophile : R-CH+-CH3 + X- → R-CHX-CH3 Application 1) CH3-CH2-C=CH2 + HBr → ........................................................................................ CH3 2) CH2=CH-CH2-CH3 + HCl → ..................................................................................... 3) CH3- CH=CH-CH3 + HCl → ..................................................................................... CAF 2002 - CHIMIE ORGANIQUE - page 33 Organique ( I ) - Fiche n°11 Idée : Les alcènes sont des matières premières à partir desquelles on produit certaines matières plastiques. Comment se produisent ces réactions chimiques de polymérisation? Action 1 On donne 1. Rappel : la principale propriété des alcènes résulte de leur caractère insaturé : ils subissent très facilement des réactions d’addition. 2. Un protocole expérimental de fabrication du polystyrène (cf CHIMIE ORGANIQUE - Centre technique et pédagogique de la Communauté française 1996 - page 119) On demande 1. réaliser l’expérience ; 2. écrire l’équation de polymérisation : ................................................................................................................................. Action 2 On donne 1. la réaction de polymérisation de l’éth(yl)ène en polyéth(yl)ène, catalysée par un acide: H + n CH2=CH2 → CH3-CH2-CH2-CH2-........-CH=CH2 (2n - 4) x CH2 On demande Imagine un mécanisme permettant de passer du monomère CH2=CH2 au dimère CH3-CH2-CH=CH2 puis au polymère. Remarque : En présence d’acide ce mécanisme est nécessairement ionique. Il existe cependant d’autres substances du type peroxyde appelées « initiateurs » qui imposent un mécanisme radicalaire. ................................................................................................................................. ................................................................................................................................. ................................................................................................................................. ................................................................................................................................. ................................................................................................................................. ................................................................................................................................. ................................................................................................................................. ................................................................................................................................. ................................................................................................................................. ................................................................................................................................. CAF 2002 - CHIMIE ORGANIQUE - page 34 Conclusion • Les alcènes ont la propriété de s’additionner entre eux : monomères identiques : polymérisation Ex. : éth(yl)ène → polyéth(yl)ène) monomères différents : copolymérisation Ex. : éth(yl)ène + prop(yl)ène→ → polyoléfine • Le mécanisme de réaction est radicalaire si la réaction est obtenue par chauffage ou par l’addition d’un initiateur du type peroxyde • le mécanisme de réaction est ionique si la réaction est catalysée par un acide : Exemple de polymérisation de l’éth(yl)ène : Résonance de l’éth(yl)ène : CH2=CH2 ↔ CH2- - CH2 + Addition électrophile du catalyseur : H+ + CH2- - CH2 + → CH3 - CH2+ (carbocation) Addition du carbocation sur une autre molécule d’alcène : CH3 - CH2+ + CH2- - CH2 + → CH3-CH2-CH2-CH2+ Propagation de la réaction en chaîne : CH3-CH2-CH2-CH2+ + CH2- - CH2+ → CH3-CH2-CH2-CH2-CH2-CH2+ ... Terminaison, le catalyseur est régénéré : CH3-CH2- ... -CH2-CH2+ → CH3-CH2- ... -CH--CH2+ + H+ CH3-CH2- ... -CH=CH2 • Exemples de matières plastiques dans la vie courante Matière plastique Monomère Exemples d’usages PE (polyéthylène) CH2=CH2 emballage PP (polypropylène) CH3-CH=CH2 jouet, emballage PS (polystyrène) CH2=CH emballage, isolation thermique (PS expansé) PVC (polyvinylchloré) CH2=CHCl châssis de fenêtre, tuyau PTFE (polytétrafluoroéthylène ou téflon) CF2=CF2 tuyau de décharge joint de plomberie, anti-adhérent Pour plus d’informations et d’expériences sur les matières plastiques, se référer au KIT PLASTIQUES DE FECHIPLAST... CAF 2002 - CHIMIE ORGANIQUE - page 35 Organique ( I ) - Fiche n°12 Idée : Comment se nomment les alcènes ? Action On donne le tableau suivant Formule semi-développée Nom CH2=CH2 éthène ou éthylène CH3-CH=CH2 propène ou propylène CH3-CH2-CH=CH2 n-but-1-ène CH3-CH=CH-CH3 n-but-2-ène CH3-CH=CH-CH2-CH3 n-pent-2-ène CH3-CH=C-CH2-CH3 CH3 3-méthylpent-2-ène CH3 CH3-CH=C-CH-CH3 3,4-diméthylpent-2-ène CH3 On demande 1. A l'aide des critères suivants, dégage les règles de nomenclature. • choix de la chaîne principale ; • nom de la chaîne principale ; • position de la double liaison ; • sens de la numérotation ; • nom du (des) groupe(s) substituant(s) éventuel(s) ; • nombre de substituants identiques ; • position des substituants sur la chaîne principale ; .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. 2. Quelle est la formule générale des alcènes ? Cn H....... CAF 2002 - CHIMIE ORGANIQUE - page 36 Conclusion Règles de nomenclature des alcènes (CnH2n) 1. les hydrocarbures "linéaires" (non ramifiés) Le nom des alcènes dépend du nombre de carbones de la chaîne carbonée : préfixe + "ène" Préfixe nombre de carbone éth(yl)- 2 prop(yl)- 3 but- 4 pent- 5 hex- 6 hept- 7 oct- 8 non- 9 déc- 10 2. Les hydrocarbures ramifiés = chaîne principale portant des substituants 2.1. Chaîne carbonée principale = chaîne carbonée "linéaire" la plus longue contenant la double liaison : préfixe - indice de position "ène" Le sens de la numérotation sera imposé par l’indice de position le plus petit pour le premier carbone porteur de la d.l. 2.2. Le nom de la chaîne principale sera précédé des noms des substituants par ordre alphabétique ("éthyl" précède "méthyl"). Quand il y a ambiguïté sur la position du substituant, il est précédé du n° du carbone de la chaîne principale sur lequel il est fixé. 2.3. Pour deux substituants identiques, on fera précéder le nom du substituant du préfixe "di-", pour trois, "tri"... Ce préfixe n'est pas pris en compte dans le classement alphabétique des groupes alkyles. CAF 2002 - CHIMIE ORGANIQUE - page 37 Organique ( I ) - Fiche n°13 Idée : Représentons toutes les formules développées correspondant à la formule moléculaire du butène C4H8. Action 1 On donne le modèle du but-1-ène On demande 1. Construis tous les modèles de la molécule du butène en réarrangeant les atomes. 2. Représente les formules développées et semi-développées des molécules obtenues. N° du modèle Formule développée Formule semi-développée (1) (2) (3) (4) 3. Observe un des modèles repris ci-dessus. Que valent les angles entre les liaisons du carbone insaturé ? ....................................................................................................................................... CAF 2002 - CHIMIE ORGANIQUE - page 38 Action 2 On donne les définitions suivantes : • Les hydrocarbures dont les chaînes carbonées principales sont différentes sont des ISOMERES DE CHAINE. • Les alcènes qui ne diffèrent que par la position de la double liaison dans une chaîne carbonée principale de même longueur sont des ISOMERES DE POSITION. • Les isoméres qui ne diffèrent que par la disposition des substituants par rapport à la d.l. sont des ISOMERES GEOMETRIQUES Z/E (Zusammen / Entgegen(*)) ou CIS/TRANS (du même côté de la d.l. / de part et d’autre de la d.l.). Ce type d’isomérie résulte de l’absence de rotation libre autour de la d.l. On demande 1. Classe les couples de modèles (1)-(2), (1)-(3), (1)-(4), (2)-(3), (2)-(4), (3)-(4) dans le tableau suivant : ISOMERES DE CHAINE ISOMERES DE POSITION ISOMERES GEOMETRIQUES Z/E (CIS/TRANS) (*) ........................................ ........................................ ........................................ ........................................ ........................................ ........................................ ........................................ ........................................ ........................................ ........................................ ........................................ ........................................ De l’allemand, zusammen : ensemble et entgegen : en face. CAF 2002 - CHIMIE ORGANIQUE - page 39 Conclusion • Les butènes dont les chaînes carbonées principales sont différentes sont des ISOMERES DE CHAINE Formule semi-développée Nom CH3-CH2-CH=CH2 but-1-ène CH3 CH=CH2 2-méthylpropène CH3 • • Les butènes qui ne diffèrent que par la position de la double liaison dans une chaîne principale à 4 carbones sont des ISOMERES DE POSITION. Formule semi-développée Nom CH3-CH2-CH=CH2 but-1-ène CH3-CH=CH-CH3 but-2-ène Les isoméres qui ne diffèrent que par la disposition des substituants par rapport à la d.l. sont des ISOMERES GEOMETRIQUES Z/E (Zusammen/Entgegen) ou CIS/TRANS (du même côté de la d.l. - de part et d’autre de la d.l.). Ce type d’isomérie résulte de l’absence de rotation libre autour de la d.l. Formule développée H H Nom H E but-2-ène C H Ou but-2-ène trans C=C H C H H H H H C=C H C H • H H C H Z but-2-ène H Ou but-2-ène cis Les Z but-2-ène et E but-2-ène ont un squelette carboné coplanaire et les angles entre les liaisons carbone-carbone valent 120°. CAF 2002 - CHIMIE ORGANIQUE - page 40 Organique ( I ) - Fiche n°14 Idée : Etendons les règles de nomenclature et les propriétés des alcènes aux alcynes. 1. Nomenclature Formule semi-développée Nom CH≡ ≡CH éthyne ou acétylène CH3-C≡ ≡CH propyne CH3-CH2-C≡ ≡CH but-1-yne CH3-C≡ ≡C-CH3 but-2-yne CH3-C≡ ≡C-CH2-CH3 n-pent-2-yne CH3-C≡ ≡C-CH-CH3 4-méthylpent-2-yne CH3 Les règles de nomenclature sont semblables à celles des alcènes, le suffixe ène devient yne. 2. Propriétés chimiques 1) La propriété chimique principale des alcènes est liée à leur caractère insaturé : ils subissent très facilement des réactions d’addition. Les alcynes sont également des molécules insaturées car elles présentent une triple liaison, ils sont donc susceptibles de présenter des réactions d’addition (pas de polyaddition). Exemples : Pt + H2 excès • Addition de H2 : CH≡ ≡CH + H2 → CH2=CH2 • Addition de Br2 : CH≡ ≡CH + Br2 → CHBr=CHBr • Addition de HCl : CH≡ ≡CH + HCl → CH2=CHCl • Addition d’eau : CH≡ ≡CH + H2O → CH2=CHOH (énol instable) H | CH2=CHOH CH3-C=O (aldéhyde) H → CH3-CH3 Pt + Br2 excès → CHBr2-CHBr2 + HCl excès → CH3-CHCl2 + Cet équilibre chimique entre deux isomères de fonction différente est appelé TAUTOMERIE (ne pas confondre avec la RESONANCE) Remarque : Seules deux des liaisons de la triple liaison sont impliquées dans les additions, elles sont donc plus fragiles ce sont des liaisons π (cfr. alcène) - C CCAF 2002 - CHIMIE ORGANIQUE - page 41 Légende : : liaison π : liaison σ 2) Une autre propriété des alcynes vrais (alc-1-yne) est leur caractère acide en présence de base forte ou d’un alcalin : R-C≡ ≡C-H (acide de Brönsted) ∆ R-C≡ ≡C- (base de Brönsted) + H+ Exemples : • CH3-C≡ ≡CH + Na-NH2 → CH3-C≡ ≡C-Na + NH3 • CH3-C≡ ≡CH + Na → CH3-C≡ ≡C-Na + ½ H2 • CH3-C≡ ≡CH + CH3-CH2-Li → CH3-C≡ ≡C-Li + CH3-CH3 3. Les alcynes dans la vie courante : l’acétylène 1) Formule : CH≡ ≡CH 2) Usages : • combustible des chalumeau pour la soudure ou le découpage des métaux ; • lampes à carbure des spéléologues. 3) Préparation : θ • CaO(s) + C(s) → CaC2(s) Carbure de calcium • CaC2(s) + H2O(l) → C2H2(g) + Ca(OH)2(aq) CAF 2002 - CHIMIE ORGANIQUE - page 42 CONNAISSANCE CONSTRUITE (fiches 7 à 14) DEUXIEME SEQUENCE : DES DERIVES DU PETROLE AUX MATIERES PLASTIQUES 7. Préparation des alcènes Si les alcènes sont produits par craquage, ils sont surtout fabriqués par vapocraquage des fractions légères du pétrole. t° CH3-CH3 → CH2=CH2 + H2 cat 8. Structure et propriétés chimiques des alcènes Les alcènes donnent lieu à des réactions d'addition car ils possèdent une double liaison sur laquelle peuvent s'additionner des réactifs avides d'électrons (électrophiles) : les alcènes sont des hydrocarbures insaturés. La double liaison est formée de deux liaisons non équivalentes. La plus faible des deux sera nommée π, la plus forte sera nommée σ. • π Représentation : C = C σ La mésomérie ou la résonance Pour expliquer la réactivité des alcènes à partir de sa structure, nous devons faire appel à un nouveau concept : la mésomérie. Si nous représentons l'ion carbonate CO32- par une formule de Lewis, nous obtenons : O O=C O Cette formule nous suggère que les liaisons entre C et O ne sont pas équivalentes (une double liaison et deux simples liaisons); de même les deux charges négatives seraient réparties sur deux des trois oxygènes. Or, les mesures de longueur de liaison indique que les trois liaisons sont équivalentes. Liaison Longueur moyenne en pm C-O (de CH3-O-CH3) 141 C=O (de CH3-CO-CH3) 122 CO (dans CO32-) 131 De plus leur longueur suggère qu’elles sont intermédiaires entre une simple et une double liaison. Comme il n'est plus possible de représenter ce type de liaison intermédiaire dans une formule de Lewis, ce modèle a atteint sa limite de validité. On doit le faire évoluer. Pour rendre compte des observations, il faut faire appel à la mésomérie. Ce modèle permet d'utiliser les formules de Lewis en délocalisant les électrons les plus "mobiles" (π π et des doublets libres) afin de rechercher toutes les structures plausibles de la molécule. CAF 2002 - CHIMIE ORGANIQUE - page 43 Pour décrire l'ion carbonate, nous obtenons ainsi 3 formes limites appelées aussi formes mésomères ou encore formes de résonance(*) : OO=C - O O- O - - O-C O-C O- O On dit que l'ion carbonate résonne entre ces trois structures limites. L'ion réel est intermédiaire entre ces trois formes limites : c'est un hybride de résonance. O 22Modèle de l'ion CO3 : O C O • Addition électrophile(**) du brome sur un alcène Réaction entre CH2=CH2 (éthène) et le Br2 : La molécule d'alcène résonne entre trois formes limites : CH2 - CH2+ - CH2 =CH2 CH2 - CH2- + Mécanisme réactionnel (justifié par l’expérience) : 1. Dissociation hétérolytique de Br2 : Br2 → Br - + Br + 2. Addition électrophile de Br+ sur le site négatif : CH2 - CH2- + Br + → +CH2 - CH2Br (carbocation intermédiaire) Br + ⊕ en réalité CH2 – CH2 3. addition nucléophile de Br - sur le site positif : CH2 - CH2Br + Br - → CH2Br - CH2Br + • Addition d’un hydracide sur un alcène Règle de Markownikov : lors de l’addition d'un composé hydrogéné sur un alcène dissymétrique, l'hydrogène se fixe sur le carbone le moins substitué (le plus hydrogéné) Jusrification de la règle : Les groupes alkyles induisent une polarisation plus forte de la liaison C-Cl. Plus on substitue les hydrogènes du carbone par des groupes alkyles, plus la liaison se polarise et tend à devenir ionique. Conséquence : plus le carbocation est substitué plus il est stable. Définitions : Un carbone lié à un seul autre carbone sera dit PRIMAIRE Un carbone lié à deux autres carbones sera dit SECONDAIRE Un carbone lié à trois autres carbones sera dit TERTAIRE Un carbone lié à quatre autres carbones sera dit QUATERNAIRE (*) Les formes de résonance n'ont aucune existence physique, elles ne sont qu'une vue de l'esprit et les charges qui y apparaissent sont purement formelles (résultent d'un bilan théorique). (**) Electrophile : qui aime les électrons → qui présente une affinité pour les charges négatives ; nucléophile : aime les noyaux → qui présente une affinité pour les charges positives. CAF 2002 - CHIMIE ORGANIQUE - page 44 Ainsi les carbocations tertiaires sont les plus stables (puisqu'il ne peut exister de carbocation quaternaire). Ex. : CH3 | CH3 - C + | CH3 Cet effet de polarisation induit le long de la chaîne carbonée s'appelle EFFET INDUCTIF. Si les (groupes d') atomes repoussent les doublets de liaison, on parlera + d'EFFET INDUCTIF REPULSIF ou DONNEUR (I ). Ex. : groupes alkyles, éléments très peu électronégatifs (Na, K ...) Si les (groupes d') atomes attirent les doublets de liaison, on parlera d'EFFET INDUCTIF ATTRACTIF ou CAPTEUR (I ). Ex. : éléments très électronégatifs, OH ... La règle de Markownikov s'explique par la stabilité relative du carbocation intermédiaire formé au cours de l'addition électrophile : Alcène + hydracide halogéné → dérivé halogéné → R-CHX-CH3 R-CH=CH2 + HX Mécanisme réactionnel : 1. addition électrophile : R-CH+-CH2- + H+ → R-CH+-CH3 (carbocation) 2. addition nucléophile : R-CH+-CH3 + X- → R-CHX-CH3 CAF 2002 - CHIMIE ORGANIQUE - page 45 • Polyaddition ou polymérisation des alcènes Les alcènes ont la propriété de s’additionner entre eux. monomères identiques : polymérisation Ex. : éth(yl)ène → polyéth(yl)ène) monomères différents : copolymérisation Ex. : éth(yl)ène + prop(yl)ène→ → polyoléfine Le mécanisme de réaction est radicalaire (chauffage ou addition d’un initiateur du type peroxyde) ou ionique (catalyse acide). Mécanisme ionique de la réaction catalysée par un acide Exemple de polymérisation de l’éth(yl)ène : Résonance de l’éth(yl)ène : CH2=CH2 ↔ CH2- - CH2 + Addition électrophile du catalyseur : H+ + CH2- - CH2 + → CH3 - CH2+ (carbocation) Addition du carbocation sur une autre molécule d’alcène : CH3 - CH2+ + CH2- - CH2 + → CH3-CH2-CH2-CH2+ Propagation de la réaction en chaîne : CH3-CH2-CH2-CH2+ + CH2- - CH2+ → CH3-CH2-CH2-CH2-CH2-CH2+ ... Terminaison, le catalyseur est régénéré : CH3-CH2- ... -CH2-CH2+ → CH3-CH2- ... -CH--CH2+ + H+ CH3-CH2- ... -CH=CH2 • Exemples de matières plastiques Matière plastique Monomère Exemples d’usages PE (polyéthylène) CH2=CH2 emballage PP (polypropylène) CH3-CH=CH2 jouet, emballage PS (polystyrène) CH2=CH emballage, isolation thermique (PS expansé) PVC (polyvinylchloré) CH2=CHCl châssis de fenêtre, tuyau PTFE (polytétrafluoroéthylène ou téflon) CF2=CF2 tuyau de décharge joint de plomberie, anti-adhérent CAF 2002 - CHIMIE ORGANIQUE - page 46 9. Règles de nomenclature des alcènes (CnH2n) • les hydrocarbures "linéaires" (non ramifiés) Le nom des alcènes dépend du nombre de carbones de la chaîne carbonée : préfixe + "ène" • Préfixe nombre de carbone éth(yl)- 2 prop(yl)- 3 but- 4 pent- 5 hex- 6 hept- 7 oct- 8 non- 9 déc- 10 Les hydrocarbures ramifiés = chaîne principale portant des substituants Chaîne carbonée principale = chaîne carbonée "linéaire" la plus longue contenant la double liaison : préfixe - indice de position -"ène" Le sens de la numérotation sera imposé par l’indice de position le plus petit pour le premier carbone porteur de la d.l. Le nom de la chaîne principale sera précédé des noms des substituants par ordre alphabétique ("éthyl" précède "méthyl"). Quand il y a ambiguïté sur la position du substituant, il est précédé du n° du carbone de la chaîne principale sur lequel il est fixé. Pour deux substituants identiques, on fera précéder le nom du substituant du préfixe "di-", pour trois, "tri"... Ce préfixe n'est pas pris en compte dans le classement alphabétique des groupes alkyles. 10. Isomérie des alcènes • Les alcènes dont les chaînes carbonées principales sont différentes sont des ISOMERES DE CHAINE Formule semi-développée Nom CH3-CH2-CH=CH2 but-1-ène CH3 C=CH2 2-méthylpropène CH3 CAF 2002 - CHIMIE ORGANIQUE - page 47 • • Les alcènes qui ne diffèrent que par la position de la double liaison dans une chaîne principale de même longueur sont des ISOMERES DE POSITION. Formule semi-développée Nom CH3-CH2-CH=CH2 but-1-ène CH3-CH=CH-CH3 but-2-ène Les isoméres qui ne diffèrent que par la disposition des substituants par rapport à la d.l. sont des ISOMERES GEOMETRIQUES Z/E (Zusammen/Entgegen) ou CIS/TRANS (du même côté de la d.l. - de part et d’autre de la d.l.). Ce type d’isomérie résulte de l’absence de rotation libre autour de la d.l. Formule développée H H Nom H E but-2-ène C H Ou but-2-ène trans C=C H C H H H H H C=C H C H • Z but-2-ène C H H H Ou but-2-ène cis H Les Z-but-2-ène et E-but-2-ène ont un squelette carboné coplanaire et les angles entre les liaisons carbone-carbone valent de 120°. 11. Les alcynes (CnH2n-2) … • Les règles de nomenclature sont semblables à celles des alcènes, le suffixe ène devient yne. 12. Propriétés chimiques des alcynes • Les alcynes sont des molécules insaturées car elles présentent une triple liaison, ils sont donc susceptibles de présenter des réactions d’addition (pas de polyaddition). Ex. : Pt 1) Addition de H2 : CH≡ ≡CH + H2 → CH2=CH2 + H2 excès → 2) Addition de Br2 : CH≡ ≡CH + Br2 → CHBr=CHBr Pt CH3-CH3 + Br2 excès CAF 2002 - CHIMIE ORGANIQUE - page 48 → CHBr2-CHBr2 Remarque : Seules deux des liaisons de la triple liaison sont impliquées dans les additions, elles sont donc plus fragiles ce sont des liaisons π (cfr. alcène) - C C• Légende : : liaison π : liaison σ Une autre propriété des alcynes vrais (alc-1-yne) est leur caractère acide en présence de base forte ou d’un alcalin : R-C≡ ≡C-H (acide de Brönsted) → R-C≡ ≡C- (base de Brönsted) + H+ Ex : CH3-C≡ ≡CH + Na-NH2 → CH3-C≡ ≡C-Na + NH3 13. Les alcynes dans la vie courante : l’acétylène • Formule : CH≡ ≡CH • Usages : combustible des chalumeaux pour la soudure ou le découpage des métaux ; lampes à carbure des spéléologues. • θ Préparation : CaO(s) + C(s) → CaC2(s) Carbure de calcium CaC2(s) + H2O(l) → C2H2(g) + Ca(OH)2(aq) CAF 2002 - CHIMIE ORGANIQUE - page 49 CHIMIE ORGANIQUE ( II ) SOMMAIRE 1. Les molécules du vivant ………………………………………… page 51 Fiche n°1 : De quelles substances chimiques les organismes vivants sont-ils constitués ? 2. Les alcools …………………………………………………………… page 53 Fiche n°2 : Toutes les boissons alcoolisées contiennent-elles le même alcool ? Fiche n°3 : Quelles sont les relations entre la structure et les propriétés physiques des alcools ? Fiche n°4 : Comment nomme-t-on les alcools ? Fiche n°5 : Classons les alcools. Fiche n°6 : Quelle est la relation entre la structure et la réactivité des alcools (R-O-H) ? Peut-on prévoir où se produira la rupture de liaison lors d’une réaction chimique ? Fiche n°7 : Comment fabrique-t-on le vinaigre à partir de vin ? Fiche n°8 : L’oxydation d’un alcool donne-t-elle toujours un acide ? 3. Les aldéhydes et les cétones ………………………………… page 78 Fiche n°9 : Les molécules de sucres simples présentent-elles les mêmes fonctions chimiques ? Fiche n°10 : Comment nomme-t-on les aldéhydes et les cétones ? Fiche n°11 : Y a-t-il des réactions chimiques permettant de distinguer les aldéhydes et les cétones ? Fiche n°12 : Qu’est-ce que le dextrose ? Quelle est sa structure moléculaire ? 4. Les acides carboxyliques ………………………………………. page 93 Fiche n°13 : Qu’est-ce qu’un acide organique ? Fiche n°14 : Comment nomme-t-on les acides carboxyliques ? Fiche n°15 : Quelles sont les relations entre la structure et les propriétés physiques des acides carboxyliques ? Fiche n°16 : Les acides carboxyliques sont-ils comparables aux acides minéraux ? Fiche n°17 : De quel(s) facteur(s) dépend la force des acides carboxyliques ? Fiche n°18 : Quel est le résultat de la réaction entre un acide carboxylique et un alcool ? Fiche n°19 : Comment nomme-t-on les esters ? Fiche n°20 : Qu’est-ce qu’un savon ? Comment le fabrique-t-on ? CAF 2002 - CHIMIE ORGANIQUE – page 50 1. Les molécules du vivant . Au cours de cette séquence, nous vous proposons de répondre à la question suivante : • Fiche n°1 : De quelles substances chimiques les organismes vivants sont-ils constitués ? CAF 2002 - CHIMIE ORGANIQUE – page 51 Organique ( II ) – Les molécules du vivant - Fiche n°1 Idée : De quelles substances chimiques les organismes vivants sont-ils constitués ? Action : On donne un texte à lire. Les organismes vivants sont constitués de cellules. Celles-ci contiennent de l’eau et un grand nombre de substances très différentes. Toutefois elles peuvent être regroupées en cinq catégories principales: les sels minéraux, les glucides (sucres), les protides (protéines), les lipides (huiles et graisses) et les acides nucléiques (ADN, ARN). Ces quatre dernières classes de substances, d’origine exclusivement organique, sont souvent constituées de macromolécules composées d’unités simples enchaînées les unes aux autres. Ainsi : • les glucides sont souvent des sucres complexes constitués de chaînes ou de réseaux tridimensionnels de sucres simples comme le glucose et le fructose. Formule semi-développée de la forme ouverte du glucose : CH2OH-CHOH-CHOH-CHOH-CHOH-CH=O , Formule semi-développée de la forme ouverte du fructose : CH2OH-CHOH-CHOH-CHOH-C-CH2OH , || O • les protéines sont des chaînes plus ou moins complexes d’acides aminés : Modèle de la molécule d’insuline humaine Structure générale d’un acide aminé : H2N - CH – C - OH, | || R O (avec R ≡ chaîne carbonée) • les lipides sont des dérivés de la glycérine et d’acides gras : CH2 – OH | CH – OH | CH2 – OH (glycérine) R – C=O | OH (acide gras) Conclusion Les fonctions chimiques organiques oxygénées couramment représentées dans ces molécules sont : et azotées les plus la fonction alcool : -OH ; les fonctions aldéhyde et cétone : - C=O , - C=O ; la fonction acide : – C – OH ; | | || H R O la fonction amine : - NH2 , - NH-R , - N – R . | R’ Nous étudierons ces fonctions, ainsi que quelques unes de leurs fonctions dérivées, au cours de cette séquence. CAF 2002 - CHIMIE ORGANIQUE – page 52 2. Les alcools Au cours de cette séquence, nous vous proposons de répondre aux questions suivantes : • Fiche n°2 : Toutes les boissons alcoolisées contiennent-elles le même alcool ? • Fiche n°3 : Quelles sont les relations entre la structure et les propriétés physiques des alcools ? • Fiche n°4 : Comment nomme-t-on les alcools ? • Fiche n°5 : Classons les alcools. • Fiche n°6 : Quelle est la relation entre la structure et la réactivité des alcools (R-O-H) ? Peut-on prévoir où se produira la rupture de liaison lors d’une réaction chimique ? • Fiche n°7 : Comment fabrique-t-on le vinaigre à partir de vin ? • Fiche n°8 : L’oxydation d’un alcool donne-t-elle toujours un acide ? CAF 2002 - CHIMIE ORGANIQUE – page 53 Organique ( II ) – Les alcools - Fiche n°2 Idée: Toutes les boissons alcoolisées contiennent-elles le même alcool ? Action 1. Préliminaires (représentation de l’élève) a) Qu’évoque pour toi le terme alcool ? ................................................................................................................................... ....................................................................................…………………...................... b) Connais-tu le nom de l’alcool (des alcools) contenu(s) dans les boissons alcoolisées ? ................................................................................................................................... ................................................................................................................……………. 2. Comment fabrique-t-on les boissons alcoolisées ? • Quelle est la matière première utilisée pour la fabrication du vin ? ............................................................................................................................ • Quelle est la matière première utilisée pour la fabrication de la bière ? ............................................................................................................................ Quel traitement fait-on subir à ces matières premières pour les transformer en boisson alcoolisée (vin ou bière) ? (Si tu l’ignores, passe au point suivant …) ............................................................................................................................ • On donne : une expérience à réaliser (en quelques minutes). On demande : de compléter les observations et de répondre aux questions. Schéma Observations ...................................................................................................... ...................................................................................................... ...................................................................................................... ...................................................................................................... ...................................................................................................... ...................................................................................................... ...................................................................................................... ...................................................................................................... ...................................................................................................... CAF 2002 - CHIMIE ORGANIQUE – page 54 a) Quelle est la nature du gaz dégagé lors de la réaction ? Justifie. .............................................................................................................................. .............................................................................................................................. b) Ouvre le récipient. Quelle odeur s’en dégage ? ............................................................................................................................. c) Complète la réaction chimique traduisant le phénomène observé : Enzymes Sucre → ................ + ………… de levures Cette réaction porte le nom de fermentation alcoolique (elle est due à la respiration anaérobie des levures) 3. Distillation d’un vin ou d’une bière « forte » a) Fais le schéma de l’appareil à distiller. b) A quelle température, l’alcool présent bout-il ? ..................................................................... c) On donne : un tableau de différents composés organiques (formules brutes) et leur température d’ébullition à la pression de 1013 hPa. Composé Nom Nom courant θ éb /°C Alcool méthylique Chlorure de méthyle Alcool éthylique Chlorure d’éthyle Alcool propylique Alcool isopropylique Chlorure d’isopropyle - 65 -24,2 -161,7 78,5 12,3 -88,6 97,4 82,5 35,7 -42,1 systématique CH3OH CH3Cl CH4 CH3-CH2OH CH3-CH2Cl CH3-CH3 CH3-CH2-CH2OH CH3-CHOH-CH3 CH3-CHCl-CH3 CH3-CH2-CH3 Méthanol Chlorométhane Méthane Ethanol Chloroéthane Ethane Propan-1-ol Propan-2-ol 2-chloropropane propane On demande 1. Quel est le composé dont le point d’ébullition correspond à la substance distillée précédemment ?............................................................................ 2. Quelle est la formule générale d’un alcool ? (une chaîne carbonée aliphatique est représentée par R) ............................................................ CAF 2002 - CHIMIE ORGANIQUE – page 55 Conclusion • Les boissons alcoolisées contiennent principalement de l’eau et de l’éthanol (alcool éthylique, formule : CH3-CH2OH) . • Cet alcool est obtenu par fermentation de jus sucrés : C6H12O6 (aq) enzymes → 2 C2H5OH (aq) + 2 CO2 (g) • L’éthanol bout à une température de 78,5°C (p = 1013 hPa) • La formule générale des alcools est ROH (avec R ≡ chaîne carbonée) • Informations complémentaires : 1. Le degré d’alcool : si une bière titre 8° d’alcool, cela signifie que 100 mL de bière contiennent plus ou moins 8 mL d’alcool pur. 2. L’alcool éthylique est une substance toxique qui peut provoquer une accoutumance (alcoolisme). Il est vivement recommander d’en consommer avec modération car l’abus peut conduire à des pathologies majeures (la cirrhose du foie, le cancer de la langue, de l’œsophage, troubles neurologiques, psychiatriques ... ). 3. L’alcool obtenu par fermentation puis distillation du bois est le méthanol (CH3OH). C’est l’alcool à brûler. Il est interdit d’en consommer car il peut provoquer la cécité voire la mort. !!! METHANOL = POISON TRES DANGEREUX !!! 4. La fonction alcool est présente dans de nombreuses molécules organiques telles que les glucides, le cholestérol, les polyols naturels comme la glycérine, etc. CAF 2002 - CHIMIE ORGANIQUE – page 56 Organique ( II ) – Les alcools - Fiche n°3 Idée : Quelles sont les relations entre la structure et les propriétés physiques des alcools ? Action On donne un tableau de caractères physiques Alcane θ éb /°C CH4 CH3-CH3 CH3-CH2-CH3 p = 101325 Pa -161,5 -88,5 -42,1 Alcool θ éb /°C CH3OH CH3-CH2OH CH3-CH2-CH2OH CH3-CHOH-CH3 CH3-CH2-CH2-CH2OH CH3-CH2-CH2-CH2-CH2OH p = 101325 Pa 65,0 78,3 97,4 82,4 117,3 138 Solubilité dans l’eau à 25°C Insoluble Insoluble Insoluble Mr Solubilité dans l’eau à 25°C Pas de limite Pas de limite Pas de limite Pas de limite 80 g/L 22 g/L Mr ... ... ... ... ... ... ... ... ... On demande 1. Calcule la masse moléculaire relative de chaque composé. 2. Compare les θ éb d’un alcane et de l’alcool correspondant. Que constates-tu ? Justifie, si possible, les différences observées. ...................................................................................................................... ...................................................................................................................... ...................................................................................................................... ...................................................................................................................... 3. Compare les θ éb d’un alcane et d’un alcool dont les masses moléculaires relatives sont voisines. Que constates-tu ? Justifie en sachant que la liaison O-H est très polarisée, comme dans la molécule d’eau (dipôle). ...................................................................................................................... ...................................................................................................................... ...................................................................................................................... ...................................................................................................................... ...................................................................................................................... ...................................................................................................................... CAF 2002 - CHIMIE ORGANIQUE – page 57 4. L’éthanol se dissout-il facilement dans l’eau ? Justifie ta réponse en établissant une relation avec la réponse fournie à la question n°3. ...................................................................................................................... ...................................................................................................................... ...................................................................................................................... ...................................................................................................................... 5. Comment varie la solubilité des alcools quand la chaîne carbonée s’allonge ? ...................................................................................................................... ...................................................................................................................... 6. Interprète cette variation de solubilité en te référant également aux données de solubilité des alcanes dans l’eau. ...................................................................................................................... ...................................................................................................................... ...................................................................................................................... ...................................................................................................................... ...................................................................................................................... ...................................................................................................................... ...................................................................................................................... ...................................................................................................................... CAF 2002 - CHIMIE ORGANIQUE – page 58 Conclusion • La température d’ébullition élevée des alcools (ROH), par rapport aux alcanes (CnH2n+2) correspondants, ne peut s’expliquer par la seule augmentation de la masse moléculaire relative. Comme la molécule d’eau, la molécule d’alcool est un dipôle. Il existe des interactions « PONTS dipôle-dipôle HYDROGENE » appelées qui « LIAISONS conjuguent leurs HYDROGENE » effets aux ou forces intermoléculaires de Van der Waals. Ces liaisons hydrogène sont plus intenses que les forces intermoléculaires de Van der Waals mais moins intenses que les liaisons covalentes. Lors des changements d’état, ces forces ne pourront être vaincues que par un apport plus important d’énergie → une température d’ébullition plus élevée. Hδ+—Oδ− .... Hδ+—Oδ− .... Hδ+—Oδ− .... Hδ+—Oδ− R R R R Liaisons hydrogène ou Ponts hydrogène • Par contre l’augmentation de la température d’ébullition des alcools quand la chaîne carbonée s’allonge s’explique parfaitement par l’augmentation de Mr. • La solubilité dans l’eau des alcools diminue quand le groupe alkyle s’allonge. Explication : Les alcanes sont des molécules non polaires, leur solubilité dans l’eau est donc très faible, ils sont dits HYDROPHOBES (« qui n’aiment pas l’eau »). Les alcools possèdent un groupe alkyle HYDROPHOBE et un groupe hydroxyle HYDROPHILE (qui aime l’eau). Tant que le groupe alkyle est de faible longueur (→ → C3 ), l’alcool est très soluble dans l’eau. Mais cette solubilité diminue avec l’allongement de la chaîne carbonée dont le caractère hydrophobe acquiert de plus en plus d’influence. CAF 2002 - CHIMIE ORGANIQUE – page 59 Organique ( II ) – Les alcools - Fiche n°4 Idée : Comment nomme-t-on les alcools ? Action On donne : un tableau de données Formule CH3OH CH3-CH2OH CH3-CH2-CH2OH CH3-CHOH-CH3 CH3-CH2-CH2-CH2OH CH3-CH2-CHOH-CH3 CH3 CH3-COH CH3 CH3 CH3-CH-CH2-CHOH-CH3 CH3 CH3-CH-CH2-CH2-CH2OH CH3 CH3-CH=CH-CH2OH Nom Méthanol Ethanol propan-1-ol propan-2-ol butan-1-ol butan-2-ol 2-méthylpropan-2-ol 4-méthylpentan-2-ol 4,4-diméthylpentan-1-ol but-2-én-1-ol On demande Sur la base des critères suivants (déjà utilisés pour établir la nomenclature des alcanes), dégage les règles de nomenclature des alcools. • choix de la chaîne principale ; • nom de la chaîne principale ; • nom du (des) groupe(s) substituant(s) ; • nombre de substituants identiques ; • position des substituants sur la chaîne principale ; • nécessité d'une numérotation des atomes de carbone de la chaîne principale ; • sens de la numérotation. ----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------CAF 2002 - CHIMIE ORGANIQUE – page 60 Conclusion Règles de nomenclature des alcools (ROH) 1. La chaîne carbonée principale correspond à la chaîne carbonée non ramifiée la plus longue comportant la fonction alcool. 2. Quand il y a ambiguïté sur la position du groupe OH, il est précédé du n° du carbone de la chaîne principale sur lequel il est fixé. Le sens de la numérotation sera imposé par un indice minimal de position du carbone dont le N.O. est le plus élevé: chaîne carbonée - indice - ol ex. : CH3-CH2-CH2OH : propan-1-ol 3. Le nom de la chaîne principale sera précédé des noms des substituants sériés par ordre alphabétique ("éthyl" précède "méthyl") et de leur indice. Remarque : Pour deux substituants identiques, on fera précéder le nom du substituant du préfixe "di-", pour trois, "tri"... Ce préfixe n'est pas pris en compte dans le classement alphabétique des groupes alkyles. CAF 2002 - CHIMIE ORGANIQUE – page 61 Organique ( II ) – Les alcools - Fiche n°5 Idée : Classons les alcools Action On donne : des modèles moléculaires de divers alcools : méthanol, éthanol, propan-1-ol, propan-2-ol, butan-1-ol, butan-2-ol, 2-méthylbutan-2-ol. On demande : 1. Représente la formule semi-développée de chaque alcool 2. Classe les alcools selon tes propres critères • Critère(s) retenu(s) : ........................................................................................... ........................................................................................... • Classement proposé : CAF 2002 - CHIMIE ORGANIQUE – page 62 3. Classe les alcools selon la nature du carbone (primaire, secondaire, tertiaire) portant le groupe fonctionnel OH, en indiquant leur formule semi-développée. Alcool primaire Alcool secondaire Alcool tertiaire 4. Quels sont les isomères de chaîne et les isomères de position ? ................................................................................................................................ ................................................................................................................................ ................................................................................................................................ ................................................................................................................................ ................................................................................................................................ ................................................................................................................................ ................................................................................................................................ ................................................................................................................................ ................................................................................................................................ ................................................................................................................................ CAF 2002 - CHIMIE ORGANIQUE – page 63 Organique ( II ) – Les alcools - Fiche n°6 Idée : Quelle est la relation entre la structure et la réactivité des alcools (RO-H) ? Peut-on prévoir où se produira la rupture de liaison lors d’une réaction chimique ? Action Expérience n°1 On donne trois réactions à effectuer (comparer à la réaction Na + H2O) Schéma Observations .............................................................................. Na .............................................................................. .............................................................................. .............................................................................. .............................................................................. .............................................................................. .............................................................................. .............................................................................. Alcool primaire .............................................................................. Butan-1-ol .............................................................................. .............................................................................. Na .............................................................................. .............................................................................. .............................................................................. .............................................................................. .............................................................................. .............................................................................. Alcool secondaire .............................................................................. .............................................................................. Butan-2-ol .............................................................................. .............................................................................. Na .............................................................................. .............................................................................. .............................................................................. .............................................................................. .............................................................................. .............................................................................. .............................................................................. Alcool tertiaire 2-méthylpropan-2- .............................................................................. .............................................................................. ol On demande • Ecris les équations des réactions observées: ................................................................................................................................... ................................................................................................................................... ................................................................................................................................... • Quelle liaison de R-O-H a été rompue lors des réactions ? Justifie. ................................................................................................................................... ................................................................................................................................... CAF 2002 - CHIMIE ORGANIQUE – page 64 • Compare l’acidité des alcools et de l’eau. Justifie ................................................................................................................................... ................................................................................................................................... ................................................................................................................................... ................................................................................................................................... ................................................................................................................................... ................................................................................................................................... ................................................................................................................................... ................................................................................................................................... ................................................................................................................................... Conclusion n°1 • En présence de métaux peu électronégatifs, un alcool joue le rôle d’acide : ROH → RO- + H+ alcool alcoolate Ex : ROH (l) + Na (s) → RONa (dissous) + ½ H2 (g) • L’effet inductif donneur (I+) des groupes alkyles explique que les alcools sont des acides encore plus faibles que l’eau. Les alcoolates, bases conjuguées, sont donc plus fortes que la base hydroxyde. Eau > alcool primaire > alcool secondaire > alcool tertiaire Force décroissante de l’acide Hydroxyde < alcoolate primaire < alcoolate secondaire < alcool tertiaire Force croissante de la base Application 1. La réaction suivante est-elle spontanée ? Justifie. CH3-CH2-OH + NaOH → CH3-CH2ONa + H2O 2. Prévois et justifie le résultat de la réaction suivante ? CH3-CH2O- + NH3 → CAF 2002 - CHIMIE ORGANIQUE – page 65 2. Expérience n°2 On donne trois réactions à effectuer (durée : 5 minutes) Schéma Observations .............................................................................. .............................................................................. .............................................................................. .............................................................................. .............................................................................. .............................................................................. .............................................................................. .............................................................................. Alcool primaire .............................................................................. Butan-1-ol .............................................................................. .............................................................................. HCl .............................................................................. conc. .............................................................................. .............................................................................. .............................................................................. .............................................................................. .............................................................................. Alcool secondaire .............................................................................. .............................................................................. Butan-2-ol .............................................................................. .............................................................................. HCl .............................................................................. conc. .............................................................................. .............................................................................. .............................................................................. .............................................................................. .............................................................................. .............................................................................. Alcool tertiaire 2-méthylpropan-2- .............................................................................. .............................................................................. ol HCl conc. On demande • Quel est l’alcool le plus réactionnel ? ........................................................................ • Ecris l’équation des réactions qui ont eu lieu : ................................................................................................................................... ................................................................................................................................... ................................................................................................................................... • Quelle liaison de R-O-H a été rompue lors de ces réactions ? Justifie. ................................................................................................................................... ................................................................................................................................... • Emets une hypothèse susceptible d’expliquer la différence de comportement des 3 alcools? ................................................................................................................................... ................................................................................................................................... CAF 2002 - CHIMIE ORGANIQUE – page 66 Conclusion n°2 • En présence d’acides forts comme HCl, HBr, HNO3, dont la base conjuguée est fortement nucléophile, un alcool subit une substitution aboutissant à la formation d’esters minéraux. ROH → R+ + OHEx. : CH3-CH2OH + HCl conc. → CH3-CH2Cl + H2O Mécanisme de la substitution nucléophile : Le mécanisme de substitution nucléophile peut être concertée ou non selon la nature de l’alcool : alcools primaire et secondaire : SN concertée (une étape) .. : Cl : - + Rδ+-OHδ- → [Cl...R...OH] - → Cl-R + OH.. état de transition un alcool tertiaire : SN non concertée (deux étapes) 1ère étape (lente): Rδ+-OHδ− → R+ + OH2ème étape (rapide) : R+ + Cl- → RCl Les alcools tertiaires sont plus réactionnels car le carbocation tertiaire est plus stable (effet inductif donneur des groupes alkyles). Ces réactions, catalysées par les ions Zn2+, entre un alcool et HCl concentré portent le nom de TEST DE LUCAS. • Complément d’information : En présence d’acides comme H2SO4 et H3PO4, dont la base conjuguée est peu nucléophile, un alcool subit une réaction d’élimination (déshydratation). H2SO4 c. Ex. : CH3-CH2OH → CH3-CH2-O-CH2-CH3 (éther-oxyde) + H2O ( à une température plus élevée on obtiendrait CH2=CH2) H2SO4 c. CH3-CHOH-CH3 → CH2=CH-CH3 + H2O H2SO4 c. CH3-COH-CH3 | CH3 → CH2=C-CH3 + H2O | CH3 Application Pourquoi les alcools tertiaires se déshydratent facilement vers 50°C alors que les alcools secondaires et primaires perdent une molécule d’eau respectivement vers 100°C et 150°C ? (Rechercher l’explication grâce au mécanisme réactionnel) CAF 2002 - CHIMIE ORGANIQUE – page 67 Organique ( II ) – Les alcools - Fiche n°7 Idée : Comment fabrique-t-on le vinaigre à partir de vin ? Action Recherche dans la vie quotidienne a) Quels mots retrouve-t-on dans « VINAIGRE » ? ................................................................................................................................ b) Quel type de substance est contenue dans le vinaigre ? ................................................................................................................................ c) Comment fabrique-t-on couramment le vinaigre de vin ? ................................................................................................................................ ................................................................................................................................ ................................................................................................................................ ................................................................................................................................ d) Quelle molécule contenue dans le vin est transformée ? ........................................ e) Sachant que la chaîne carbonée reste inchangée, quelle équation chimique peut traduire la réaction de préparation du vinaigre ? Fonction Groupe fonctionnel Alcène >C=C< Alcool -COH Aldéhyde -C=O H Cétone -C=O -C- Acide -C=O carboxylique OH ................... + oxygène → .................. CAF 2002 - CHIMIE ORGANIQUE – page 68 Conclusion • L’oxydation du vin donne du vinaigre. • Le vinaigre contient de l’acide éthanoïque (acétique) : CH3-CH2OH + oxygène → CH3-C=O | OH CAF 2002 - CHIMIE ORGANIQUE – page 69 Organique ( II ) – Les alcools - Fiche n°8 Idée : L’oxydation d’un alcool donne-t-elle toujours un acide ? Action On donne : • des réactions d’oxydation des alcools par KMnO4 (K2Cr2O7) à effectuer en solution acidifiée par H2SO4 (mode opératoire : chimie organique - CTP de Frameries – 1996, page 145) • un tableau de référence Fonction Groupe fonctionnel Alcène >C=C< Alcool -COH Aldéhyde -C=O H Cétone -C=O -C- • Acide -C=O carboxylique OH deux informations : 1. Les aldéhydes sont mises en évidence par la liqueur de Fehling qui donne un précipité rouge. 2. Les cétones et aldéhydes sont mises en évidence par le test de Brady qui donne un précipité jaune. On demande : a) de compléter le tableau suivant : Réaction étudiée Observations Test de Brady Test de Fehling ............................................................... Ethanol + .......................... ............................................................... + / - + / - ............................................................... ............................................................... Butan-2-ol + ...................... ............................................................... + / - + / - ............................................................... 2-méthylpropan-2-ol + .......................................... ............................................................... + / ............................................................... ............................................................... CAF 2002 - CHIMIE ORGANIQUE – page 70 + / - b) Quel est le résultat de l’oxydation de l’alcool primaire ? ...................................................................................................................................... Ecris l’équation de la réaction avec l’éthanol: ...................................................................................................................................... c) Quel est le résultat de l’oxydation de l’alcool secondaire ? ...................................................................................................................................... Ecris l’équation de la réaction avec le butan-2-ol: ...................................................................................................................................... d) Quel est le résultat de l’oxydation de l’alcool tertiaire ? ...................................................................................................................................... Ecris l’équation de la réaction avec le 2-méthylpropan-2-ol : ...................................................................................................................................... e) Calcule le N.O. du carbone fonctionnel du produit de réaction dans chaque équation. Les oxydations sont-elles ménagées ( N.O. intermédiaire atteint) ou brutales (N.O. maximal atteint)? 1-. ............................................................................................................................ 2-............................................................................................................................. 3-............................................................................................................................. f) Que donnerait l’oxydation brutale d’un alcool ? Écris l’équation pondérée correspondant à la combustion de l’éthanol. ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... CAF 2002 - CHIMIE ORGANIQUE – page 71 Conclusion • L’oxydation d’un alcool par KMnO4 ou K2Cr2O7 en milieu sulfurique est une oxydation ménagée car le N.O. du carbone fonctionnel du produit obtenu n’est pas maximal. N.O. du C Fonctionnel CH3-CH2OH CH3-C=O | H CH3-C=O | CH3 CH3-C=O | OH O=C=O • -I +I +II +III +IV L’oxydation ménagée d’un alcool primaire → aldéhyde → acide carboxylique Ex. : CH3-CH2OH + ox. → CH3-CH=O → CH3-COOH éthanol éthanal acide éthanoïque (acétique) Remarque : si KMnO4 est présent en quantité stœchiométrique, l’oxydation peut s’arrêter au stade aldéhyde. • L’oxydation ménagée d’un alcool secondaire → cétone. Ex. : CH3-CH2-CHOH-CH3 + ox. → CH3-CH2-CO-CH3 butan-2-ol butan-2-one • L’oxydation ménagée d’un alcool tertiaire → rien (ou à chaud un alcène). • L’oxydation brutale (combustion) d’un alcool donne du dioxyde de carbone . Ex. : CH3-CH2OH + 3 O2 → 2 CO2 + 3H2O Application L’alcootest applique cette propriété des alcools primaires : il contient du dichromate de potassium orange qui oxyde l’alcool éthylique contenu dans l’haleine du contrevenant (si son taux l’alcoolémie dépasse 0,5 g/L) en acide acétique. Au cours de cette réaction, le dichromate de potassium est réduit en sels de chrome de couleur verte. CH3-CH2OH + Cr2O72- + H+ → CH3-COOH + Cr3++ H2O Equilibre cette réaction. CAF 2002 - CHIMIE ORGANIQUE – page 72 CONNAISSANCE CONSTRUITE (fiches 2 à 8) PREMIERE SEQUENCE : LES ALCOOLS • La formule générale des alcools est ROH (avec R ≡ chaîne carbonée) • Les boissons alcoolisées contiennent principalement de l’eau et de l’éthanol (alcool éthylique, formule : CH3-CH2OH) . Cet alcool est obtenu par fermentation de jus sucrés : C6H12O6 (aq) • enzymes → 2 C2H5OH (aq) + 2 CO2 (g) Informations complémentaires : 1. Le degré d’alcool : si une bière titre 8° d’alcool, cela signifie que 100 mL de bière contiennent plus ou moins 8 mL d’alcool pur. 2. L’alcool éthylique est une substance toxique qui peut provoquer une accoutumance (alcoolisme). Il est vivement recommander d’en consommer avec modération car l’abus peut conduire à des pathologies majeures (la cirrhose du foie, le cancer de la langue, de l’œsophage, troubles neurologiques, psychiatriques ... ). 3. L’alcool obtenu par fermentation puis distillation du bois est le méthanol (CH3OH). C’est l’alcool à brûler. Il est interdit d’en consommer car il peut provoquer la cécité voire la mort. !!! METHANOL = POISON TRES DANGEREUX !!! 4. La fonction alcool est présente dans de nombreuses molécules organiques telles que les glucides, le cholestérol, les polyols naturels comme la glycérine, etc. • Règles de nomenclature des alcools (ROH) 1. La chaîne carbonée principale correspond à la chaîne carbonée non ramifiée la plus longue comportant la fonction alcool. 2. Quand il y a ambiguïté sur la position du groupe OH, il est précédé du n° du carbone de la chaîne principale sur lequel il est fixé. Le sens de la numérotation sera imposé par un indice minimal de position du carbone dont le N.O. est le plus élevé: chaîne carbonée - indice - ol 3. ex. : CH3-CH2-CH2OH : propan-1-ol Le nom de la chaîne principale sera précédé des noms des substituants sériés par ordre alphabétique ("éthyl" précède "méthyl") et de leur indice. Remarque : Pour deux substituants identiques, on fera précéder le nom du substituant du préfixe "di-", pour trois, "tri"... (Ce préfixe n'est pas pris en compte dans le classement alphabétique des groupes alkyles) CAF 2002 - CHIMIE ORGANIQUE – page 73 • Isomérie Les alcools primaires, secondaires et tertiaires de même formule moléculaire sont soit des isomères de position soit des isomères de chaîne. Ex. : CH3-CH2-CH2OH et CH3-CHOH-CH3 = isomères de position CH3-CH2-CH2-CH2OH et CH3-COH-CH3 = isomères de chaîne CH3 • Relation propriétés physiques – structure 1. La température d’ébullition élevée des alcools (ROH), par rapport aux alcanes (CnH2n+2) correspondants, ne peut s’expliquer par la seule augmentation de la masse moléculaire relative. Comme la molécule d’eau, la molécule d’alcool est un dipôle. Il existe des interactions dipôle-dipôle appelées « LIAISONS HYDROGENE » ou « PONTS HYDROGENE » qui conjuguent leurs effets aux forces intermoléculaires de Van der Waals. Ces liaisons hydrogène sont plus intenses que les forces intermoléculaires de Van der Waals mais moins intenses que les liaisons covalentes. Lors des changements d’état, ces forces ne pourront être vaincues que par un apport plus important d’énergie → une température d’ébullition plus élevée. Hδ+—Oδ− .... Hδ+—Oδ− .... Hδ+—Oδ− .... Hδ+—Oδ− R R R R Liaisons hydrogène ou Ponts hydrogène 2. Par contre l’augmentation de la température d’ébullition des alcools quand la chaîne carbonée s’allonge s’explique parfaitement par l’augmentation de Mr. 3. La solubilité dans l’eau des alcools diminue quand le groupe alkyle s’allonge. Explication : Les alcanes sont des molécules non polaires, leur solubilité dans l’eau est donc très faible, ils sont dits HYDROPHOBES (« qui n’aiment pas l’eau »). Les alcools possèdent un groupe alkyle HYDROPHOBE et un groupe hydroxyle HYDROPHILE (qui aime l’eau). Tant que le groupe alkyle est de faible longueur (→ → C3 ), l’alcool est très soluble dans l’eau. Mais cette solubilité diminue avec l’allongement de la chaîne carbonée dont le caractère hydrophobe acquiert de plus en plus d’influence. CAF 2002 - CHIMIE ORGANIQUE – page 74 • Relation propriétés chimiques - structure 1. En présence de métaux peu électronégatifs, un alcool joue le rôle d’acide : ROH → RO- + H+ alcool alcoolate Ex : ROH (l) + Na (s) → RONa (dissous) + ½ H2 (g) 2. L’effet inductif donneur (I+) des groupes alkyles explique que les alcools sont des acides encore plus faibles que l’eau. Les alcoolates, bases conjuguées, sont donc plus fortes que la base hydroxyde. Eau > alcool primaire > alcool secondaire > alcool tertiaire Force décroissante de l’acide Hydroxyde < alcoolate primaire < alcoolate secondaire < alcool tertiaire Force croissante de la base 3. En présence d’acides forts comme HCl, HBr, HNO3, dont la base conjuguée est fortement nucléophile, un alcool subit une substitution aboutissant à la formation d’esters minéraux. ROH → R+ + OHEx. : CH3-CH2OH + HCl conc. → CH3-CH2Cl + H2O Mécanisme de la substitution nucléophile : Le mécanisme de substitution nucléophile peut être concertée ou non selon la nature de l’alcool : alcools primaire et secondaire : SN concertée (une étape) .. : Cl : - + Rδ+-OHδ- → [Cl...R...OH] - → Cl-R + OH.. état de transition état de transition un alcool tertiaire : SN non concertée (deux étapes) 1ère étape (lente): Rδ+-OHδ- → R+ + OH2ème étape (rapide) : R+ + Cl- → RCl Les alcools tertiaires sont plus réactionnels car le carbocation tertiaire est plus stable (effet inductif donneur des groupes alkyles). Ces réactions catalysées par les ions Zn2+ entre un alcool et HCl concentré portent le nom de TEST DE LUCAS. CAF 2002 - CHIMIE ORGANIQUE – page 75 Information compléméntaire: En présence d’acides comme H2SO4 et H3PO4, dont la base conjuguée est peu nucléophile, un alcool subit une réaction d’élimination (déshydratation). H2SO4 c. Ex. : CH3-CH2OH → CH3-CH2-O-CH2-CH3 (éther-oxyde) + H2O ( à une température plus élevée on obtiendrait CH2=CH2) H2SO4 c. CH3-CHOH-CH3 → CH2=CH-CH3 + H2O H2SO4 c. CH3-COH-CH3 | CH3 → CH2=C-CH3 + H2O | CH3 4. L’oxydation d’un alcool par KMnO4 ou K2Cr2O7 en milieu sulfurique est une oxydation ménagée car le N.O. du carbone fonctionnel du produit obtenu n’est pas maximal. N.O. du C Fonctionnel CH3-CH2OH CH3-C=O | H CH3-C=O | CH3 CH3-C=O | OH O=C=O -I +I +II +III +IV a) L’oxydation ménagée d’un alcool primaire → aldéhyde → acide carboxylique Ex. : CH3-CH2OH + ox. → CH3-CH=O → CH3-COOH éthanol éthanal acide éthanoïque (acétique) Remarque : si KMnO4 est présent en quantité l’oxydation peut s’arrêter au stade aldéhyde. stœchiométrique, b) L’oxydation ménagée d’un alcool secondaire → cétone. Ex. : CH3-CH2-CHOH-CH3 + ox . → CH3-CH2-CO-CH3 butan-2-ol butan-2-one c) L’oxydation ménagée d’un alcool tertiaire → rien (ou à chaud un alcène). d) L’oxydation brutale (combustion) d’un alcool donne du dioxyde de carbone . Ex. : CH3-CH2OH + 3 O2 → 2 CO2 + 3 H2O CAF 2002 - CHIMIE ORGANIQUE – page 76 Informations complémentaires : • Le principe de l’alcootest est basé sur la réduction des ions dichromate (Cr2O72-) par l’alcool contenu dans l’haleine d’un conducteur. La longueur de la couleur verte (Cr3+) dans l’ampoule permet de déterminer l’alcoolémie. • Le principe de l’éthylomètre est basé sur l’oxydation de l’éthanol en éthanal par l’alcool déshydrogénase. L’éthanal produit est dosé par spectrophotométrie. La lecture de l’alcoolémie est immédiate. • ATTENTION : un phénol est un dérivé aromatique dont la formule ressemble à un alcool. Il a cependant des propriétés chimiques très différentes. Exemple de phénol Formule du phénol dérivé du benzène : C6H5OH Formule développée : CH=CH CH C-OH CH-CH CAF 2002 - CHIMIE ORGANIQUE – page 77 3. Les aldéhydes et les cétones Au cours de cette séquence, nous vous proposons de répondre aux questions suivantes : • Fiche n°9 : Les molécules de sucres simples présentent-elles les mêmes fonctions chimiques ? • Fiche n°10 : Comment nomme-t-on les aldéhydes et les cétones ? • Fiche n°11 : Y a-t-il des réactions chimiques permettant de distinguer les aldéhydes et les cétones ? • Fiche n°12 : Qu’est-ce que le dextrose ? Quelle est sa structure moléculaire ? CAF 2002 - CHIMIE ORGANIQUE – page 78 Organique ( II ) – Les aldéhydes et les cétones - Fiche n°9 Idée : Les molécules de sucres simples présentent-elles les mêmes fonctions chimiques ? Action : Classer les sucres simples. On donne la formule développée de trois sucres simples isomères (C6H12O6) : le glucose, le fructose présents dans les fruits et le galactose obtenu par hydrolyse du glucide du lait, le lactose. Formules semi-développées planes (Représentations de Fischer) : le glucose : le fructose : H-C=O | H-C-OH | HO-C-H | H-C-OH | H-C-OH | CH2OH le galactose : CH2OH | C=O | HO-C-H | H-C-OH | H-C-OH | CH2OH H-C=O | H-C-OH | HO-C-H | HO-C-H | H-C-OH | CH2OH On demande 1. Quelle(s) différence(s) présentent ces trois formules? .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................……………………………………………… 2. Classe-les en deux catégories : Critère de classement : …………………………………………………………………… ère 1 catégorie e 2 catégorie 3. Entoure les groupements fonctionnels différenciant les deux catégories. 4. Quels sont ces groupements fonctionnels ? ………………………………………………………………………………………………. CAF 2002 - CHIMIE ORGANIQUE – page 79 Conclusion Outre la fonction alcool, les glucides présentent • soit une fonction aldéhyde R–CH=O ou • soit une fonction cétone R R’ R C=O; H C=O. Remarque : Les représentations de Fischer ne montrent pas clairement la différence entre les molécules de glucose et de galactose. Pour bien comprendre la différence de structure, il faut se référer aux modèles en 3D. Conventions : : liaison dans le plan de la feuille ; : liaison vers l’avant ; : liaison vers l’arrière. glucose H H galactose H OH C HO C C H C CH=O HO HO H OH C H H C C H C CH=O HO CH2OH OH OH CH2OH Les carbones entourés sont dits asymétriques car ils portent 4 atomes (ou groupes d’ atomes) différents. De plus les carbones différenciant le glucose du galactose ne sont pas superposables. Ils sont l’image l’un de l’autre dans un miroir. H HO X X C C Y Y axe de symétrie HO H X ou OH H C Y obtenu par rotation de 180° autour de l’axe CY Les composés contenant au moins un atome de carbone asymétrique possèdent des propriétés optiques particulières dont nous ne parlerons pas car elles dépassent le cadre de ce cours. CAF 2002 - CHIMIE ORGANIQUE – page 80 Application Coche la case des fonctions chimiques présentes dans les molécules odorantes suivantes ? Molécule odorante Alcool CH3-(CH2)10-CH=O (« Chanel n°5 ») H2C CH2 O=C CH-CH2-C=O (« Eau Sauvage ») CH O-CH3 C5H11 CH3-C=CH-CH2-C=CH-CH=O (essence de citron) CH3 CH3 C6H5- CH=CH-CH=O (essence de cannelle) O C CH2 H2C C-CH2-CH=CH-CH2-CH3 C-CH3 (essence de jasmin) CAF 2002 - CHIMIE ORGANIQUE – page 81 Aldéhyde Cétone Organique ( II ) – Les aldéhydes et les cétones - Fiche n°10 Idée : Comment nomme-t-on les aldéhydes et cétones ? Action : Rechercher les règles de nomenclature. On donne un tableau d’aldéhydes et de cétones. Formule Nom H-CH=O méthanal CH3-CH=O éthanal CH3-CH2-CH=O propanal CH2=CH-CH=O propénal CH2=CH-CH2-CH=O but-3-énal CH3-CO-CH3 propanone CH3-CH2-CO-CH3 butanone CH3-CH2-CO-CH2-CH3 pentan-3-one CH3-CO-CH-CH=CH2 3-méthylpent-4-én-2-one CH3 On demande d’énoncer les règles de nomenclature des aldéhydes et des cétones. • aldéhydes : .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. .................................................................................................................................. • cétones : .................................................................................................................................. ................................................................................................................................... ................................................................................................................................... ................................................................................................................................... ................................................................................................................................... ................................................................................................................................... ....…............................................................................................................................ .…............................................................................................................................... . CAF 2002 - CHIMIE ORGANIQUE – page 82 Conclusion • Règles de nomenclature des aldéhydes (-CH=O) 1. La chaîne carbonée principale correspond à la chaîne carbonée non ramifiée la plus longue comportant la fonction aldéhyde. Si le N.O. du carbone du groupe aldéhyde est le plus élevé, l’indice de position n’est pas précisé. chaîne carbonée - al ex. : CH3-CH2-CH=O : propanal 2. Le nom de la chaîne principale sera précédé des noms des substituants sériés par ordre alphabétique ("éthyl" précède "méthyl") et de leur indice de position. Remarque : Pour deux substituants identiques, on fera précéder le nom du substituant du préfixe "di-", pour trois, "tri"... (Ce préfixe n'est pas pris en compte dans le classement alphabétique des groupes alkyles) • Règles de nomenclature des cétones ( -C=O) 1. . La chaîne carbonée principale correspond à la chaîne carbonée non ramifiée la plus longue comportant la fonction cétone. La position du groupe carbonyle (C=O) est précisée par le n° du carbone dans la chaîne. Le sens de la numérotation sera imposé par un indice minimal de position : chaîne carbonée - indice - one ex. : CH3-CH2-CO-CH3 : butan-2-one 2. .. Le nom de la chaîne principale sera précédé des noms des substituants sériés par ordre alphabétique ("éthyl" précède "méthyl") et de leur indice de position. Remarque : Pour deux substituants identiques, on fera précéder le nom du substituant du préfixe "di-", pour trois, "tri"... (Ce préfixe n'est pas pris en compte dans le classement alphabétique des groupes alkyles) Application Complète le tableau suivant. Formule Nom CH3-CH=CH-CH2-CH=O .............................................................................. CH3-CO-CH2-CH3 .............................................................................. CH3-CH - CH-CH=O ........…............................………………………….. CH3 CH3 ................................................................................ 2,2-diméthylpropanal ................................................................................ 4-éthylhex-3-én-2-one ..................................................…........................ cyclopentanone CAF 2002 - CHIMIE ORGANIQUE – page 83 Organique ( II ) – Les aldéhydes et les cétones - Fiche n°11 Idée : Y a-t-il des réactions chimiques permettant de distinguer les aldéhydes et les cétones ? Action On donne 3 tests et leurs résultats avec des aldéhydes, des cétones et des glucides. Nature du test Indication de test positif Test de Tollens 1 Test de Felhing 2 Test à l’iodoforme 3 solution d’un complexe solution de tartrate de cuivre (II) solution de I2 en milieu basique. ammoniacal d’argent (I) (équivalent à Ag2O). apparition d’un miroir d’argent CH3-CO-CH3 CH3-CH2-CO-CH2-CH3 H-CH=O CH3-CH=O glucose fructose (équivalent à CuO). apparition d’un précipité rouge brique de Cu2O. apparition d’iodoforme CHI3 , solide jaune à odeur caractéristique. Test de Tollens Test de Felhing Test à l’iodoforme + + + - + + + - + + - On demande • Quel groupe d’atomes ou quelle fonction est mis(e) en évidence par chaque test ? 1. Test de Fehling: ....................................................................................... 2. Test de Tollens: ....................................................................................... 3. Test à l’iodoforme: ................................................................................... • Quelle réaction chimique peux-tu associer à ces tests ? On représente un aldéhyde par R-CHO, une cétone par R-CO-R. 4. Test de Fehling : ................................+ CuO → ........................+.................(s) 5. Test de Tollens : ................................+ Ag2O → .......................+ ................(s) 6. Test à l’iodoforme: ..............................+ I2 + OH- → R-COO- + CHI3 1 Chime organique - CTP Frameries – 1996 – démonstration n°34 Id. – démonstration n°35 3 Id – démonstration n°36 CAF 2002 - CHIMIE ORGANIQUE – page 84 2 Conclusion 1. Le test de Fehling permet la mise en évidence les aldéhydes en les oxydant en acide. La réduction du CuO en Cu2O en atteste : R-CH=O + CuO → R-COOH + Cu2O (solide rouge brique) 2. Le test de Tollens met également en évidence les aldéhydes : R-CH=O + Ag2O → R-COOH + Ag (miroir d’argent) 3. Le test à l’iodoforme met en évidence le groupement CH3-C=O : CH3-CH=O + I2 + OH- → CH3-COO- + CHI3 4. Rappel (voir alcools): Oxydation Alcool primaire Réduction Oxydation aldéhyde acide carboxylique Réduction Oxydation Alcool secondaire cétone Réduction Application On donne Des recherches récentes ont permis d’identifier 47 composés donnant le parfum des poivrons. En voici 19. 1] 2-méthylpropanal 2] 2-méthylbutanal 3] 3-méthylbutanal 4] 2,3-butandione 5] 1-pentén-3-one 6] hexanal 7] heptanal 8] trans-3-heptén-2-one 9] diméthyltrisulfure 10] 2-isobutyl-3-méthoxypyrazine 11] beta-cyclocitral 12] 1-méthyl-1H-pyrrole 13] 1-Pentén-3-ol 14] D-(+)-limonène 15] cis-2-hepténal 16] nonanal 17] 1-octén-3-ol 18] décanal 19] pentanal On demande • • • • Repère les aldéhydes et cétones et écris leurs formules. Représente les isomères cis-trans des composés 8] et 15]. Quel type d’isomérie intervient pour les composés 2] et 3] ? Quel est le numéro de l’éther-oxyde ? CAF 2002 - CHIMIE ORGANIQUE – page 85 Organique ( II ) – Les aldéhydes et les cétones - Fiche n°12 Idée : Qu’est-ce que le dextrose ? Quelle est sa structure moléculaire ? Action 1 On donne • • • Une information : le dextrose est un aliment énergétique que l’on retrouve dans certaines boissons pour sportifs ou dans des tablettes que l’on recommande de consommer en cas d’hypoglycémie. la formule moléculaire du dextrose : C6H12O6, les représentations de Fischer et de Haworth du dextrose non-cyclique (forme toute éclipsée): H-C=O CH2OH | H-C-OH OH | O H H HO-C-H | H OH H H-C-OH HO | H-C-OH H OH | CH2OH On demande 1. Quelle est l’autre appellation du dextrose ? …………………………………………. 2. Numérote les carbones dans les représentations de Fischer et de Haworth en commençant par le carbone dont le N.O. est le plus élevé (convention). Action 2 On donne Une information : en solution aqueuse, il existe un équilibre chimique entre trois isomères du dextrose. Cet équilibre est qualifié de « tautomère » car il s’agit d’un équilibre chimique entre plusieurs isomères de constitution. CH2OH CH2OH CH2OH O H H OH OH H H HO H OH H OH β- dextrose H OH H O O H H HO H OH H OH HO H OH forme ouverte du dextrose CAF 2002 - CHIMIE ORGANIQUE – page 86 H H OH α-dextrose On demande 1. Manipule le modèle moléculaire du β-dextrose pour le transformer en structure ouverte puis en α-dextrose. Rappelle-toi que les (groupements d’) atomes peuvent tourner librement autour d’une simple liaison appartenant à un ensemble non cyclique. 2. Commente le schéma de l’équilibre chimique de la page précédente pour expliquer la transformation du β-dextrose en α-dextrose. ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... 3. Explique brièvement pourquoi cet équilibre tautomère est appelé mutarotation du glucose. ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... CAF 2002 - CHIMIE ORGANIQUE – page 87 Conclusion Le dextrose est une forme du glucose C6H12O6. Il s’agit du D - (+) - glucose qui possède des propriétés optiques particulières dont nous ne parlerons pas car elles dépassent le cadre de ce cours. 1 H-C=O 2| H-C-OH 3| HO-C-H 4| H-C-OH 5| H-C-OH 6| CH2OH 6 CH2OH 5 H H OH 4 OH H HO 1 H 2 3 H O OH D-(+)-glucose car OH à droite dans la représentation de Fischer Le carbone n°1 est celui de la fonction aldéhyde car son N.O. = +I. Pour établir le lien entre les deux représentations proposées, remarquons que les (groupements d’) atomes, fixés sur les carbones 2 ,3 et 4 et situés à gauche dans la représentation de Fischer, sont placés au-dessus dans la représentation de Haworth. • La mutarotation (du latin « mutare », changer et « rotare », tourner) du glucose résulte de l’existence d’un équilibre chimique tautomère entre deux formes cycliques et une forme ouverte. il s’agit d’un équilibre chimique entre plusieurs isomères de constitution. CH2OH CH2OH CH2OH O H H OH OH H H HO H OH H OH β- dextrose H OH H O O H H HO H OH H OH HO H OH forme ouverte du dextrose H H OH α-dextrose Commentaire sur le schéma de réaction (de gauche à droite) : 1. Ouverture du cycle du β- dextrose au niveau de la liaison carbone n°1 – oxygène, 2. Régénération de la fonction aldéhyde et de la fonction alcool par transfert d’un hydrogène dans la forme ouverte, 3. Rotation de 180° autour de la liaison C1-C2, 4. Réaction entre la fonction alcool et aldéhyde pour reformer un autre cycle dans lequel le OH n°1 est sous le cycle. CAF 2002 - CHIMIE ORGANIQUE – page 88 Informations complémentaires à propos des glucides • Les glucides sont des produits naturels de formule moléculaire Cn(H2O)m, d’où leur nom courant malencontreux d’hydrates de carbone. • Ce sont des composés comportant des fonctions alcooliques et une fonction aldéhyde ou cétone. • Les végétaux en fabriquent par photosynthèse : lumière solaire 6 CO2 + 6 H2O chlorophylle C6H12O6 + 6 O2 Le glucose est un sucre simple à partir duquel les végétaux construisent des substances de masse moléculaire très élevée : la cellulose, constituant des parois des cellules végétales, ou l’amidon, réserve énergétique. Chez les animaux, le glycogène, stocké dans le foie joue un rôle semblable. • Les acides nucléiques (ADN, ARN) contiennent certains glucides. L’acide désoxyribonucléique contient du désoxyribose : CH2OH – CHOH – CHOH – CH2 – CH=O, l’acide ribonucléique contient du ribose : CH2OH – CHOH – CHOH – CHOH – CH=O. • Classification sommaire des glucides Oses = sucres simples (aldoses et cétoses) Osides = sucres complexes Structure de 3 à 8 carbones : Holosides : chaînes de sucres simples. Hétérosides : oses + substances non glucidiques Exemples : Exemples : Exemples : ADN, ARN … pentoses (C5) : ribose, désoxyribose, Diholosides (disaccharides) : saccharose = glucose + fructose, lactose = glucose + galactose hexoses (C6) : glucose, fructose, galactose… Polyholosides (polysaccharides) : amidon, cellulose … CAF 2002 - CHIMIE ORGANIQUE – page 89 CONNAISSANCE CONSTRUITE (fiches 9 à 12) DEUXIEME SEQUENCE : LES ALDEHYDES ET CETONES • Règles de nomenclature des aldéhydes (-CH=O) 1. La chaîne carbonée principale correspond à la chaîne carbonée non ramifiée la plus longue comportant la fonction aldéhyde. Si le N.O. du carbone du groupe aldéhyde est le plus élevé, l’indice de position n’est pas précisé. chaîne carbonée - al ex. : CH3-CH2-CH=O : propanal 2. Le nom de la chaîne principale sera précédé des noms des substituants sériés par ordre alphabétique ("éthyl" précède "méthyl") et de leur indice de position. Remarque : Pour deux substituants identiques, on fera précéder le nom du substituant du préfixe "di-", pour trois, "tri"... (Ce préfixe n'est pas pris en compte dans le classement alphabétique des groupes alkyles) • Règles de nomenclature des cétones ( -C=O) 1. La chaîne carbonée principale correspond à la chaîne carbonée non ramifiée la plus longue comportant la fonction cétone. La position du groupe carbonyle (C=O) est précisée par le n° du carbone dans la chaîne. Le sens de la numérotation sera imposé par un indice minimal de position : chaîne carbonée - indice - one ex. : CH3-CH2-CO-CH3 : butan-2-one 2. Le nom de la chaîne principale sera précédé des noms des substituants sériés par ordre alphabétique ("éthyl" précède "méthyl") et de leur indice de position. Remarque : Pour deux substituants identiques, on fera précéder le nom du substituant du préfixe "di-", pour trois, "tri"... (Ce préfixe n'est pas pris en compte dans le classement alphabétique des groupes alkyles) • Propriétés des aldéhydes et cétones 1. Le test de Fehling permet la mise en évidence les aldéhydes en les oxydant en acide. La réduction du CuO en Cu2O en atteste : R-CH=O + CuO → R-COOH + Cu2O (solide rouge brique) 2. Le test de Tollens met également en évidence les aldéhydes : R-CH=O + Ag2O → R-COOH + Ag (miroir d’argent) 3. Le test à l’iodoforme met en évidence le groupement CH3-C=O : CH3-CH=O + I2 + OH- → CH3-COO- + CHI3 4. Rappel (voir alcools): Oxydation Alcool primaire Réduction Oxydation aldéhyde Réduction Oxydation Alcool secondaire Réduction cétone CAF 2002 - CHIMIE ORGANIQUE – page 90 acide carboxylique • Les glucides 1. Le dextrose est une forme du glucose C6H12O6. Il s’agit du D - (+) glucose qui possède des propriétés optiques particulières dont nous ne parlerons pas car elles dépassent le cadre de ce cours. 1 H-C=O 2| H-C-OH 3| HO-C-H 4| H-C-OH 5| H-C-OH 6| CH2OH 6 CH2OH 5 H H OH 4 OH H HO 1 H 2 3 H O OH D-(+)-glucose car OH à droite dans la représentation de Fischer Le carbone n°1 est celui de la fonction aldéhyde car son N.O. = +I. Pour établir le lien entre les deux représentations proposées, remarquons que les (groupements d’) atomes, fixés sur les carbones 2 ,3 et 4 et situés à gauche dans la représentation de Fischer, sont placés au-dessus dans la représentation de Haworth. 2. La mutarotation (du latin « mutare », changer et « rotare », tourner) du glucose résulte de l’existence d’un équilibre chimique tautomère entre formes cycliques et ouverte. Il s’agit d’un équilibre chimique entre plusieurs isomères de constitution. CH2OH CH2OH CH2OH O H H OH OH H H HO H OH H OH β- dextrose H OH H O O H H HO H OH H OH HO H OH forme ouverte du dextrose H H OH α-dextrose Commentaire sur le schéma de réaction (de gauche à droite) : Ouverture du cycle du β - dextrose au niveau de la liaison unissant le carbone n°1 et l’oxygène, Régénération de la fonction aldéhyde et de la fonction alcool par transfert d’un hydrogène dans la forme ouverte, Rotation de 180° autour de la liaison C1-C2, Réaction entre la fonction alcool et aldéhyde pour reformer un autre cycle dans lequel le OH n°1 est sous le cycle. CAF 2002 - CHIMIE ORGANIQUE – page 91 3. Informations complémentaires à propos des glucides Les glucides sont des produits naturels de formule moléculaire Cn(H2O)m, d’où leur nom courant malencontreux d’hydrates de carbone. Ce sont des composés comportant des fonctions alcooliques et une fonction aldéhyde ou cétone. Les végétaux en fabriquent par photosynthèse : lumière solaire 6 CO2 + 6 H2O chlorophylle C6H12O6 + 6 O2 Le glucose est un sucre simple à partir duquel les végétaux construisent des substances de masse moléculaire très élevée : la cellulose, constituant des parois des cellules végétales, ou l’amidon, réserve énergétique. Chez les animaux, le glycogène, stocké dans le foie joue un rôle semblable. Les acides nucléiques (ADN, ARN) contiennent certains glucides. L’acide désoxyribonucléique contient du désoxyribose : CH2OH – CHOH – CHOH – CH2 – CH=O, l’acide ribonucléique contient du ribose : CH2OH – CHOH – CHOH – CHOH – CH=O. Classification sommaire des glucides Oses = sucres simples (aldoses et cétoses) Osides = sucres complexes Structure de 3 à 8 carbones : Holosides : chaînes de sucres simples. Hétérosides : oses + substances non glucidiques Exemples : Exemples : Exemples : ADN, ARN … pentoses (C5) : ribose, désoxyribose, Diholosides les montants des deux molécules (disaccharides) : sont constitués d’une succession saccharose = glucose + de [désoxy]ribose + phosphate. fructose, lactose = glucose + galactose hexoses (C6) : glucose, fructose, galactose… Polyholosides (polysaccharides) : amidon, cellulose … ADN GLUCOSE CAF 2002 - CHIMIE ORGANIQUE – page 92 3. Les acides carboxyliques Au cours de cette séquence, nous vous proposons de répondre aux questions suivantes : Fiche n°13 : Qu’est-ce qu’un acide organique ? Fiche n°14 : Comment nomme-t-on les acides carboxyliques ? Fiche n°15 : Quelles sont les relations entre la structure et les propriétés physiques des acides carboxyliques ? Fiche n°16 : Les acides carboxyliques sont-ils comparables aux acides minéraux ? Fiche n°17 : De quel(s) facteur(s) dépend la force des acides carboxyliques ? Fiche n°18 : Quel est le résultat de la réaction entre un acide carboxylique et un alcool ? Fiche n°19 : Comment nomme-t-on les esters ? Fiche n°20 : Qu’est-ce qu’un savon ? Comment le fabrique-t-on ? CAF 2002 - CHIMIE ORGANIQUE – page 93 Organique ( II ) – Les acides carboxyliques - Fiche n°13 Idée : Qu’est-ce qu’un acide organique ? Action On donne un tableau de substances acides d’origine organique : Substance Molécule organique contenue vinaigre acide éthanoïque (acétique) jus de citron acide citrique Formule de la molécule CH3-COOH CH2-COOH HO-C-COOH CH2-COOH aspirine acide acétylsalicylique CH3-COO-C6H4-COOH beurre rance acide butanoïque (butyrique) CH3-CH2-CH2-COOH bougie « stéarique » acide octadécanoïque (stéarique) CH3-(CH2)16-COOH jus de rhubarbe acide oxalique HOOC-COOH On demande • Recherche le groupement d’atomes commun à toutes ces molécules. ...................................................................................................................................... • Ecris la formule développée de l’acide éthanoïque. ...................................................................................................................................... • Ecris la formule développée du groupement fonctionnel des acides organiques carboxyliques CAF 2002 - CHIMIE ORGANIQUE – page 94 Organique ( II ) – Les acides carboxyliques - Fiche n°14 Idée : Comment nomme-t-on les acides carboxyliques ? Action On donne un tableau de noms et de formules d’acides carboxyliques Formule Nom Nom courant H-COOH acide méthanoïque acide formique CH3-COOH acide éthanoïque acide acétique CH3-CH2-COOH acide propanoïque - CH3-CH2-CH2-COOH acide butanoïque - CH3-CH2-CH-COOH acide 2-méthylbutanoïque - acide pentanoïque acide valérique CH3 CH3-CH2-CH2-CH2-COOH On demande d’énoncer les règles de nomenclature des acides carboxyliques. ........................................................................................................................................ ........................................................................................................................................ ........................................................................................................................................ ..............................................................................................................………………… ........................................................................................................................................ ........................................................................................................................................ ........................................................................................................................................ ..............................................................................................................………………… ........................................................................................................................................ ........................................................................................................................................ ........................................................................................................................................ ................................................................................................................ ………………. ........................................................................................................................................ ........................................................................................................................................ ........................................................................................................................................ ..............................................................................................................………………… CAF 2002 - CHIMIE ORGANIQUE – page 95 Conclusion OH • Règles de nomenclature des acides carboxyliques ( -C=O) 1. . La chaîne carbonée principale correspond à la chaîne carbonée non ramifiée la plus longue comportant la fonction acide. acide nom de la chaîne carbonée - oïque ex. : CH3-CH2-CH2-COOH : acide butanoïque 2. .. Le nom de la chaîne principale sera précédé des noms des substituants sériés par ordre alphabétique ("éthyl" précède "méthyl") et de leur indice de position. Remarque : Pour deux substituants identiques, on fera précéder le nom du substituant du préfixe "di-", pour trois, "tri"... (Ce préfixe n'est pas pris en compte dans le classement alphabétique des groupes alkyles) Application Complète le tableau suivant. Formule Nom CH3-CH=CH-CH2-COOH .............................................................................. CH3-CH2-CH2-CH2-COH .............................................................................. CH3-CH2-CH - CH-COOH ........…............................………………………….. CH3 CH3 ................................................................................ acide 2-méthylpropanoïque ................................................................................ acide 4-méthylhep-3-énoîque ..................................................…........................ acide octanoïque CAF 2002 - CHIMIE ORGANIQUE – page 96 Organique ( II ) – Les acides carboxyliques - Fiche n°15 Idée : Quelles sont les relations entre la structure et les propriétés physiques des acides carboxyliques ? Action On donne un graphique de températures d‘ébullition. alcanes alcools acides carboxyliques 200 150 100 θ éb./°C 50 0 -50 1 2 3 4 -100 -150 -200 Nombre d'atomes de carbone /molécule On demande • A nombre égal d’atomes de carbone, quelle est la fonction de la molécule qui présente une température toujours plus élévée que les deux autres ? Comment la structure moléculaire peut-elle justifier cette constatation ? ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... • Les acides carboxyliques sont solubles dans l’eau de C1 à C4, ensuite, leur solubilité dans l’eau diminue progressivement. Justifie cette affirmation. ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... CAF 2002 - CHIMIE ORGANIQUE – page 97 Conclusion • Les acides carboxyliques ont des températures d’ébullition plus élevées que les alcanes et les alcools correspondants. Les liaisons « hydrogène » sont donc plus fortes que dans les alcools. Les molécules d’acides carboxyliques se trouvent en grande partie sous forme de dimères cycliques. O- - -HO R-C C-R OH- - -O liaison hydrogène • D’autre part, comme ces molécules possèdent un groupe hydrophile (COOH) et un groupe hydrophobe (R), elles sont solubles dans l’eau pour autant que le groupe R ne soit pas trop long : la solubilité dans l’eau est totale jusqu’en C4 , puis elle diminue et devient nulle en C9. CAF 2002 - CHIMIE ORGANIQUE – page 98 Organique ( II ) – Les acides carboxyliques - Fiche n°16 Idée : Les acides carboxyliques sont-ils comparables aux acides minéraux ? Action 1 On donne deux expériences à réaliser schéma Observations méthylorange …………………………………………….. ……………………………………………… HCl 0,1 mol.dm ……………………………………………… -3 ……………………………………………… méthylorange …………………………………………….. ……………………………………………… ……………………………………………… CH3COOH 0,1 -3 mol.dm ……………………………………………… On demande 1. Quel est l’ion mis en évidence par le méthylorange ? 2. Ecris l’équation de dissociation ionique de l’acide éthanoïque (acétique) dans l’eau. ………………………………………………………………………………………………… Action 2 On donne deux expériences de conductivité à réaliser. schéma observations …............................................................... .................................................................. 6V= .................................................................. .................................................................. .................................................................. .................................................................. .................................................................. .................................................................. .................................................................. HCl 1 mol.dm -3 .................................................................. CAF 2002 - CHIMIE ORGANIQUE – page 99 schéma observations .................................................................. .................................................................. 6V= .................................................................. .................................................................. .................................................................. .................................................................. .................................................................. .................................................................. .................................................................. CH3COOH -3 1 mol.dm .................................................................. On demande • • Note tes observations L’acide éthanoïque est-il fort ou faible ? Justifie ta réponse. ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... CAF 2002 - CHIMIE ORGANIQUE – page 100 Conclusion • • Comme les acides minéraux, les acides carboxyliques s’hydrolysent : ils libèrent dans l’eau des ions H+ (aq) ou plus correctement des ions H3O+. Cette hydrolyse est le résultat d’une dissociation ionique incomplète, car la conductivité d’une solution relativement concentrée est assez faible : Ex. : CH3-COOH + H2O ∆ CH3-COO- + H3O+ Cet équilibre chimique est caractérisé par une constante d’acidité Ka. Acide CH3-COOH CH3-CH2-COOH Ka (à 25°C) 1,8 . 10-5 1,25 . 10-5 pKa = - log10Ka 4,75 4,9 Remarque : L’acidité des acides carboxyliques est faible par rapport aux acides minéraux forts. Elle est cependant forte pour un composé organique car l’ion carboxylate, stabilisé par résonance, favorise la dissociation ionique de la molécule d’acide. O- O R-C R-C O- O CAF 2002 - CHIMIE ORGANIQUE – page 101 Organique ( II ) – Les acides carboxyliques - Fiche n°17 Idée : De quel(s) facteur(s) dépend la force des acides carboxyliques ? Action 1 On donne un tableau de constantes d’acidité Acide carboxylique H-COOH CH3-COOH CH2Cl-COOH CHCl2-COOH CCl3-COOH CH3-CH2-COOH Ka (à 25°C) 1,8 . 10-4 1,8 . 10-5 1,2 . 10-3 5,0 . 10-2 2,0 . 10-1 1,3 . 10-5 On demande • Classe ces acides par force croissante. ...................................................................................................................................... • Compare l’acidité des acides formique, acétique et propanoïque. ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... • Compare l’acidité des acides acétique, monochloracétique, dichloracétique et trichloracétique. ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... • Justifie la différence d’acidité de ces substances à la lumière des effets inductifs. ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... CAF 2002 - CHIMIE ORGANIQUE – page 102 Conclusion La force des acides carboxyliques dépend de : • la nature de la chaîne carbonée, plus elle est grande, plus l’acidité diminue. l’effet inductif répulsif (effet I+) des groupes alkyles en est la cause : H-COOH > CH3-COOH > CH3-CH2-COOH. • la présence d’atomes électronégatifs dont l’effet inductif attractif (effet I-) augmente l’acidité de la molécule. CCl3-COOH > CHCl2-COOH > CH2Cl-COOH > CH3-COOH. Schémas explicatifs O I+ CH3 → C Ka = 1,8 x 10-5 (à 25°C) O H augmentation de la densité électronique au niveau de O ; accentuation du caractère négatif de O ; H+ est davantage retenu ; libération de H+ défavorisée ; force de l’acide est réduite (Ka petit). I- O Cl CH2 Ka = 1,2 x 10-3 (à 25°C) C O H diminution de la densité électronique au niveau de O ; atténuation du caractère négatif de O ; H+ est moins retenu ; libération de H+ favorisée ; force de l’acide est augmentée (Ka plus élevé). CAF 2002 - CHIMIE ORGANIQUE – page 103 Organique ( II ) – Les acides carboxyliques - Fiche n°18 Idée : Quel est le résultat de la réaction entre un acide carboxylique et un alcool? Action On donne une expérience à réaliser Schéma descriptif de l’expérience • Mode opératoire Introduire dans un tube à essais 6 mL d’éthanol absolu, 8 mL d’acide éthanoïque et un grain de pierre ponce. Sentir ce mélange. • Ajouter doucement 2 mL de sulfate d’hydrogène concentré et homogénéiser (noter l’échauffement). • Fermer le tube par un bouchon traversé d’un tube en verre (50 cm) et chauffer à reflux au bain-marie pendant au moins 5 minutes. • Refroidir puis verser dans une ampoule à décanter contenant 25 mL de solution saturée de NaCl. • Décanter et recueillir la phase organique dans un tube à essais contenant quelques grains de CaCl2. On obtient environ 7 ml d’ester. On demande • Quelle était l’odeur du mélange initial ? ...................................................................................................................................... • Décris l’odeur du produit obtenu après décantation : ...................................................................................................................................... • Quel est le rôle du CaCl2 utilisé après la décantation ? ...................................................................................................................................... O • Sachant qu’un ester répond à la formule générale R-C-OR’, écris l’équation de la réaction d’estérification de l’acide éthanoïque par l’éthanol et catalysée par H2SO4 conc. ...................................................................................................................................... CAF 2002 - CHIMIE ORGANIQUE – page 104 Conclusion • L’estérification est une réaction catalysée par H2SO4: R-COOH + R’OH H + R-COOR’ + H20 H + Ex. : CH3COOH + CH3-CH2OH ∆ CH3-COOCH2-CH3 + H2O Ethanoate (acétate) d’éthyle Remarques : 1. Le mécanisme de la réaction nous apprend que l’oxygène présent dans l’eau, produit de réaction, provient de l’acide et non de l’alcool. 2. La réaction d’estérification est incomplète, c’est un équilibre chimique : ainsi pour une mole d’acide et une mole d’alcool, un alcool primaire donnera 0,67 mole d’ester, un alcool secondaire donnera 0,60 mole d’ester, un alcool tertiaire donnera 0,05 mole d’ester. • Informations complémentaires : les esters dans la vie courante 1. Certaines essences végétales contiennent des esters : Formule CH3-CH2-CH2-COOCH2-CH3 CH3-COOCH2-CH2-CH(CH3)2 CH3-COO(CH2)7-CH3 CH3-(CH2)3-COO(CH2)7-CH3 nom butyrate d’éthyle acétate d’isoamyle acétate d’octyle valérate d’octyle odeur ananas poire orange cognac avec note de mandarine 2. Les lipides sont des triesters de la glycérine (CH2OH-CHOH-CH2OH) Ils répondent à la formule générale R1-COO-CH2 R2-COO-CH R3-COO-CH2 R1, R2, R3 sont des chaînes carbonées provenant d’acides gras. Formule de l’acide gras CH3-(CH2)14-COOH CH3-(CH2)16-COOH CH3-(CH2)7-CH=CH-(CH2)7-COOH CH3-CH2-(CH=CH-CH2)3-(CH2)6-COOH CH3-(CH2)4-CH=CH-CH2-CH=CH-(CH2)7-COOH Nom acide stéarique acide palmitique acide oléique acide linolénique acide linoléique Substance courante blanc de bœuf ou de mouton huile d’olive huile de lin huile de soja Si les chaînes carbonées (R) sont saturées, le lipide est une graisse (solide) qui présentent l’inconvénient de favoriser l’apparition de cholestérol … si les chaînes carbonées sont insaturées, il s’agit d’une huile (liquide). L’acide oléique est dit « monoinsaturé » car il ne contient qu’une double liaison, alors que l’acide linolénique est dit « polyinsaturé » car il en contient plusieurs. On peut transformer les huiles végétales en margarine (solides) par hydrogénation partielle ou totale. CAF 2002 - CHIMIE ORGANIQUE – page 105 Organique ( II ) – Les acides carboxyliques - Fiche n°19 Idée : Comment nomme-t-on les esters ? Action On donne un tableau de noms et de formules d’esters Formule Nom H-COOCH3 Méthanoate de méthyle CH3-COOCH3 Ethanoate de méthyle CH3-CH2-COOCH2-CH3 Propanoate d’éthyle (CH3)2-CH-CH2-CH2-COOCH3 Méthyl-4-pentanoate de méthyle On demande d’énoncer les règles de nomenclature des esters. ........................................................................................................................................ ........................................................................................................................................ ........................................................................................................................................ ..............................................................................................................………………… ........................................................................................................................................ ........................................................................................................................................ ........................................................................................................................................ ..............................................................................................................………………… ........................................................................................................................................ ........................................................................................................................................ ........................................................................................................................................ ................................................................................................................ ………………. ........................................................................................................................................ ........................................................................................................................................ ........................................................................................................................................ ..............................................................................................................………………… CAF 2002 - CHIMIE ORGANIQUE – page 106 Organique ( II ) – Les acides carboxyliques - Fiche n°20 Idée : Qu’est-ce qu’un savon ? Comment le fabrique-t-on ? Action On donne un mode opératoire pour la fabrication d’un savon dur (*) Schéma descriptif de l’expérience Mode opératoire • Dans un ballon de 250 mL, on introduit -1 20 mL de NaOH 10 mol.L , 15 mL d’huile alimentaire, 20 mL d’éthanol à Huile + soude caustique + éthanol + pierre ponce 90° et quelques grains de pierre ponce. • Chauffer à reflux le mélange pandant environ 15 minutes. • Verser ensuite le mélange obtenu dans un bécher contenant environ 100 mL de solution concentrée de NaCl pour que le savon précipite. • Filtrer sur filtre Büchner, rincer à l’eau distillée et sécher sur verre de montre. ATTENTION : ce savon ne doit pas être utilisé car il contient encore de la soude caustique. On demande 1. Sachant qu’une huile alimentaire est un triester de la glycérine, écris l’équation de saponification (inverse de la réaction d’estérification) R-COO-CH2 R-COO-CH + … NaOH → ……………………………………………………. R-COO-CH2 2. Quelle est la formule générale d’un savon dur ? ………………………………. 3. Explique le rôle de la solution concentrée de NaCl dans la précipitation du savon. ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... ...................................................................................................................................... (*) CHIMIE Term S – Durupthy – Hachette Éducation (1995) CAF 2002 - CHIMIE ORGANIQUE – page 107 Conclusion • Un savon est un sel d’acide gras (acide carboxylique à longue chaîne carbonée). • Formule générale d’un savon dur R-COONa. • La réaction de préparation du savon est une SAPONIFICATION : R-COO-CH2 CH2-OH R-COO-CH + 3 NaOH → 3 R-COONa + CH-OH R-COO-CH2 CH2-OH Triester (huile) • sel d’acide gras (savon) + glycérine Informations complémentaires : les savons et détergents dans la vie courante 1. Les savons de toilette sont des savons durs (sel de sodium). 2. Le savons vert est un savon mou obtenu à partir d’huile de palme et de potasse (hydroxyde de potassium). Il est donc très corrosif pour la peau et réservé à l’entretien des surfaces (sols, murs …). 3. Les détergents n’appartiennent pas à la famille des savons. Les plus courants sont des agents anioniques tels que les sulfates d’alkyle R-OSO3- Na+. 4. Les savons et les détergents sont des agents tensioactifs qui diminuent la tension superficielle de l’eau. Cette propriété leur confère un pouvoir détergent ou émulsionnant ou mouillant ou encore moussant. Représentation d’une molécule de savon : O O- Chaîne carbonée hydrophobe Groupe hydrophile ou plus simplement Représentation d’une émulsion d’huile dans l’eau savonneuse micelle goutelette d’huile eau CAF 2002 - CHIMIE ORGANIQUE – page 108 Na+ CONNAISSANCE CONSTRUITE (fiches 13 à 20) TROISIEME SEQUENCE : LES ACIDES CARBOXYLIQUES OH • Règles de nomenclature des acides carboxyliques ( R-C=O) La chaîne carbonée principale correspond à la chaîne carbonée non ramifiée la plus longue comportant la fonction acide. acide nom de la chaîne carbonée - oïque ex. : CH3-CH2-CH2-COOH : acide butanoïque . Le nom de la chaîne principale sera précédé des noms des substituants sériés par ordre alphabétique ("éthyl" précède "méthyl") et de leur indice de position. Remarque : Pour deux substituants identiques, on fera précéder le nom du substituant du préfixe "di-", pour trois, "tri"... (Ce préfixe n'est pas pris en compte dans le classement alphabétique des groupes alkyles) Relation propriétés physiques - structure alcanes alcools acides carboxyliques 200 150 100 θ éb./°C • 50 0 -50 1 2 3 4 -100 -150 -200 Nombre d'atomes de carbone /molécule Les acides carboxyliques ont des températures d’ébullition plus élevées que les alcanes et les alcools correspondants. Les liaisons « hydrogène » sont donc plus fortes que dans les alcools. Les molécules d’acides carboxyliques se trouvent en grande partie sous forme de dimères cycliques. O- - -HO R-C C-R OH- - -O liaison hydrogène CAF 2002 - CHIMIE ORGANIQUE – page 109 D’autre part, comme ces molécules possèdent un groupe hydrophile (COOH) et un groupe hydrophobe (R), elles sont solubles dans l’eau pour autant que le groupe R ne soit pas trop long : la solubilité dans l’eau est totale jusqu’en C4 , puis elle diminue et devient nulle en C9. • Propriétés chimiques Les acides carboxyliques s’hydrolysent : ils libèrent dans l’eau des ions H+ (aq) ou H3O+. Cette hydrolyse est le résultat d’une dissociation ionique incomplète car la conductivité d’une solution relativement concentrée est assez faible : Ex. : CH3-COOH + H2O CH3-COO- + H3O+ Cet équilibre chimique est caractérisé par une constante d’acidité Ka. Acide CH3-COOH CH3-CH2-COOH Ka (à 25°C) 1,8 . 10-5 1,25 . 10-5 pKa = - log10Ka 4,75 4,9 Remarque : L’acidité des acides carboxyliques est faible par rapport aux acides minéraux forts. Elle est cependant forte pour un composé organique car l’ion carboxylate, stabilisé par résonance, favorise la dissociation ionique de la molécule d’acide. O- O R-C R-C O- O La force des acides carboxyliques dépend de : la nature de la chaîne carbonée, plus elle est grande, plus l’acidité diminue. l’effet inductif répulsif des groupes alkyles en est la cause : H-COOH > CH3-COOH > CH3-CH2-COOH. la présence d’atomes électronégatifs dont l’effet inductif attractif augmente l’acidité de la molécule. CCl3-COOH > CHCl2-COOH > CH2Cl-COOH > CH3-COOH. L’estérification est une réaction catalysée par H2SO4: R-COOH + R’OH H + R-COOR’ + H20 H Ex. : CH3COOH + CH3-CH2OH + CH3-COOCH2-CH3 + H2O Ethanoate (acétate) d’éthyle CAF 2002 - CHIMIE ORGANIQUE – page 110 Remarques : 1. Le mécanisme de la réaction nous apprend que l’oxygène présent dans l’eau, produit de réaction, provient de l’acide et non de l’alcool. 2. La réaction d’estérification est incomplète, c’est un équilibre chimique : ainsi pour une mole d’acide et une mole d’alcool, o un alcool primaire donnera 0,67 mole d’ester, o un alcool secondaire donnera 0,60 mole d’ester, o un alcool tertiaire donnera 0,05 mole d’ester. • Informations complémentaires : les esters dans la vie courante 1. Certaines essences végétales contiennent des esters : Formule CH3-CH2-CH2-COOCH2-CH3 CH3-COOCH2-CH2-CH(CH3)2 CH3-COO(CH2)7-CH3 CH3-(CH2)3-COO(CH2)7-CH3 nom butyrate d’éthyle acétate d’isoamyle acétate d’octyle valérate d’octyle odeur ananas poire orange cognac avec note de mandarine 2. Les lipides sont des triesters de la glycérine (CH2OH-CHOH-CH2OH) Ils répondent à la formule générale R1-COOCH2 R2-COOCH R3-COOCH2 R1, R2, R3 sont des chaînes carbonées provenant d’acides gras. Formule de l’acide gras CH3-(CH2)14-COOH CH3-(CH2)16-COOH CH3-(CH2)7-CH=CH-(CH2)7-COOH CH3-CH2-(CH=CH-CH2)3-(CH2)6-COOH CH3-(CH2)4-CH=CH-CH2-CH=CH-(CH2)7-COOH Nom acide stéarique acide palmitique acide oléique acide linolénique acide linoléique Substance courante blanc de bœuf ou de mouton huile d’olive huile de lin huile de soja Si les chaînes carbonées (R) sont saturées, le lipide est une graisse (solide) qui présente l’inconvénient de favoriser l’apparition de cholestérol … si les chaînes carbonées sont insaturées, il s’agit d’une huile (liquide). L’acide oléique est dit « monoinsaturé » car il ne contient qu’une double liaison, alors que l’acide linolénique est dit « polyinsaturé » car il en contient plusieurs. On peut transformer les huiles végétales en margarine (solides) par hydrogénation partielle ou totale. CAF 2002 - CHIMIE ORGANIQUE – page 111 Les savons • Un savon est un sel d’acide gras (acide carboxylique à longue chaîne carbonée). • Formule générale d’un savon dur R-COONa. • La réaction de préparation du savon est une SAPONIFICATION : R-COO-CH2 CH2-OH R-COO-CH + 3 NaOH → 3 R-COONa + CH-OH R-COO-CH2 CH2-OH Triester (huile) • sel d’acide gras (savon) + glycérine Informations complémentaires : les savons et détergents dans la vie courante 1. Les savons de toilette sont des savons durs (sel de sodium). 2. Le savons vert est un savon mou obtenu à partir d’huile de palme et de potasse (hydroxyde de potassium). Il est donc très corrosif pour la peau et réservé à l’entretien des surfaces (sols, murs …). 3. Les détergents n’appartiennent pas à la famille des savons. Les plus courants sont des agents anioniques tels que les sulfates d’alkyle R-OSO3- Na+. 4. Les savons et les détergents sont des agents tensioactifs qui diminuent la tension superficielle de l’eau. Cette propriété leur confère un pouvoir détergent ou émulsionnant ou mouillant ou encore moussant. Représentation d’une molécule de savon : O O- Chaîne carbonée hydrophobe Groupe hydrophile ou plus simplement Représentation d’une émulsion d’huile dans l’eau savonneuse micelle goutelette d’huile eau CAF 2002 - CHIMIE ORGANIQUE – page 112 Na+